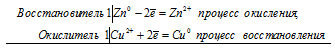- Решение задач по химии на коррозию металлов
- а) Электрохимические процессы при реакции цинка и сульфата меди
- б) Электрохимические процессы при реакции железа и сульфата меди
- Уравнение коррозии железа с медью в нейтральной среде
- Коррозия металлов
- Теоретическая часть
- Практическая часть
- Электрохимическая коррозия
- Опыт №5. Ионы Cl как активные стимуляторы коррозии.
- Цель работы: ознакомиться с влиянием ионов Cl на процесс коррозии.
- Вывод: Ионы Cl являются активными стимуляторами коррозии. При добавлении NaCl процесс коррозии усиливается, реакция идёт быстрее.
- Опыт №6. Коррозия железа в различных электролитах
- Защита металлов от коррозии
- Цель работы – ознакомление с основными способами защиты металлов от коррозии.
- Разнообразные способы защиты металлов и сплавов от коррозии можно разделить на три основных вида; нанесение покрытий, обработка среды и электрохимическая защита.
- Практическая часть
- Опыт №1. Коррозия оцинкованного и лужёного железа в кислом растворе.
- Лабораторная работа по химии №4
- 📽️ Видео
Видео:Электрохимическая коррозия (алюминий — медь)Скачать

Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ — восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 
Катодный процесс: Cu 2+ + 2 
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, — это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 

Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Анод: Zn 0 -2 
Катод: 1/2O2 + H2O + 2 
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 
Катодный процесс: в кислой среде: 2Н + + 2 

В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Видео:Электрохимическая коррозияСкачать

Уравнение коррозии железа с медью в нейтральной среде
8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом ( E ° = –0,44В), а медь – катодом ( E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Видео:Коррозия металла. Химия – ПростоСкачать

Коррозия металлов
Цель работы — ознакомление с химической и электрохимической коррозией металлов.
Видео:Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Теоретическая часть
Коррозией металлов называется самопроизвольное разрушение металлов, происходящее в результате химического или электрохимического воздействия внешней среды.
По механизму процесса различают коррозию химическую и электрохимическую.
Химическая коррозия не сопровождается возникновением электрического тока и происходит при взаимодействии с металлами сухих газов и жидкостей, не являющихся электролитами.
Практически химическая коррозия проявляется чаще всего как газовая коррозия металлов при высоких температурах. При этом металл химически взаимодействует с газами O2; H2O; CO2;SO2;H2S и др. На поверхности металла образуется пленка продуктов коррозии, которая чаще всего представляет собой оксиды металлов. Если пленка препятствует проникновению коррозионной среды к поверхности металла, её называют защитной. Начальная стадия образования защитной пленки — чисто химический процесс. Дальнейшее течение процесса будет определяться скоростью диффузии атомов кислорода снаружи и ионов металла изнутри через защитную пленку.
При нагревании металлов (железа, меди) на воздухе тонкие, невидимые пленки оксидов начинают расти, и при толщине 400-500 Å становятся видимыми благодаря интерференции в них световых лучей. Вследствие этого возникают так называемые цвета побежалости: желтый, оранжевый, красный, фиолетовый, синий. Цвет пленки определяется её толщиной, а толщина зависит от температуры нагрева и от времени выдержки при данной температуре.
При дальнейшем нагреве железо и обычная углеродистая сталь быстро покрываются продуктами газовой коррозии, так называемой окалиной. Окалина имеет сложное строение. Толщина слоев различных оксидов в окалине зависит от условий коррозии: температуры, продолжительности нагревания и состава коррозионной среды. При температурах, превышающих 575 С, окалина состоит из слоев оксидов: FeO, Fe3O4, Fe2O3 (с промежуточными слоями из твердых растворов, соприкасающихся оксидов). К поверхности железа ближе других примыкает слой монооксида железа FeO, или вюстита. Вюстит имеет решетку с избытком анионов (ионов кислорода) и недостатком катионов (ионов железа). Наличие незанятых катионных узлов облегчает диффузию. Последующие слои представляют собой магнетит Fe3O4 и гематит Fe2O3. Поскольку окалина состоит главным образом из вюстита, она не обладает защитными свойствами.
При нагревании железа в атмосфере водяного пара протекает процесс окисления железа, водород при этом выделяется в свободном состоянии.
На поверхности меди при нагревании её на воздухе также образуется пленка продуктов коррозии, состоящая из различных оксидов. К поверхности металла примыкает слой полуокиси меди Cu2O, имеющий, подобно вюститу, решетку с недостатком катионов. Наружным слоем является слой монооксида меди CuO.
Наиболее распространена электрохимическая коррозия. Она протекает в электролитах и во влажных газах и представляет собой окислительно-восстановительные процессы на границе металл-электролит аналогично процессам, происходящим в гальваническом элементе.
По условиям протекания различают следующие виды электрохимической корро
1) коррозию в электролитах;
2) атмосферную коррозию;
4) коррозию под напряжением и др.
Чаще всего встречается атмосферная коррозия. На поверхности технических металлов и сплавов в атмосферных условиях всегда есть тонная пленка влаги, адсорбированной из воздуха. Эта пленка в результате растворения в ней газов, содержащихся в воздухе (главным образом углекислого газа), становится электропроводной. Это обусловливает работу микрогальванических элементов на поверхности металла, где роль анодов играют структурные составляющие металла, обладающие более отрицательным электродным потенциалом (например, участки феррита), а роль катодов — структурные составляющие или примеси, электродный потенциал которых более электроположителен (например, цементит Fe3C). Коррозионные элементы могут возникнуть при контакте двух различных, а также в результате любой микронеоднородности металлической поверхности: ликвация твердого раствора, различная ориентация отдельных зерен металла, наличие включений, границ зерен и другие факторы. Если на поверхности металла существует электропроводная пленка оксидов, сплошность которой нарушена, т. е. имеются оголенные участки металлической поверхности или поры в пленке, это также может являться причиной возникновения коррозионного элемента; при коррозии пленка будет представлять собой катод, металл-анод.
При электрохимической коррозии разрушению подвергаются лишь анодные участки поверхности. Здесь происходит переход ионов металла в электролит.
При коррозии железа на аноде протекает следующий процесс:
На катодных участках поверхности в нейтральных и щелочных средах осуществляется процесс ионизации кислорода, растворенного в электролите или в тонкой пленке влаги.
В подавляющем большинстве коррозионных процессов происходит именно эта реакция. В кислых средах на катоде разряжаются ионы водорода
Обе приведенные катодные реакции могут протекать совместно в зависимости от характера коррозионной среды и потенциалов электродов. Продукты электродных процессов в толще электролита или на поверхности металла в пленке влаги обычно взаимодействуют с образованием гидроксида железа (II) который в присутствии влаги и кислорода окисляется в гидроксид железа (III)
Состав продуктов коррозии стали (ржавчины) является неопределенным и может быть выражен общей формулой
При работе коррозионного элемента сила тока с течением времени уменьшается в результате изменения потенциалов электродов. Это явление называется поляризацией. Анодная поляризация — это смещение потенциала анода в положительную сторону в результате изменения концентрации ионов и, главным образом, вследствие образования на аноде оксидных пленок (явление пассивности). Катодная поляризация — это смещение потенциала катода в отрицательную сторону в результате затруднений в протекании катодной реакции (перенапряжение) и изменение концентрации кислорода у катода. Исследование процессов поляризации требует применения специальной аппарату ры.
Состав коррозионной среды оказывает больное влияние на скорость коррозии. Коррозия протекает тем более интенсивно, чем выше в растворе концентрация ионов водорода. Иную роль при коррозии железа играют ионы гидроксида. Эти ноны образуют с ионами железа труднорастворимые в щелочных средах гидроксиды. По этой причине железо в щелочных средах не корродирует.
Коррозия металлов может быть вызвана неравномерной концентрацией кислорода в растворе. Участки металлической поверхности, к которым доступ кислорода затруднен, являются анодными и подвергаются разрушению, в то время как участки поверхности, к которым доступ кислорода облегчен, играют роль катодов. Здесь легко протекает процесс ионизации находящегося в растворе кислорода.
Электрохимическая коррозия может быть значительно ускорена в присутствии небольшого количества веществ, называемых в соответствии с характером их действия ускорителями или стимуляторами.
Активными стимуляторами коррозии являются ионы галогенов. На поверхности металла в атмосферных условиях имеется оксидная пленка, которая может обладать защитным характером. Ионы галогена, адсорбируются на пленке и вытесняют кислород, как бы образуя хлорид, который переходит в раствор. В пленке возникают поры, облегчающие коррозию.
Состав коррозионной среды оказывает больное влияние на скорость коррозии. Коррозия протекает тем более интенсивно, чем выше в растворе концентрация ионов водорода. Иную роль при коррозии железа играют ионы гидроксида. Эти ноны образуют с ионами железа труднорастворимые в щелочных средах гидроксиды. По этой причине железо в щелочных средах не корродирует.
Коррозия металлов может быть вызвана неравномерной концентрацией кислорода в растворе. Участки металлической поверхности, к которым доступ кислорода затруднен, являются анодными и подвергаются разрушению, в то время как участки поверхности, к которым доступ кислорода облегчен, играют роль катодов. Здесь легко протекает процесс ионизации находящегося в растворе кислорода.
Электрохимическая коррозия может быть значительно ускорена в присутствии небольшого количества веществ, называемых в соответствии с характером их действия ускорителями или стимуляторами.
Активными стимуляторами коррозии являются ионы галогенов. На поверхности металла в атмосферных условиях имеется оксидная пленка, которая может обладать защитным характером. Ионы галогена, адсорбируются на пленке и вытесняют кислород, как бы образуя хлорид, который переходит в раствор. В пленке возникают поры, облегчающие коррозию.
Видео:Эксперимент «Коррозия железа» из набора «Коррозия»Скачать

Практическая часть
Электрохимическая коррозия
Опыт №1. Коррозия металлов при высоких температурах.
Цель работы: ознакомиться с коррозией металлов при высоких температурах.
Ход работы: С помощью наждачной бумаги хорошо очистить поверхность стальной пластинки. Взять тигельными щипцами стальную пластинку за один конец и нагрейте её с другого конца в бесцветном пламени горелки. При нагревании пластинку держать неподвижно относительно пламени горелки. Аналогичный опыт проделать с медной пластинкой.
Наблюдения: Сначала наблюдаем появление цветов побежалости. При более длительном нагревании поверхность пластинки принимает серый цвет окалины.
При проведении данного опыта с медной пластинкой наблюдаем, как цвета побежалости принимают чёрный цвет вследствие образования толстых слоёв непрозрачных оксидов меди.
Вывод: При высоких температурах процесс коррозии усиливается. Железная окалина имеет серый цвет, медная – чёрный.
Опыт №З. Коррозия при контакте двух различных металлов.
Цель работы: ознакомиться с коррозией при контакте двух различных металлов.
Ход работы: 
В трубку, согнутую под углом, налит разбавленный раствор серной кислоты.
В одно колено трубки вставляется полоса цинка. В другое колено вставляем медную проволоку, не соприкасая её с цинком.
Наблюдения: Выделение водорода на меди не наблюдается. Приводим металлы в соприкосновение. Наблюдаем выделение водорода на меди при контакте металлов. Наблюдаем выделение водорода.
Вывод: При контакте металлов выделяется водород.
Опыт №4. Образование микро коррозийных элементов.
Цель работы: ознакомиться с образованием микро коррозионных элементов.
Ход работы: К кусочку гранулированного цинка прилили несколько миллилитров разбавленной серной кислоты, прилили в пробирку несколько капель раствора сульфата меди
Наблюдения: Сначала началось медленное выделение водорода. После того, как прилили в пробирку несколько капель раствора сульфата меди, увеличилась скорость выделения водорода. Медный купорос (СuSO4) изменяет цвет с глубоко синего на голубой. Zn из белого покрывается плёнкой (Cu).
Вывод: При взаимодействии цинка с серной кислотой и сульфатом меди, цинк покрывается плёнкой из меди.
Опыт №5. Ионы Cl как активные стимуляторы коррозии.
Цель работы: ознакомиться с влиянием ионов Cl на процесс коррозии.
Ход работы: В две пробирки поместить небольшое количество алюминиевых стружек и прилить к ним раствор сульфата меди, слегка подкисленный серной кислотой. В одну пробирку добавить несколько капель раствора NaCl.
Наблюдения: В первый момент ничего не наблюдается. После добавления NaCl начинается реакция. Наблюдается выделение пузырьков. Выделяется медь. В пробирке с NaCl процесс ускорился при выделении меди.
Вывод: Ионы Cl являются активными стимуляторами коррозии. При добавлении NaCl процесс коррозии усиливается, реакция идёт быстрее.
Опыт №6. Коррозия железа в различных электролитах
Цель работы: ознакомиться с коррозией железа в различных электролитах.
Ход работы: Наливаем в пять пробирок до 1/4 объема:
1. дистиллированной воды
2. 10% раствора хлорида натрия
3. 10% раствора хлорида магния
4. 10% раствора едкого натра
В каждую пробирку погружаем одновременно по железному гвоздю или по куску железной проволоки приблизительно одинаковой длины. Добавляем растворы красной или желтой кровяной соли.
Наблюдения: Растворы во всех пробирках сначала прозрачные, бесцветные.
1. Раствор остаётся прозрачным, бесцветным. Практически ничего не наблюдается, т. к. коррозия незначительная.
2. Окрашивание раствора. Интенсивная коррозия.
3. Окрашивание раствора. Интенсивность коррозии повышается.
4. Коррозии нет, т. к. NaOH является ингибитором коррозии.
5. Наиболее сильное окрашивание раствора. Наибольшая интенсивность коррозии, т. к. Cl-окислитель.
Вывод: NaOH является ингибитором коррозии; Cl является окислителем.
Опыт №7. Роль кислорода воздуха в процессе атмосферной коррозии железа.
Цель работы: ознакомиться с ролью кислорода воздуха в процессе коррозии железа.
Ход работы: Собрали прибор по рис. 3. В колбу, смоченную раствором поваренной соли, поместили железные стружки, предварительно промытые и обезжиренные. Закрыли колбу пробкой с газоотводной трубкой. Конец трубки поместили в стакан с подкрашенной водой.
Наблюдения: По истечении некоторого времени подкрашенная вода в стакане начинает подниматься. Процесс протекает медленно.
Fe + O2 +H2O Fe + OH
Вывод: Кислород воздуха влияет на атмосферную коррозию железа, т. к. подкрашенная вода поднимается.
Опыт №8. Коррозия стали в результате неравномерной аэрации.
Цель работы: ознакомиться с коррозией стали в результате неравномерной аэрации.
Ход работы: На поверхность стальной пластинки наносим каплю ферроксил-индикатора, имеющего в 1л:
а) хлорида натрия 15 г;
б) агар-агара 2 г;
в) красной кровяной соли 10 г;
г) спиртового раствора фенолфталеина 1 мл.
Наблюдения: При нанесении капли ферроксил-индикатора на поверхность стальной пластинки она имеет синий цвет. По истечении некоторого времени цвет капли изменяется на розовый. Особо интенсивное окрашивание наблюдается по краю капли.
Fe + O2 +H2O Fe + OH
Вывод: Цвет капли ферроксил-индикатора изменяется на розовый, происходит коррозия стали в результате неравномерной аэрации.
Общий вывод: При высоких температурах процесс коррозии усиливается. Железная окалина имеет серый цвет, медная – чёрный. При контакте металлов выделяется водород. При взаимодействии цинка с серной кислотой и сульфатом меди, цинк покрывается плёнкой из меди. Ионы Cl являются активными стимуляторами коррозии. При добавлении NaCl процесс коррозии усиливается, реакция идёт быстрее. NaOH является ингибитором коррозии; Cl является окислителем. Кислород воздуха влияет на атмосферную коррозию железа, т. к. подкрашенная вода поднимается. Цвет капли ферроксил-индикатора изменяется на розовый, происходит коррозия стали в результате неравномерной аэрации.
1. Почему цинк, содержащий значительное количество примесей, растворяется в кислоте быстрее, чем цинк чистый? На поверхности металла образуется плёнка продуктов коррозии. Если плёнка препятствует проникновению коррозионной среды к поверхности металла, она является защитной. На цинке, сод. примеси образуется незащитная плёнка; на чистом цинке образуется защитная плёнка, препятствующая коррозии.
2. Какие факторы влияют на скорость коррозионных процессов?
Состав коррозионной среды оказывает больное влияние на скорость коррозии. Коррозия протекает тем более интенсивно, чем выше в растворе концентрация ионов водорода. Иную роль при коррозии железа играют ионы гидроксида. Эти ноны образуют с ионами железа труднорастворимые в щелочных средах гидроксиды. По этой причине железо в щелочных средах не корродирует.
Коррозия металлов может быть вызвана неравномерной концентрацией кислорода в растворе. Участки металлической поверхности, к которым доступ кислорода затруднен, являются анодными и подвергаются разрушению, в то время как участки поверхности, к которым доступ кислорода облегчен, играют роль катодов. Здесь легко протекает процесс ионизации находящегося в растворе кислорода.
Электрохимическая коррозия может быть значительно ускорена в присутствии небольшого количества веществ, называемых в соответствии с характером их действия ускорителями или стимуляторами.
Активными стимуляторами коррозии являются ионы галогенов Cl, Br, J. На поверхности металла в атмосферных условиях имеется оксидная пленка, которая может обладать защитным характером. Ионы галогена, например ионы Cl, адсорбируются на пленке и вытесняют кислород, как бы образуя хлорид, который переходит в раствор. В пленке возникают поры, облегчающие коррозию.
Защита металлов от коррозии
Теоретическая часть
Цель работы – ознакомление с основными способами защиты металлов от коррозии.
Разнообразные способы защиты металлов и сплавов от коррозии можно разделить на три основных вида; нанесение покрытий, обработка среды и электрохимическая защита.

Катодными называются такие покрытия, у которых электродный потенциал металла покрытия имеет более положительное значение, чей электродный потенциал основного металла (например, слой олова на железе). При работе коррозионного элемента, составленного из таких металлов, разрушению будет подвергаться основной металл. Следовательно, катодное покрытие защищает металл от коррозии только механически (рис. 2)

При оксидировании стальных деталей на их поверхности образуется оксидная пленка черного цвета, состоящая преимущественно из магнетита Fe3O4.
Среди различных способов оксидирования сталей наибольшее распространение имеет щелочной метод, предложенный доцентом .
Защитные свойства оксидного слоя могут быть повышены путем промасливания только что нанесённого слоя.
Фосфатирование изделий из железа, цинка и сплавов на основе этих металлов осуществляют нагреванием в 3%-ном растворе препарата «Мажеф», который представляет собой смесь дигидрофосфатов марганца и железа. Эти соли в растворе диссоциируют с образованием фосфат — и гидрофосфат-ионов.
Процесс фосфатировання имеет электрохимический характер. На катодных участках металлической поверхности выделяется водород:
На анодных участках ионы металла переходят в раствор:
Ионы металлов образуют с фосфат — и гидрофосфат-ионами труднорастворимые двухзамещенные и нормальные фосфаты, которые кристаллизуются на металлической поверхности в виде темно-серого осадка.
Фосфатные покрытия слабо предохраняют металлы от коррозии и большей частью применяются в качестве грунта под окраску. Защитные свойства их могут быть повышены пропиткой минеральными маслами или раствором K2Cr2O7.
Электрохимическая коррозия может быть в большой мере замедлена в присутствии небольших количеств веществ, называемых в соответствии с характером их действия замедлителями, или ингибиторами.
Ингибиторы коррозии бывают неорганического и органического происхождения. Они широко применяются для защиты металлов. Из неорганических замедлителей часто используются хроматы, нитриты, силикаты и другие вещества. Механизм их действия различен и сводится к образованию защитных пленок. Ионы CrO42+ или Cr2O72- адсорбируются на активных участках металлической поверхности, делая невозможной коррозию.
Аналогичную роль могут играть полярные молекулы ряда органических веществ, в состав которых входят кислород, сера или азот (амины, пиридин, уротропин и др.).
Среди методов защиты металлов от коррозии особое место занимает электрохимическая защита. Этот метод защиты применим только в токопроводящей среде. Сущность метода заключается в том, что вся поверхность подлежащего защите металлического сооружения искусственно делается катодом. На практике это осуществляется в основном двумя способами.
1) Катодная защита. При этом защищаемое сооружение присоединяют к катоду внешнего источника постоянного тока. В качестве анода используют дополнительный электрод (металлический стержень или пластинку), который подвергается разрушению, предохраняя тем самим от коррозии защищаемое сооружение.
2) Протекторная защита. Защищаемый металлический объект приводят в контакт с другим металлом, имеющим болей отрицательный электродный потенциал, чей защищаемый металл. Деталь из более активного металла называется протектором. В образовавшейся гальванической паре протектор является анодом, 8 защищаемый металлический объект — катодом. В этих условиях протектор постепенно разрушается, а коррозия металлической конструкции почти прекращается.
При помощи электрохимической защиты предохраняют от коррозии морские суда, буи, сваи и эстакады, сооруженные в воде, подземные и подводные трубопроводы, силовые кабели, кабели связи, внутренние поверхности резервуаров, химическую и теплообменную аппаратуру и пр.
Практическая часть
Опыт №1. Коррозия оцинкованного и лужёного железа в кислом растворе.
Цель работы: ознакомиться с коррозией оцинкованного и лужёного железа в кислом растворе.
Ход работы: В две пробирки налить по 5 мл воды, прибавить в каждую по две капли 10%-ной серной кислоты и по две капли раствора красной кровяной соли.
В одну пробирку опустить кусочек лужёного железа (от консервной банки), в другую – кусочек оцинкованного железа.
Наблюдения: Железо, покрытое цинком, наблюдается выделение пузырьков, синее окрашивание. В пробирке с железом, покрытым оловом – ничего не наблюдается.
Вывод: В кислом растворе происходит коррозия оцинкованного железа, с лужёным железом – ничего не происходит.
Опыт №5. Хроматирование цинка.
Цель работы: ознакомиться с хроматированием цинка.
Ход работы: Налить в пробирку немного 0,1 н раствора соляной кислоты и опустить кусочек цинка, потом бросить несколько кристаллов бихромата калия.
Наблюдения: При опускании цинка в соляную кислоту наблюдается выделение пузырьков водорода. При добавлении кристаллов бихромата калия K2Cr2O7 прекращается выделение водорода, реакция замедляется. K2Cr2O7 является ингибитором коррозии.
Вывод: K2Cr2O7 является ингибитором коррозии, реакция замедляется.
Опыт №7. Электрохимическая защита.
Цель работы: ознакомиться с электрохимической защитой.
а) Катодная защита.
Ход работы: В два стакана наливаем 3%-ный раствор NaCl. В оба стакана добавляем несколько капель раствора красной кровяной соли K3[Fe(CN)6]. В один из стаканов опускаем в качестве анода уголь, а в качестве катода — железный образец. Соединяем электроды с плюсами источника постоянного тока. Для сравнения другой железный образец опускаем во второй стакан.
Наблюдения: Наблюдаем появление турнбулевой сини.
При включении тока:
A: Cl -2e Cl2
Вывод: При пропускании тока через раствор коррозии железа нет.
б) Протекторная защита.
Ход работы: В два стакана наливаем разбавленного раствора уксусной кислоты (0,5н). В каждый стакан прибавляем несколько капель раствора йодида калия. В один стакан поместим цинковый и свинцовый образцы в контакте друг с другом. Во второй стакан опускаем один свинцовый образец.
Наблюдения: В пробирке с одним свинцом коррозия идёт. В пробирке с цинком и свинцом коррозии нет, т. к. цинк является протектором по сравнению со свинцом. Цинк является анодом, свинец-катодом.
Вывод: Цинк является протектором коррозии по сравнению со свинцом.
Общий вывод: В кислом растворе происходит коррозия оцинкованного железа, с лужёным железом – ничего не происходит. K2Cr2O7 является ингибитором коррозии, реакция замедляется. При пропускании тока через раствор коррозии железа нет. Цинк является протектором коррозии по сравнению со свинцом.
1. Приведите примеры анодных и катодных покрытий.
Катодными называются такие покрытия, у которых электродный потенциал металла покрытия имеет более положительное значение, чей электродный потенциал основного металла (например, слой олова на железе). При работе коррозионного элемента, составленного из таких металлов, разрушению будет подвергаться основной металл. Следовательно, катодное покрытие защищает металл от коррозии только механически.
Анодные: железо, алюминий, цинк.
Катодные: олово, медь.
2. В чём сущность электрохимической защиты металлов от коррозии?
Среди методов защиты металлов от коррозии особое место занимает электрохимическая защита. Этот метод защиты применим только в токопроводящей среде. Сущность метода заключается в том, что вся поверхность подлежащего защите металлического сооружения искусственно делается катодом.
Видео:Коррозия металловСкачать

Лабораторная работа по химии №4
«Коррозия металлов. Защита металлов от коррозии.»
📽️ Видео
Уравниваем реакцию окисления сульфата железа (II) в нейтральной средеСкачать

Химия 9 Коррозия металловСкачать

§13, 9 кл. Коррозия металловСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Электролиз. 10 класс.Скачать

Эксперимент «Защита от коррозии» из набора «Коррозия»Скачать

Коррозия металлов и способы защиты от нееСкачать

5-3 Коррозия металлов 0Скачать

Лекция 08 :: Электрохимические системы. Электролиз. Коррозия.Скачать

Роль кислорода в процессе коррозии железаСкачать

Электрохимическая коррозия в кислой средеСкачать

Химия, 9-й класс, Понятие о коррозии. Методы защиты от коррозииСкачать

8. Коррозия металловСкачать

Химия для дома. Передача 10. Коррозия металловСкачать