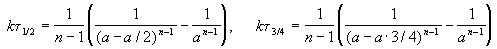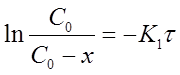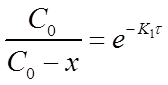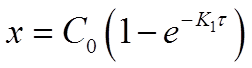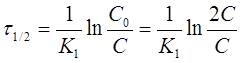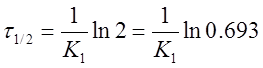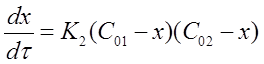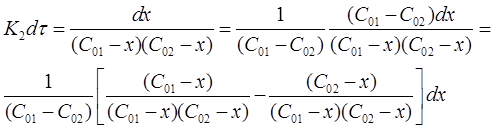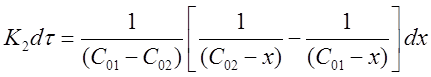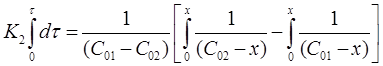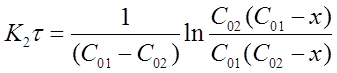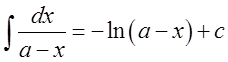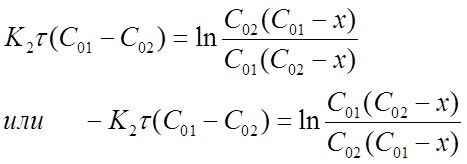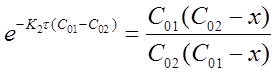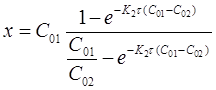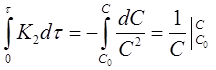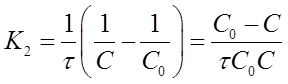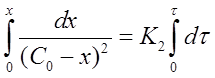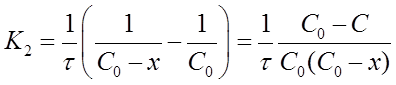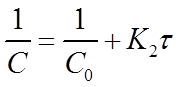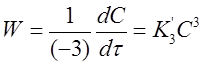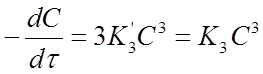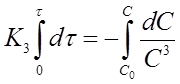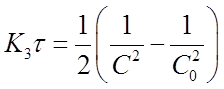1. Основные понятия и постулаты химической кинетики
Химическая кинетика — раздел физической химии, изучающий скорости химических реакций. Основные задачи химической кинетики: 1) расчет скоростей реакций и определение кинетических кривых, т.е. зависимости концентраций реагирующих веществ от времени (прямая задача); 2) определение механизмов реакций по кинетическим кривым (обратная задача).
Скорость химической реакции описывает изменение концентраций реагирующих веществ в единицу времени. Для реакции
aA + bB + . 
скорость реакции определяется следующим образом:
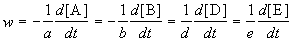
где квадратные скобки обозначают концентрацию вещества (обычно измеряется в моль/л), t — время; a, b, d, e — стехиометрические коэффициенты в уравнении реакции.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и наличия катализатора. Зависимость скорости реакции от концентрации описывается основным постулатом химической кинетики — законом действующих масс:
Скорость химической реакции в каждый момент времени пропорциональна текущим концентрациям реагирующих веществ, возведенным в некоторые степени:
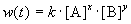
где k — константа скорости (не зависящая от концентрации); x, y — некоторые числа, которые называют порядком реакции по веществам A и B, соответственно. Эти числа в общем случае никак не связаны с коэффициентами a и b в уравнении реакции. Сумма показателей степеней x + y называется общим порядком реакции. Порядок реакции может быть положительным или отрицательным, целым или дробным.
Большинство химических реакций состоит из нескольких стадий, называемых элементарными реакциями. Под элементарной реакцией обычно понимают единичный акт образования или разрыва химической связи, протекающий через образование переходного комплекса. Число частиц, участвующих в элементарной реакции, называют молекулярностью реакции. Элементарные реакции бывают только трех типов: мономолекулярные (A 


ПРИМЕРЫ
Пример 1-1. Скорость образования NO в реакции 2NOBr(г) 
Решение. По определению, скорость реакции равна:
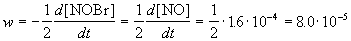
Из этого же определения следует, что скорость расходования NOBr равна скорости образования NO с обратным знаком:
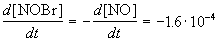
Пример 1-2. В реакции 2-го порядка A + B 
Решение. По закону действующих масс, в любой момент времени скорость реакции равна:
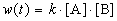
К моменту времени, когда [A] = 1.5 моль/л, прореагировало по 0.5 моль/л веществ A и B, поэтому [B] = 3 – 0.5 = 2.5 моль/л. Константа скорости равна:
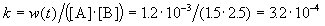
К моменту времени, когда [B] = 1.5 моль/л, прореагировало по 1.5 моль/л веществ A и B, поэтому [A] = 2 – 1.5 = 0.5 моль/л. Скорость реакции равна:
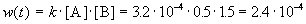
ЗАДАЧИ
1-1. Как выражается скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3 через концентрации азота и водорода? (ответ)
1-2. Как изменится скорость реакции синтеза аммиака 1/2 N2 + 3/2 H2 = NH3, если уравнение реакции записать в виде N2 + 3H2 = 2NH3? (ответ)
1-3. Чему равен порядок элементарных реакций: а) Сl + H2 = HCl + H; б) 2NO + Cl2 = 2NOCl? (ответ)
1-4. Какие из перечисленных величин могут принимать а) отрицательные; б) дробные значения: скорость реакции, порядок реакции, молекулярность реакции, константа скорости, стехиометрический коэффициент? (ответ)
1-5. Зависит ли скорость реакции от концентрации продуктов реакции? (ответ)
1-6. Во сколько раз увеличится скорость газофазной элементарной реакции A = 2D при увеличении давления в 3 раза?(ответ)
1-7. Определите порядок реакции, если константа скорости имеет размерность л 2 /(моль 2 . с). (ответ)
1-8. Константа скорости газовой реакции 2-го порядка при 25 о С равна 10 3 л/(моль . с). Чему равна эта константа, если кинетическое уравнение выражено через давление в атмосферах?(ответ)
1-9. Для газофазной реакции n-го порядка nA 
1-10. Константы скорости прямой и обратной реакции равны 2.2 и 3.8 л/(моль . с). По какому из перечисленных ниже механизмов могут протекать эти реакции: а) A + B = D; б) A + B = 2D; в) A = B + D; г) 2A = B.(ответ)
1-11. Реакция разложения 2HI 
1-12. Скорость реакции 2-го порядка A + B 
1-13. В реакции 2-го порядка A + B 
1-14. В реакции 2-го порядка A + B 
1-15. Скорость газофазной реакции описывается уравнением w = k . [A] 2 . [B]. При каком соотношении между концентрациями А и В начальная скорость реакции будет максимальна при фиксированном суммарном давлении? (ответ)
2. Кинетика простых реакций
В данном разделе мы составим на основе закона действующих масс и решим кинетические уравнения для необратимых реакций целого порядка.
Реакции 0-го порядка. Скорость этих реакций не зависит от концентрации:
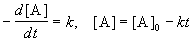
где [A] — концентрация исходного вещества. Нулевой порядок встречается в гетерогенных и фотохимических реакциях.
Реакции 1-го порядка. В реакциях типа A 
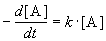
При решении кинетических уравнений часто используют следующие обозначения: начальная концентрация [A]0 = a, текущая концентрация [A] = a — x(t), где x(t) — концентрация прореагировавшего вещества A. В этих обозначениях кинетическое уравнение для реакции 1-го порядка и его решение имеют вид:
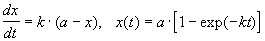
Решение кинетического уравнения записывают и в другом виде, удобном для анализа порядка реакции:
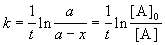
Время, за которое распадается половина вещества A, называют периодом полураспада t 1/2. Он определяется уравнением x(t 1/2) = a/2 и равен
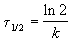
Реакции 2-го порядка. В реакциях типа A + B 
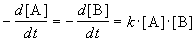
При решении этого уравнения различают два случая.
1) одинаковые начальные концентрации веществ A и B: a = b. Кинетическое уравнение имеет вид:
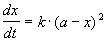
Решение этого уравнения записывают в различных формах:
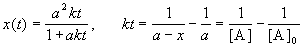
Период полураспада веществ A и B одинаков и равен:
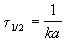
2) Начальные концентрации веществ A и B различны: a 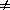
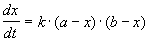
Решение этого уравнения можно записать следующим образом:
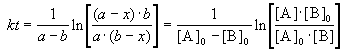
Периоды полураспада веществ A и B различны: 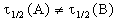
Реакции n-го порядка nA 
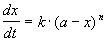
Решение кинетического уравнения:
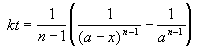
Период полураспада вещества A обратно пропорционален (n-1)-й степени начальной концентрации:
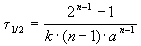
Пример 2-1. Период полураспада радиоактивного изотопа 14 C — 5730 лет. При археологических раскопках было найдено дерево, содержание 14 C в котором составляет 72% от нормального. Каков возраст дерева?
Решение. Радиоактивный распад — реакция 1-го порядка. Константа скорости равна:
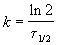
Время жизни дерева можно найти из решения кинетического уравнения с учетом того, что [A] = 0.72 . [A]0:
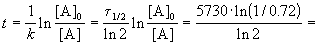
Пример 2-2. Установлено, что реакция 2-го порядка (один реагент) завершается на 75% за 92 мин при исходной концентрации реагента 0.24 М. Какое время потребуется, чтобы при тех же условиях концентрация реагента достигла 0.16 М?
Решение. Запишем два раза решение кинетического уравнения для реакции 2-го порядка с одним реагентом:
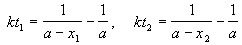
где, по условию, a = 0.24 M, t1 = 92 мин, x1 = 0.75 . 0.24 = 0.18 M, x2 = 0.24 — 0.16 = 0.08 M. Поделим одно уравнение на другое:
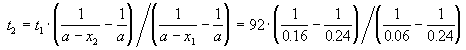
Пример 2-3. Для элементарной реакции nA 
и поделим одно выражение на другое. Постоянные величины k и a из обоих выражений сократятся, и мы получим:
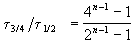
Этот результат можно обобщить, доказав, что отношение времен, за которые степень превращения составит a и b , зависит только от порядка реакции:
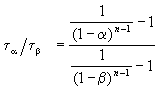
ЗАДАЧИ
2-1. Пользуясь решением кинетического уравнения, докажите, что для реакций 1-го порядка время t x, за которое степень превращения исходного вещества достигает x, не зависит от начальной концентрации. (ответ)
2-2. Реакция первого порядка протекает на 30% за 7 мин. Через какое время реакция завершится на 99%? (ответ)
2-3. Период полураспада радиоактивного изотопа 137 Cs, который попал в атмосферу в результате Чернобыльской аварии, — 29.7 лет. Через какое время количество этого изотопа составит менее 1% от исходного? (ответ)
2-4. Период полураспада радиоактивного изотопа 90 Sr, который попадает в атмосферу при ядерных испытаниях, — 28.1 лет. Предположим, что организм новорожденного ребенка поглотил 1.00 мг этого изотопа. Сколько стронция останется в организме через а) 18 лет, б) 70 лет, если считать, что он не выводится из организма?(ответ)
2-5. Константа скорости для реакции первого порядка SO2Cl2 = SO2 + Cl2 равна 2.2 . 10 -5 с -1 при 320 о С. Какой процент SO2Cl2 разложится при выдерживании его в течение 2 ч при этой температуре?(ответ)
2-6. Константа скорости реакции 1-го порядка
2N2O5(г) 
при 25 о С равна 3.38 . 10 -5 с -1 . Чему равен период полураспада N2O5? Чему будет равно давление в системе через а) 10 с, б) 10 мин, если начальное давление было равно 500 мм рт. ст. (ответ)
2-7. Реакцию первого порядка проводят с различными количествами исходного вещества. Пересекутся ли в одной точке на оси абсцисс касательные к начальным участкам кинетических кривых? Ответ поясните.(ответ)
2-8. Реакция первого порядка A 
2-9. Реакция второго порядка 2A 
2-10. Вещество A смешали с веществами B и C в равных концентрациях 1 моль/л. Через 1000 с осталось 50% вещества А. Сколько вещества А останется через 2000 с, если реакция имеет: а) нулевой, б) первый, в) второй, в) третий общий порядок?(ответ)
2-11. Какая из реакций — первого, второго или третьего порядка — закончится быстрее, если начальные концентрации веществ равны 1 моль/л и все константы скорости, выраженные через моль/л и с, равны 1? (ответ)
CH3CH2NO2 + OH — 
имеет второй порядок и константу скорости k = 39.1 л/(моль . мин) при 0 о С. Был приготовлен раствор, содержащий 0.004 М нитроэтана и 0.005 М NaOH. Через какое время прореагирует 90% нитроэтана? (ответ)
2-13. Константа скорости рекомбинации ионов H + и ФГ — (фенилглиоксинат) в молекулу НФГ при 298 К равна k = 10 11.59 л/(моль . с). Рассчитайте время, в течение которого реакция прошла на 99.999%, если исходные концентрации обоих ионов равны 0.001 моль/л. (ответ)
2-14. Скорость окисления бутанола-1 хлорноватистой кислотой не зависит от концентрации спирта и пропорциональна [HClO] 2 . За какое время реакция окисления при 298 К пройдет на 90%, если исходный раствор содержал 0.1 моль/л HClO и 1 моль/л спирта? Константа скорости реакции равна k = 24 л/(моль . мин). (ответ)
2-15. При определенной температуре 0.01 М раствор этилацетата омыляется 0.002 М раствором NaOH на 10% за 23 мин. Через сколько минут он будет омылен до такой же степени 0.005 М раствором KOH? Считайте, что данная реакция имеет второй порядок, а щелочи диссоциированы полностью.(ответ)
2-16. Реакция второго порядка A + B 
*2-17. Скорость автокаталитической реакции A 
*2-18. Автокаталитическая реакция A 
*2-19. Автокаталитическая реакция A 


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Уравнение константы скорости 1 го порядка
Из уравнений (4) и (5) видно, что критериями первого порядка реакции по реагенту А является линейная зависимость ln [ A ] – t или ln 
В тоже время по тангенсам углов наклона линейных зависимостей можно определить константы скорости.
Другой тест правильности выбранного первого порядка является постоянство константы скорости реакции, вытекающее из уравнения (5)
Размерность константы скорости первого порядка dim = [1/ c ], [1/мин] или соответственно с -1 , мин -1
Третий тест основан на концентрационной зависимости времени полупревращения. Условие полупревращения [ A ] = 0,5[ A ]0 , тогда в соответствии с уравнением (5)
Можно видеть, что критерием первого порядка реакции является независимость времени полупревращения t ½ от начальной концентрации реагента [ A ]0.
Примерами подобных реакций первого порядка являются реакции изомеризации, а также реакции разложения некоторых сложных молекул в газовой фазе.
и в жидкой фазе, например, гидролиз трет-бутилбромида.
Для реакции A + B → C + D можно записать уравнение скорости
Обозначим [ A ]0 и [ B ]0 – начальными концентрациями реагентов А и В, а Х – количество прореагировавших А и В, тогда уравнение (1) приобретет вид
Разделяя переменные, имеем
Проинтегрируем левую часть этого уравнения методом неопределенных коэффициентов, для чего представим дробь
в виде суммы дробей
Решая совместно эти уравнения, имеем

Подставляя значения α и β в уравнение (3) и (4) и интегрируя полученные уравнения в соответствующих пределах
Из уравнения (5) видно, что критерием правильности выбранного второго порядка реакции является линейность зависимости

По тангенсу угла наклона этой зависимости можно определить константу скорости реакции. Другим критерием правильности выбранного второго порядка является постоянство значений k , вычисленных в соответствии с уравнением (5):
во всем диапазоне пар значений τ – х.
Размерность константы скорости второго порядка

Если вещества А и В взяты в равных количествах или реакция идет с участием одного вещества, например
то при постоянстве объема удобно использовать в качестве переменной концентрацию одного из исходных веществ
тогда кинетическое уравнение будет иметь вид
Интегрируя это уравнение в соответствующих пределах
приходим к выражению
Из уравнений (7) и (8) следует, что критериями правильности выбранного второго порядка являются линейный характер зависимости 1/[ A ] от t и постоянство значения k , вычисленных для различных пар значений [ A ] – t по формуле
Третий критерий правильности второго порядка основан на определении времени полупревращения t ½ . Так как [ A ] = 0.5[ A ]0, то в соответствии с уравнением (7)

Можно видеть, что критерием второго порядка является обратно пропорциональная зависимость между t ½ и начальной концентрацией реагента. В соответствии с выражениями (7) и (8) константы скорости второго порядка можно определить по тангенсу угла наклона зависимостей 

Имеется множество реакций протекающих по кинетике второго порядка:
и простой случай, соответствующий равенству исходных и текущих концентраций реагентов
Разделяя переменные и интегрируя
Из уравнения (3) видно, что критериями правильности выбранного третьего порядка является линейность зависимостей 

для всех пар значений t и [ A ] и обратно пропорциональная зависимость между временем полупревращения и квадратом начальной концентрации реагента
В соответствии с уравнением (3) константа скорости третьего порядка может быть определена по тангенсу угла наклона зависимости 

Интегрирование уравнения (1)
приводит к выражениям
Из уравнений (2) и (3) следует, что критериями нулевого порядка по реагенту А являются линейный характер зависимости [ A ] от t , постоянство k , вычисленного по формуле

Из уравнений (2) и (3) следует, что константа скорости нулевого порядка может быть определена по тангенсу угла наклона зависимостей [ A ]0 – [ A ] или [ A ] от времени
Сложные реакции представляют собой совокупность простых реакций. К сложным реакциям относятся обратимые реакции.
При кинетическом анализе сложных реакций руководствуются принципом независимости простых реакций, согласно которому каждая простая реакция, входящая в сложную ведет себя кинетически так, как если бы она была единственная.
в начальный момент времени концентрация реагента A составляет [ A ]0, а [ B ] = 0, то уравнение этой реакции запишется как
Выражая r через концентрацию [A] имеем


где X – количество молей вещества A в единице объеме, которое прореагировало к моменту τ и соответственно количество молей вещества B в единице объеме, которое образовалось к этому моменту. Преобразуя правую часть уравнения (2)

В условиях равновесия
При τ ® ¥ X стремится к своему равновесному значению X ® X ¥ . Тогда
где
Тогда кинетическое уравнение (3) примет вид
Интегрируя это уравнение в соответствующих пределах
и
В соответствии с выражениями (6) и (7) кинетические зависимости для A и B будут иметь следующий вид
Пользуясь интегральной формой кинетического уравнения (5) и соотношением 
Так, в соответствии с (5)
так как 
Подставляя последнее выражение в уравнение (8), имеем
Подставляя выражение (10) в уравнение (8), имеем
Рассмотрим систему параллельных реакций первого порядка
В соответствии с ранее принятыми обозначениями суммарная скорость расходования реагента A выразится уравнением
По форме уравнение (1) подобно кинетическому уравнению необратимой реакции первого порядка, поэтому его интегральная форма имеет вид.
Разрешая уравнение (2) относительно [ A ] имеем
Для определения констант k 1 и k 2 рассмотрим уравнения конкурирующих параллельных реакций.
Поделив почленно, левые и правые части уравнений (5) и (6), имеем уравнение 
Разделяя, левые и правые части уравнений (5) и (1), (6) и (7), приходим к очевидным равенствам

интегрирование которых дает уравнения:

Подставляя в последние уравнения выражение (4) приходим к равенствам
Уравнения (2) и (8) являются основой для определения абсолютных значений констант скорости конкурирующих реакций k 1 и k 2 . На первом этапе можно определить сумму констант скоростей k 1 + k 2 , пользуясь уравнением (2). Затем на основе линейных зависимостей между XB и X , а также XC и X определяют брутто константы 

Нетрудно показать, что для трех параллельных реакций первого порядка


Этот случай более сложен по сравнению с предыдущим. Рассмотрим систему параллельных реакций
Уравнение скорости расхода A в этой системе реакций с учетом его количества, прореагировавшего к моменту времени t (Х) имеет вид:
или с учетом преобразований
обозначая 
Разделяя переменные, приходим к выражению
Интегрируем левую часть уравнения (3) методом неопределенных коэффициентов, для чего представим левую её часть в виде суммы дробей.

так как 

Тогда 
Откуда 

С учетом (4) возвращаемся к уравнению (3)
Интегрирование уравнения (5) приводит к выражению
Откуда
или
Возвращаясь к соотношению 
Рассмотрим систему двух последовательных реакций первого порядка
В силу принципа независимости скорости расходования реагента A выражается уравнением скорости необратимой реакции первого порядка
Решение которого дается в виде


Уравнение скорости изменения концентрации промежуточных продуктов
Разделим почленно левые и правые части уравнений (3) и (1)
Уравнение (4) имеет признаки однородного уравнения первого порядка. Для его решения вводим обозначение
Подставляя последнее выражение в уравнение (4), имеем:
Разделяем переменные и интегрируем
и
тогда
и
или
Так как 
В тоже время в соответствии с уравнением (2)
Тогда уравнение (5) можно преобразовать в форму
Выведенные зависимости показывают, что в случае необратимых последовательных реакций уравнение для первого промежуточного продукта связано с характеристиками лишь первых двух стадий, оставаясь одинаковым при любом числе и характеристиках последующих стадий. При этом независимо от начальной концентрации реагента A , значение второй характеристики материального баланса 
Используя уравнение (5) можно найти 
Из анализа уравнения (6) следует, что при XA = 0 и XA = 1 

откуда
и значение максимума
Из выражений (8) и (9) видно, что положение и величина максимума промежуточного продукта в необратимых реакциях первого порядка зависит только от соотношения констант скоростей первых двух стадий. При этом, чем больше величина 

Уравнение образования продукта C :
Максимальная скорость 
Легко видеть, что это условие соответствует одновременно условию максимума концентрации B , определяемого уравнениями(8) и (9). Качественно проанализированные зависимости могут быть представлены графически.
Неэлементарные реакции состоят из ряда элементарных стадий, составляющих их механизм. Кинетика таких реакций определяется последовательностью элементарных стадий, их характером (обратимые, необратимые), природой реагентов, интермедиатов и продуктов реакции. При кинетическом анализе неэлементарных реакций возникает задача определения концентраций интермедиатов, играющих ключевую роль в образовании продуктов или расходовании реагентов. В качестве инструмента такого определения используется принцип квазистационарных концентраций Боденштейна – Семенова. Согласно этому принципу скорость изменения концентраций нестабильных интермедиатов пренебрежимо мала по сравнению со скоростью изменения концентраций реагентов и продуктов реакции и её можно считать равной нулю. Применение принципа стационарных концентраций к неэлементарным реакциям, протекающим по сложному механизму, позволяет исключить из кинетического описания процессов неизвестные концентрации интермедиатов и получить одно или некоторый минимум дифференциальных уравнений скорости, выраженных через подлежащие измерению концентрации реагентов и продуктов реакции.
Рассмотрим пример неэлементарной реакции, описываемой стехиометрией
и протекающей через образование интермедиата Q
Скорость реакции можно приравнять к скорости образования продукта B
В соответствии с принципом квазистационарных концентраций
откуда
Подставляя последнее выражение в уравнение (1) приходим к уравнению скорости реакции
Если экспериментально возможно непосредственно измерить скорость реакции, то обработку кинетических данных можно провести, преобразуя уравнение (3) как:
Последнее уравнение приводится к виду
Обрабатывая зависимость (4) в координатах 

Видео:Определение порядка реакции методом подбора кинетического уравненияСкачать

Скорость образования, расходования компонента и скорость реакции
Трейдинг криптовалют на полном автомате по криптосигналам. Сигналы из первых рук от мощного торгового робота и команды из реальных профессиональных трейдеров с опытом трейдинга более 7 лет. Удобная система мгновенных уведомлений о новых сигналах в Телеграмм. Сопровождение сделок и индивидуальная помощь каждому. Сигналы просты для понимания как для начинающих, так и для опытных трейдеров. Акция. Посетителям нашего сайта первый месяц абсолютно бесплатно .

Уравнение для константы скорости реакции первого порядка примет вид:
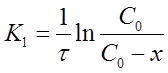
Из уравнения (13) при известной константе скорости и начальной концентрации вещества Со можно определить х в момент времени τ. Для этого преобразуем уравнение (13) к виду:
После потенцирования этого выражения получим
Разрешив уравнение относительно х найдем формулу для его вычисления:
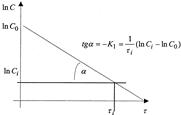
Основной задачей химической кинетики является расчет скоростей химических реакций. Их определяют из уравнения (7) по известной константе скорости. К1 находят экспериментально. При этом по экспериментальным данным изменения концентрации исходного вещества от времени строят график в координатах 1пС — τ. В этой системе координат кинетическое уравнение реакции 1го порядка (12) представляет прямую линию. Тангенс угла наклона этой линии равен К1 (см. рисунок 2).
Рисунок 2 — Графическое определение константы скорости реакции 1го порядка
Иногда для характеристики скорости реакции пользуются временем полупревращения или полураспада τ1/2.
τ1/2 — это промежуток времени, в течение которого реагирует
половина взятого вещества: С = 1/2С0; С0 = 2С,
Из уравнения следует, что τ1/2 для реакции первого порядка не зависит от начальной концентрации исходного вещества и определяется только константой скорости.
Уравнения кинетики реакции 1 ого порядка характеризуют не только скорости мономолекулярных реакций, но применимы и к сложным реакциям. Многие сложные реакции протекают как реакции первого порядка.
1.4.2 Односторонние реакции 2го порядка
Это реакции вида:
А1+ А2 = Продукты.
Выражение для скорости реакции имеет вид:
где С1 и С2 — концентрации веществ А1 и А2 в момент времени τ протекания реакции;
К2 — константа скорости реакции 2го порядка. С другой стороны скорость реакции можно представить через изменения концентрации исходных веществ во времени:
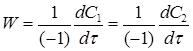
После подстановки этих соотношений в уравнение (14) получим:
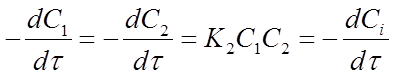
Обозначим x — уменьшение концентрации исходных веществ с течением реакции. Тогда
при τ = 0, С1 =С01, С2 =С02;
приτ > 0,С1 = С01 — х, С2= С02 — х ,
где С01 и С02 начальные концентрации веществ A1 и A2, Из равенств для времени τ > 0 в общем виде:
Подставим приведенные соотношения в уравнение (15) и получим:
Разделим переменные в полученном выражении и проведем некоторые преобразования:
Окончательно можно записать:
Проинтегрируем выражение в пределах от τ = 0 до τ и от х = 0 до х:
После решения интегральных выражений получим:
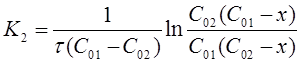
При выводе формулы для расчета К2 использовано вычисление неопределенного интеграла
Из уравнения (16), после небольших его преобразований, можно получить выражение для расчета х .
Представим формулу (16) в виде:
После потенцирования получим
В частном случае, когда С01 = C02 = C0 уравнение скорости односторонней реакции второго порядка примет вид (при v = 1):
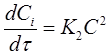
Если использовать значение х, то производная:
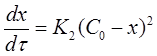
Разделим переменные в уравнениях (17) и (18), проинтегрируем первое в пределах от 0 до τ и от С0 до С, второе от 0 до τ и от 0 до х:
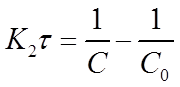
Если уравнение разрешить относительно К2, то получим:
после решения для определения К2 дает формулу:
Константу скорости К2 определяют экспериментально. При этом используют уравнения (16) или (19) в виде:
Приведенное уравнение в системе координат (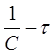
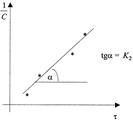
прямую линию. Тангенс угла наклона этой линии, построенной по экспериментальным данным, равен константе скорости изучаемой реакции (рисунок 3).
Рисунок 3 — Графическое определение константы скорости реакции второго порядка
1.4.3 Односторонние реакции 3го порядка
Это реакции вида:
3А → Продукты или А1 + А2+ А3 → Продукты.
Для скорости первой реакции справедливо соотношение:
Если концентрации исходных веществ СА1 =СА2 =СА3=С в любой момент времени, то кинетическое уравнение скорости второй реакции имеет вид:
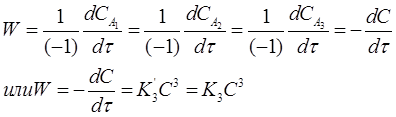
Разделим переменные в уравнении (20) и проинтегрируем его в пределах от 0 до τ и от С0 до С
И получим
Если это равенство разрешить относительно К3, то найдем формулу для вычисления константы скорости реакции третьего порядка:
🎦 Видео
Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Порядок реакцииСкачать

задачи на порядок хим реакцииСкачать

Скорость реакции. Химия – ПростоСкачать

Константа скорости реакций первого порядкаСкачать

Скорость химических реакций. 9 класс.Скачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Вычисление константы скорости реакции | Задачник по химии ГлинкаСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Лекция 146 Константа скорости электрохимической реакцииСкачать

Кинетика || Лекция 3 || Реакции первого порядкаСкачать

5 3 Порядок реакцииСкачать

Кинетика. Ванильная задача №1Скачать

Лекция 2: закон действия масс, реакции первого и второго порядка (18.09.2019)Скачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Константа скорости реакций второго порядкаСкачать

Химическое равновесие. Закон действующих масс.Скачать

3 1 Константа химической реакцииСкачать