Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

Ваш ответ
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

решение вопроса
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Похожие вопросы
- Все категории
- экономические 43,408
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,025
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Учебно-методический комплекс по дисциплине «Химия». Раздел «Неорганическая химия» (стр. 26 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 |
Находим, что скорость реакции увеличится в 27 раз.
Задание 3. Записать выражение константы равновесия для реакции CH4+H2O«CO+3H2
В каком направлении будет смещаться равновесие реакции при уменьшении объема?
По закону действующих масс для данной реакции скорость равна u=k[СH4]×[Н2О].
выражение константы равновесия для реакции CH4+H2O«CO+3H2
Реакция идет с увеличением объема (4>2), поэтому уменьшение объема будет смещать равновесие влево.
Задание 4. Равновесие реакции H2+I2«2HI установилось при следующих концентрациях [H2]=0,5 моль/л, [I2]=0,1 моль/л, [HI]=1,8 моль/л. Определить исходные концентрации йода и водорода и константу химического равновесия.
Из уравнения реакции следует, что к моменту равновесия израсходовано 0,9 моль/л Н2 и 0,9 моль/л I2:
Следовательно, исходная концентрация составляет:
[H2]=0,5+0,9=1,4 моль/л; [I2]=0,1+0,9=1 моль/л.
Константа химического равновесия равна
К =
1. Классификация химических реакций. Гомогенные и гетерогенные химические реакции.
2. Записать кинетическое уравнение по закону действующих масс для реакции:
Как изменится скорость данной реакции, если давление в системе увеличить в 3 раза?
3. Записать выражение константы равновесия для реакции (N2) + 3(H2) « 2(NH3), DH 0 и определить смещение равновесия при повышении давления.
3.При некоторой температуре равновесие гомогенной системы 2(NO)+(О2)⇆2(NO2) установилось при следующих концентрациях реагирующих веществ (моль/л): [NО]p= 0,05; [О2]р = 0,02; [NO2]р = 0,04 моль. Вычислите константу равновесия и исходную концентрацию NO и О2.
1.Влияние температуры на скорость реакции. Правило Вант-Гоффа.
2.Записать кинетическое уравнение по закону действующих масс для реакции:
(CН4) + (H2O) ® (CO) + 3(H2). Как изменится скорость данной реакции, если увеличить давление в 3 раза?
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Константа равновесия химической реакции

Средняя оценка: 4.8
Всего получено оценок: 142.
Средняя оценка: 4.8
Всего получено оценок: 142.
Количественная характеристика, показывающая направление реакции и смещение концентрации веществ, называется константой равновесия химической реакции. Константа равновесия зависит от температуры и природы реагентов.
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Обратимые и необратимые реакции
Все реакции можно разделить на два типа:
- обратимые, одновременно протекающие в двух взаимно противоположных направлениях;
- необратимые, протекающие в одном направлении с полным расходом хотя бы одного исходного вещества.
При необратимых реакциях обычно образуются нерастворимые вещества в виде осадка или газа. К таким реакциям относятся:
Обратимые реакции возможны только в определённых неизменных условиях. Исходные вещества дают новое вещество, которое тут же распадается на составные части и собирается вновь. Например, в результате реакции 2NO + O2 ↔ 2NO2 оксид азота (IV) легко разлагается на оксид азота (II) и кислород.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Равновесие
Через определённое время скорость обратимой реакции замедляется. Достигается химическое равновесие – состояние, при котором не происходит изменения концентрации исходных веществ и продуктов реакции с течением времени, так как скорость прямой и обратной реакций уравниваются. Равновесие возможно только в гомогенных системах, то есть все реагирующие вещества являются либо жидкостями, либо газами.
Рассмотрим химическое равновесие на примере реакции взаимодействия водорода с йодом:
Как только смешиваются два реагента – водород и йод – йодоводорода ещё не существует, так как простые вещества только вступают в реакцию. Большое количество исходных веществ активно реагируют друг с другом, поэтому скорость прямой реакции будет максимальной. При этом обратная реакция не протекает, и скорость её равна нулю.
Скорость прямой реакции можно выразить графически:
где kпр – константа скорости прямой реакции.
Со временем реагенты расходуются, их концентрация снижается. Соответственно, скорость прямой реакции уменьшается. Одновременно с этим увеличивается концентрация нового вещества – йодоводорода. При накоплении он начинает разлагаться, и скорость обратной реакции повышается. Её можно выразить как
Йодоводород в квадрате, так как коэффициент молекулы равен двум.
В определённый момент скорости прямой и обратной реакции уравниваются. Наступает состояние химического равновесия.
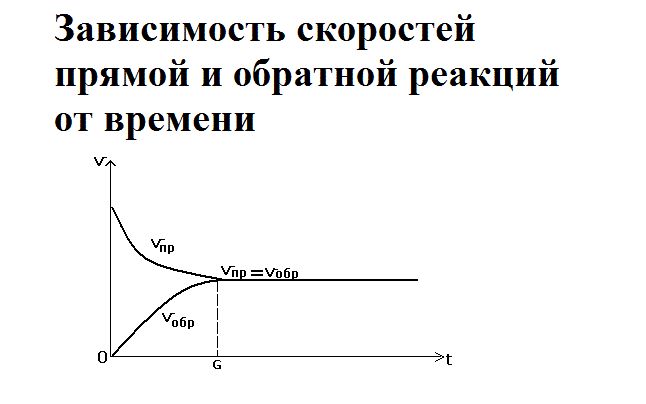
Равновесие можно сместить либо в сторону исходных веществ, либо в сторону продуктов реакции. Смещение под воздействием внешних факторов называется принципом Ле Шателье. На равновесие влияют температура, давление, концентрация одного из веществ.
Видео:Если в реакции СН4 + 2O2 → СО2 + 2Н2O весь кислород заменить на смесь xN2 + О2 равного объёма, тоСкачать

Расчёт константы
В состоянии равновесия обе реакции идут, но при этом концентрации веществ находятся в равновесии (образуются равновесные концентрации), так как уравновешенны скорости (νпр = νобр).
Химическое равновесие характеризуется константой химического равновесия, которая выражается сводной формулой:
Константы скорости реакции можно выразить через соотношение скорости реакции. Возьмём условное уравнение обратной реакции:
Тогда скорости прямой и обратной реакции будут равны:
📽️ Видео
Химия | Тепловой эффект химической реакции (энтальпия)Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Уравнивание реакций горения углеводородовСкачать

Химия 9 класс (Урок№4 - Обратимые и необратимые реакции. Понятие о химическом равновесии.)Скачать

Обратимость химических реакций. Химическое равновесие | Химия 11 класс #16 | ИнфоурокСкачать

Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Задача на Константу равновесия (Кр) с дискриминантом. Химия. Олимпиада + ВУЗСкачать

259. Как изменится скорость хим реакции, если увеличить давлениеСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Скорость химических реакций. 9 класс.Скачать


