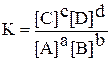
Особенность записи выражения константы равновесия для гетерогенных равновесий заключается в том, что концентрации твёрдых веществ считают неизменными, условно равными единице, и в уравнение для константы равновесия не включают.
Так, для реакции
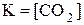
Константа равновесия – важнейшая характеристика обратимых химических реакций. Чем больше значение константы равновесия, тем больше концентрации продуктов реакции, тем с большей полнотой проходит прямая реакция.
Принцип Ле Шателье
Если на систему не оказывать внешнего воздействия, то состояние равновесия будет сохраняться как угодно долго. При изменении внешних условий равновесие может быть нарушено, однако через некоторое время установится новое состояние равновесия, характеризующееся новыми равновесными концентрациями. Переход от одного состояния химического равновесия к другому называют смещением равновесия. Направление смещения определяется принципом Ле Шателье:
· если на систему, находящуюся в состоянии химического равновесия, оказать внешнее воздействие, то равновесие сместится в направлении реакции, уменьшающей это воздействие.
Влияние концентраций компонентов системы. При увеличении концентрации какого-либо из веществ увеличится скорость реакции, расходующей это вещество, следовательно, равновесие смещается в сторону этой реакции. При уменьшении концентрации вещества равновесие сместится в сторону реакции
образования этого вещества. Если, например, в системе
CH4(Г) + 2H2O(Г) Û CO2(Г) + 4H2(Г), 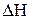
увеличить концентрацию метана CH4 или паров воды, это приведёт к смещению равновесия вправо. Если увеличить концентрацию диоксида углерода, равновесие сместится влево.
Влияние общего давления в системе. При увеличении давления равновесие смещается в сторону реакции, идущей с образованием меньшего количества газообразных веществ, при уменьшении давления — в сторону реакции, идущей с образованием большего количества газообразных веществ. Для рассматриваемой системы увеличение давления смещает равновесие влево, уменьшение давления – вправо (слева 3 моль газов, справа – 5).
Влияние температуры. При повышении температуры равновесие смещается в сторону эндотермической (DН > 0) реакции, т.е. в сторону поглощения тепла, при понижении температуры — в сторону экзотермической (DН

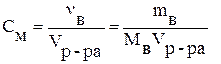
где 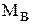
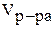
Размерность молярной концентрации — моль/л.
· Пример. Вычислите процентную и молярную концентрации раствора H3PO4, содержащего 18 г кислоты в 282 мл воды, если плотность его равна 1,03 г/мл.
Рассчитываем процентную концентрацию (следует помнить что плотность воды 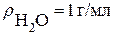
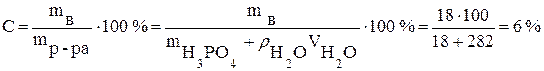
Чтобы рассчитать молярную концентрацию раствора, выражаем массу растворённого вещества из формулы для процентной концентрации:
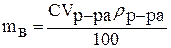
а затем полученное выражение подставляем в формулу для молярной концентрации:
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

MgO(к) + CO2(г) MgCO3(к) ΔH  Готовое решение: Заказ №8633
Готовое решение: Заказ №8633





Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
MgO (к) + CO 2 (г) 
ΔH
В гетерогенной системе установилось равновесие. Напишите выражение для константы равновесия. Дайте обоснованные ответы на вопросы: а) как уменьшение давления отразится на состоянии равновесия; б) в каком направлении сместится равновесие при уменьшении температуры; в) как и во сколько раз изменится скорость прямой реакции при уменьшении давления в системе в два раза?
Решение :
Выражение константы равновесия:
Направление смещения равновесия определяется принципом Ле Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в направлении, которое ослабляет эффект внешнего воздействия
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Номер задачи 94 A m, г 95 V, л ρ, KOH 718 2,0 1,27 Водный раствор содержит массу m вещества А в объе¬ме V. Плотность раствора ρ. Вычислите массовую долю (в %)
- Si + O2 + NaOH → Na2SiO3 + H2O HNO3 + Bi → NO + Bi(NO3)3 + H2O Окислительно-восстановительные реакции протекают по приведенным схемам. Для каждой реакции укажите: а) окислитель и восстановитель
- Элемент A l 35 Br 79 1 1). Один из изотопов элемента имеет массовое число A. Каков заряд ядра его атома? Сколько электронов находится на всех электронных оболочках атома?
- Реакция горения бензола выражается термохимическим уравнением: C6H6(ж) + 7½O2(г) = 6CO2(г) + 3H2O(г); ΔH = ? Вычислите тепловой эффект
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Гетерогенное равновесиеСкачать

Химическая кинетика и катализ
Если температурный коэффициент скорости равен 2, то при увеличении температуры от 20°С до 50°С скорость химической реакции _______ раз.
1) увеличится в 8
2) уменьшится в 8
3) увеличится в 6
4) уменьшится в 6
Согласно принципу Ле Шателье, повышение температуры вызывает смещение равновесия в системе в сторону …
1) эндотермической реакции
2) экзотермической реакции
3) увеличения объема
4) уменьшения объема
Параметром, изменение которого не вызывает смещения равновесия в системе CO(г) + H2O(г) ↔ H2(г) + CO2 (г); ∆r H 0 0 С установилось равновесие 

1)
2)
3)
4)
Для увеличения выхода продуктов реакции в равновесной системе MgCO3 (т)↔MgO(т) + CO2(г); 
1) повысить давление
2) ввести катализатор
3) увеличить концентрацию оксида углерода (IV)
4) повысить температуру
Для увеличения выхода продуктов реакции в равновесной системе 

1) повысить температуру
2) ввести катализатор
3) увеличить концентрацию оксида углерода (IV)
4) повысить давление
Для увеличения выхода продуктов реакции в равновесной системе 

1) повысить давление
2) понизить температуру
3) ввести катализатор
4) повысить температуру
Для увеличения выхода продуктов реакции в равновесной системе

1) повысить температуру
2) повысить давление
3) понизить температуру
4) понизить давление
Уравнение реакции, в которой при понижении давления равновесие смещается в сторону продуктов, имеет вид …
1)
2)
3)
4)
Уравнение реакции, в которой при изменении давления не происходит смещения равновесия, имеет вид …
1)
2)
3)
4)
При увеличении объема реакционной смеси в 2 раза скорость элементарной гомогенной реакции 2CO + O2 = 2CO2 _____ раз.
1) уменьшится в 6
2) увеличится в 8
3) увеличится в 6
4) уменьшится в 8
При увеличении давления в реакционной смеси в 2 раза скорость элементарной гомогенной реакции 2NO + Cl2 =2NOCl_____ раз.
1) увеличится в 8
2) уменьшится в 8
3) уменьшится в 6
4) увеличится в 6
Увеличение скорости химической реакции при введении катализатора происходит в результате …
1) уменьшения энергии активации
📹 Видео
Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Лекция 6. Скорость химической реакцииСкачать

Урок № 2. Скорость химических реакций. Химическое равновесиеСкачать

Скорость химической реакцииСкачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Влияние температуры на скорость реакцииСкачать

Скорость химических реакцииСкачать

80. Скорость химической реакции (часть 1)Скачать

влияние концентрации реагирующих веществ на скорость химической реакцииСкачать
Зависимость скорости реакции от концентрации реагентовСкачать

Гибридизация - смысл. Разбор 10 молекул:CH4, NH3, H2O, C2H4, BCl3, SO2, SO3, BeCl2, CO2, C2H2.Скачать

Скорость химической реакции | Химия 11 класс #15 | ИнфоурокСкачать

Химические реакции. Скорость химической реакции | Химия 9 класс #5 | ИнфоурокСкачать

Скорость химических реакций. Видеоурок по химии 9 класс.Скачать

Химия. Факторы, влияющие на скорость реакции. Центр онлайн-обучения «Фоксфорд»Скачать

Основные положения молекулярно-кинетической теории газов и ее опытное обоснование. 10 класс.Скачать

Уравнения и графики механических гармонических колебаний. Практ. часть - решение задачи. 11 класс.Скачать

 Готовое решение: Заказ №8633
Готовое решение: Заказ №8633












