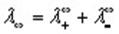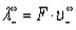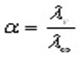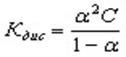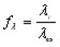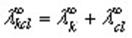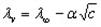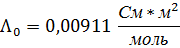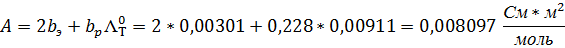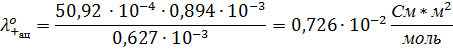Эквивалентная электропроводность при бесконечном разбавлении как для сильных, так и для слабых электролитов может быть вычислена с помощью закона Кольрауша.
Согласно закону Кольрауша эквивалентная электропроводность раствора электролита при бесконечном разбавлении определяется выражением:
где 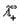
Эквивалентные электропроводности ионов называются также подвижностями. Они равны произведению абсолютной скорости ионов на число Фарадея, т.е.
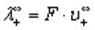
где 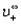
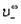
По измеренным сопротивлениям для каждой из концентраций вычисляют удельную электропроводность, эквивалентную электропроводность, а затем вычисляют степень диссоциации по уравнению:
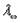
Константу равновесия процесса диссоциации слабого электролита вычисляют по уравнению (закон разбавления Оствальда):
где ? – степень диссоциации,
С – концентрация раствора.
При работе с раствором сильного электролита необходимо вычислить коэффициент электропроводности по уравнению:
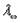
Подвижности ионов К’ и Cl’ взять из приложения ( в конце работы).
Для сильных электролитов зависимость эквивалентной электропроводности от концентрации выражается эмпирическим уравнением Кольрауша
где а – постоянная, зависящая от природы электролита, растворителя и температуры.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СЛАБЫХ ЭЛЕКТРОЛИТОВ
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Измерения электрической проводимости растворов производят с помощью приборов, называемых кондуктометрами. Методика выполнения измерений описана в инструкции, прилагаемой к используемому прибору.
Любые исследования, основанные на измерении электрической проводимости, объединяются под названием кондуктометрии. Кондуктометрические методы применяются для изучения свойств как сильных, так и слабых электролитов.
РАБОТА № 1
ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ
Цель работы:определение предельной молярной проводимости и коэффициентов проводимости сильных электролитов.
Электролит: CH3COONa
| Молярная концентрация раствора C, моль/м 3 | 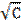 | Удельная проводимость σ* 10 4 ,См/м | Эквивалентная проводимость Λ*10 4 , См*м 2 /моль | Λ0 |  | A |
| 0,196 | ||||||
| 0,01 | 0,1 | 0,5535 | 55,35 | 0,00911 | 0,6076 | 0,0358 |
| 0,1 | 0,3162 | 1,439 | 14,39 | 0,1580 | 0,0243 | |
| 8,059 | 8,059 | 0,0885 | 0,0083 | |||
| 3,1623 | 51,65 | 5,165 | 0,0567 | 0,0027 | ||
| 270,5 | 2,705 | 0,0297 | 0,0009 |
1. Постройте график 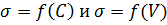
2. Рассчитайте эквивалентную электрическую проводимость каждого раствора:
3. Постройте график 

4. Рассчитайте значение 
5. Сравните Λ0 найденное графически, с теоретическим.
6. Рассчитайте коэффициент проводимости для каждого раствора fΛ=Λ/Λ0
7. Сделайте вывод о влиянии концентрации на взаимодействие между ионами.
В растворах слабых электролитов, чем выше концентрация, тем ниже коэффициент проводимости.
По теории Дебая — Онзагера снижение эквивалентной электрической проводимости при переходе от бесконечно разбавленного раствора к растворам конечных концентраций связано с уменьшением скоростей движения ионов. Это объясняется появлением эффектов торможения движения ионов, возникающих за счет сил электростатического взаимодействия между ионом и его ионной атмосферой.
8. Установите область концентрации, для которой применимо уравнение Кольрауша.
Уравнение Кольрауша, в соответствии с графиком, применимо к области концентраций от 0,01 моль/м 3 до 0,1 моль/м 3
9. Найдите значение предельной электропроводности электролита и коэффициента А по уравнению Кольрауша.
y = -0,0005x + 0,0079

10. Результаты измерений занесите в таблицу.
11. Рассчитайте значение углового коэффициента в уравнении Дебая-Хюккеля-Онзагера, если ε=78,25; η=0,894*10 -3 Па*с;
Уравнение Дебая-Хюккеля-Онзагера (1,1 – электролит)
Подставив значения, получим (q = 1/2, так как электролит симметричен):
12. Сравните значения полученных угловых коэффициентов:
A (графическая) = 0,0005
А (аналитическая) = 0,008097
13. Определите подвижность катиона и аниона, если число переноса аниона дано в таблице.
14. Предельную электрическую подвижность катиона в водном растворе.
15. Скорость движения катиона при градиенте поля 100 В/м.
16. Стоксов радиус иона (для воды η = 0,894 * 
17. Подвижность катиона при бесконечном разведении в ацетоне и нитрометане, вязкости которых при этой температуре соответственно равны 0,310∙ 

Работа №2
ИЗМЕРЕНИЕ УДЕЛЬНОЙ ЭЛЕКТРОПРОВОДНОСТИ РАСТВОРОВ СЛАБЫХ ЭЛЕКТРОЛИТОВ
Цель работы:определение степени диссоциации слабых электролитов при разных концентрациях и константы диссоциации.
Электролит: CH3COOH
| Молярная концентрация раствора C, моль/м 3 | 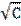 | Удельная проводимость σ*10 4 ,См/м | Эквивалентная проводимость Λ*10 4 , См*м 2 /моль | Степень диссоциации α | Ка |
| 1,61 | 1,6116 | 0,004125 | 1,7086*10 -5 | ||
| 2,2361 | 3,56 | 0,7119 | 0,001822 | 1,6629*10 -5 | |
| 3,1623 | 5,13 | 0,5130 | 0,001313 | 1,7262*10 -5 | |
| 4,4721 | 7,2 | 0,3602 | 0,000922 | 1,7017*10 -5 | |
| 7,0711 | 11,37 | 0,2273 | 0,000582 | 1,6946*10 -5 |
1. Рассчитать эквивалентную проводимость растворов.
2. Построить графики зависимости 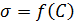

3. Пользуясь величинами предельных подвижностей ионов, по закону независимого движения ионов рассчитайте предельную молярную проводимость электролита.
4. Рассчитайте степень диссоциации слабого электролита в каждом исследуемом растворе.
5. Постройте график зависимости α от концентрации раствора.
6. По закону разбавления Оствальда рассчитайте константу диссоциации для каждого раствора и найдите ее среднее значение.
7. По графикам в координатах 

8. Сравните найденное значение константы диссоциации с табличным значением.
К(найденное) = 2,24*10 -7
К(табличное) = 1,8*10 -5
9. Сделайте вывод о влиянии концентрации раствора на величины α и Ка
У слабых электролитов степень и константа диссоциации понижаются с повышением концентрации раствора.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Уравнение кольрауша для слабых электролитов
10. Электропроводность растворов электролитов
Электропроводность 
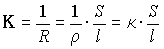
где 

Удельной электропроводностью 
Эквивалентной электропроводностью 
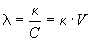
где V = 1/C — разведение (или разбавление) раствора, т.е. объем, в котором содержится 1 г-экв растворенного вещества, а C — эквивалентная концентрация (нормальность) раствора. В системе СИ эквивалентная электропроводность выражается в Ом -1. м 2. кг-кв -1 .
Эквивалентная электропроводность 

В разбавленных растворах сильных электролитов выполняется эмпирический закон Кольрауша (закон квадратного корня):
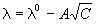
где 

В растворах слабых электролитов 


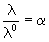
Кроме того, выполняется закон разведения Оствальда, который для бинарного электролита записывается следующим образом:
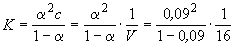
где K — константа диссоциации слабого электролита.
Электропроводность электролитов связана со скоростями движения ионов в растворе. Скорость движения vi [м . с -1 ] иона в растворе пропорциональна напряженности приложенного электрического поля E [В . м -1 ]:
Коэффициент пропорциональности u [м 2. с -1. В -1 ] называется абсолютной подвижностью иона.
Произведение uiF (F — постоянная Фарадея) называется подвижностью иона 

Подвижность иона при бесконечном разбавлении называется предельной подвижностью иона и обозначается 

Согласно закону Кольрауша о независимой миграции ионов, эквивалентная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов:



Доля тока, переносимая данным ионом, называется числом переноса ti иона:
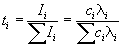
причем по определению 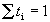
Согласно закону Стокса, предельная подвижность 
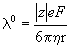
где e — элементарный заряд, F — постоянная Фарадея.
Предельные подвижности 
Катионы

Анионы

Из этого уравнения следует правило Вальдена-Писаржевского, согласно которому для любого иона или электролита:
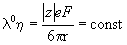
Пример 10-1. Удельная электропроводность 0.135 моль . л -1 раствора пропионовой кислоты C2H5COOH равна 4.79 . 10 -2 См . м -1 . Рассчитать эквивалентную электропроводность раствора, константу диссоциации кислоты и pH раствора, если предельные подвижности H + и C2H5COO — равны 349.8 См. см 2. моль -1 и 37.2 См . см 2 моль -1. соответственно.






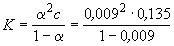
[H + ] = 
Ответ. 

Пример 10-2. Удельная электропроводность насыщенного раствора BaCO3 в воде при 18 o C равна 25.475 . 10 -4 См . м -1 . Удельная электропроводность воды 4.5 . 10 -5 См . м -1 . Подвижности ионов Ba 2+ и CO3 2- при 18 o C равны соответственно 55 и 66 См . см 2. г-экв -1 . Рассчитать растворимость BaCO3 в воде при 18 o C в моль . л -1. считая соль полностью диссоциированной, а подвижности ионов равными подвижностям при бесконечном разведении.






= 55 + 66 = 121 См . см 2. г-экв -1 = 1.21 . 10 -2 См . м 2. г-экв -1 .
С = 

Ответ. С = 1.03 . 10 -4 моль . л -1 .
Пример 10-3. Удельная электропроводность 5%-го раствора Mg(NO3)2 при 18 o C равна 4.38 См . м -1. а его плотность — 1.038 г . см -3 . Рассчитать эквивалентную электропроводность раствора и кажущуюся степень диссоциации соли в растворе. Подвижности ионов Mg 2+ и NO3 — при 18 o C равны соответственно 44.6 и 62.6 См . см 2. г-экв -1 .
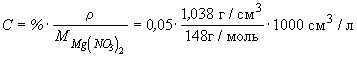

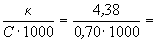




Ответ: 

10-1. Рассчитать удельную электропроводность абсолютно чистой воды при 25 o C. Ионное произведение воды при 25 o C равно 1.00 . 10 -14 .(ответ)
10-2. Удельная электропроводность бесконечно разбавленных растворов KCl, KNO3 и AgNO3 при 25 o C равна соответственно 149.9, 145.0 и 133.4 См . м 2. моль -1 . Какова удельная электропроводность бесконечно разбавленного раствора AgCl при 25 o C? (ответ)
10-3. Удельная электропроводность бесконечно разбавленных растворов соляной кислоты, хлорида натрия и ацетата натрия при 25 o C равна соответственно 425.0. 128.1 и 91.0 См . м 2 . моль -1 . Какова удельная электропроводность бесконечно разбавленного раствора уксусной кислоты при 25 o C? (ответ)
10-4. Удельная электропроводность 4% водного раствора H2SO4 при 18 o C равна 0.168 См . см -1. плотность раствора — 1.026 г . см -3 . Рассчитать эквивалентную электропроводность раствора. (ответ)
10-5. Удельная электропроводность насыщенного раствора AgCl в воде при 25 o C равна 2.28 . 10 -4 См . м -1. а удельная электропроводность воды 1.16 . 10 -4 См . м -1 . Рассчитать растворимость AgCl в воде при 25 o C в моль . л -1 . (ответ)
10-6. Какую долю общего тока переносит ион Li + в водном растворе LiBr при 25 o C? (ответ)
10-7. Рассчитать число переноса H + в растворе HCl с концентрацией 1 . 10 -3 моль . л -1 . Каково будет число переноса H + , если к этому раствору добавить NaCl, чтобы его концентрация была равна 1.0 моль . л -1 ? (ответ)
10-8. Рассчитать скорость движения иона Rb + в водном растворе при 25 o C, если разность потенциалов 35 В приложена к электродам, находящимся на расстоянии 0.8 см друг от друга. (ответ)
10-9. Рассчитать скорость движения иона Na + в водном растворе при 25 o C, если разность потенциалов 10 В приложена к электродам, находящимся на расстоянии 1 см друг от друга. Сколько времени понадобится иону, чтобы пройти расстояние от одного электрода до другого?(ответ)
10-10. Удельная электропроводность водного раствора KI равна 89.00 См . м -1. а раствора KCl той же концентрации — 186.53 См . м -1 . Удельная электропроводность раствора, содержащего обе соли, равна 98.45 См . м -1 . Рассчитать долю KCl в растворе. (ответ)
10-11. Удельная электропроводность водного раствора сильного электролита при 25 o C равна 109.9 См . см 2 . моль -1 при концентрации 6.2 . 10 -3 моль . л -1 и 106.1 См . см 2 . моль -1 при концентрации 1.5 . 10 -2 моль . л -1 . Какова удельная электропроводность раствора при бесконечном разбавлении? (ответ)
10-12. Рассчитать радиус иона N(CH3)4 + по закону Стокса из его предельной подвижности в водном растворе при 25 o C. Вязкость воды при 25 o C равна 8.91? 10 -4 Па . с. Оценить предельную подвижность этого иона в глицерине, вязкость которого равна 1.49 Па . с. (ответ)
10-13. Оценить предельную подвижность иона K + в формамиде и метилацетате, если вязкость формамида в 3.7 раз больше, а вязкость метилацетата в 2.6 раз меньше, чем вязкость воды. (ответ)
10-14. Рассчитать удельную электропроводность 1.0 . 10 -3 M водного раствора NaCl при 25 o C, считая, что подвижности ионов при этой концентрации равны их предельным подвижностям. Через слой раствора длиной 1 см, заключенный между электродами площадью 1 см 2. пропускают ток силой 1 мА. Какое расстояние пройдут ионы Na + и Cl — за 10 минут? (ответ)
10-15. Рассчитать эффективный радиус иона Li + при 25 o C из его предельной подвижности, используя закон Стокса. Рассчитать приблизительное число молекул воды, входящих в гидратную оболочку иона Li + . Кристаллографический радиус иона Li + равен 60 пм. Вязкость воды при 25 o C равна 8.91 . 10 -4 Па . с. Собственный объем молекулы воды оценить из параметров уравнения Ван-дер-Ваальса. (ответ)
10-16. Константа диссоциации гидроксида аммония равна 1.79 . 10 -5 моль . л -1 . Рассчитать концентрацию NH4OH, при которой степень диссоциации равна 0.01. и эквивалентную электропроводность раствора при этой концентрации. (ответ)
10-17. Эквивалентная электропроводность 1.59 . 10 -4 моль . л -1 раствора уксусной кислоты при 25 o C равна 12.77 См . см 2 . моль -1 . Рассчитать константу диссоциации кислоты и pH раствора. (ответ)
10-18. Константа диссоциации масляной кислоты C3H7COOH равна 1.74 . 10 -5 моль . л -1 . Эквивалентная электропроводность раствора при разведении 1024 л . моль -1 равна 41.3 См . см 2 . моль -1 . Рассчитать степень диссоциации кислоты и концентрацию ионов водорода в этом растворе, а также эквивалентную электропроводность раствора при бесконечном разведении. ( 

10-19. Эквивалентная электропроводность раствора гидроксида этиламмония C2H5NH3OH при бесконечном разведении равна 232.6 См . см 2 . моль -1 . Рассчитать константу диссоциации гидроксида этиламмония, эквивалентную электропроводность раствора, степень диссоциации и концентрацию ионов гидроксила в растворе при разведении 16 л . моль -1. если удельная электропроводность раствора при данном разведении равна 1.312 . 10 -3 См . см -1 . (ответ)


Сервер создается при поддержке Российского фонда фундаментальных исследований
Не разрешается копирование материалов и размещение на других Web-сайтах
Вебдизайн: Copyright (C) И. Миняйлова и В. Миняйлов
Copyright (C) Химический факультет МГУ
Написать письмо редактору
💡 Видео
Электропроводность сильных и слабых электролитовСкачать

сильные и слабые электролиты РАСЧЕТ рНСкачать

Диссоциация. Сильные и слабые электролиты. Проводник второго рода. Химия – ПростоСкачать

Как отличить слабый электролит от сильного?Скачать

Электрическая проводимость растворов электролитов. Кондуктометрия.Скачать

Сильные и слабые электролиты. Степень электролитической диссоциацииСкачать

Степень диссоциации. Сильные и слабые электролиты. Самоподготовка к ЕГЭ и ЦТ по химииСкачать

Сильные и слабые электролиты | Химия с Сашей Сильвер | ЕГЭ 2024 | SMITUPСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химия, 12-й класс, Химическое равновесие в растворах слабых электролитовСкачать

Химия. 9 класс. Степень диссоциации. Сильные и слабые электролиты /11.09.2020/Скачать

Закон ОствальдаСкачать

Теории кислот, оснований и растворов. Теория Аррениуса-Оствальда. 11 класс.Скачать

Успеть за 300 секунд, #7: Электролиты и неэлектролитыСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Лекция 28 Эквивалентная электропроводностьСкачать