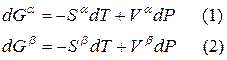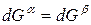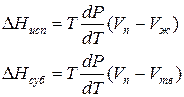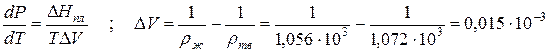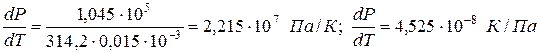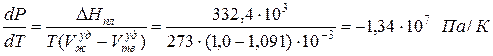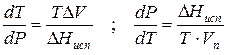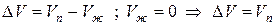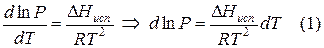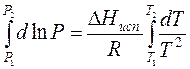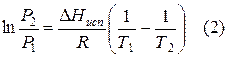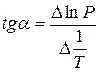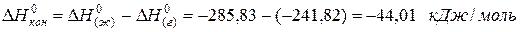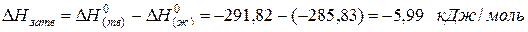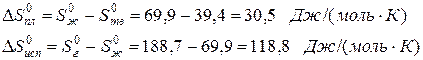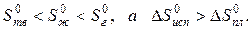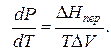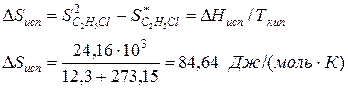ТЕПЛОВЫЕ ЭФФЕКТЫ ФАЗОВЫХ ПЕРЕХОДОВ.
УРАВНЕНИЕ КЛАПЕЙРОНА – КЛАУЗИУСА.
Переход компонента из одной фазы в другую сопровождается выделением или поглощением теплоты, которую можно определить количественно на основе фундаментального уравнения термодинамики:
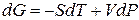
ВЫВОД И АНАЛИЗ УРАВНЕНИЯ КЛАПЕЙРОНА – КЛАУЗИУСА.
Для любого равновесного перехода вещества из одной фазы α в другую фазу β, применяя уравнение (*) к каждой из фаз, можно написать
Индексы α и β отражают принадлежность параметров к соответствующей фазе. В равновесных условиях между фазами α и β изменение энергии Гиббса отсутствует, т.е.
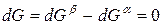
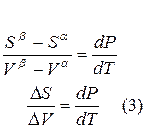
Для равновесного обратимого процесса согласно уравнениям 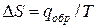
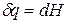
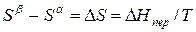
а уравнение (3) примет вид
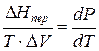
где ∆Hпер – теплота фазового перехода.
Тепловой эффект, сопровождающий фазовый переход, определяется следующим образом:
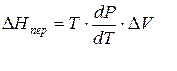
Клапейрона–Клаузиуса
где ∆V – изменение объема в результате фазового перехода; dP/dT – изменение давления в зависимости от температуры при сохранении равновесия между двумя фазами.
Уравнение Клапейрона–Клаузиуса связывает тепловой эффект процесса с изменением давления насыщенного пара, температурой и изменением объема в процессе фазового перехода.
Для процессов испарения ж→п и сублимации тв→п уравнение Клапейрона–Клаузиуса можно представить следующим образом:
где ∆Hисп , ∆Hсуб – теплоты испарения и сублимации; Vп, Vж, Vтв – мольные объемы пара, жидкости и твердого тела соответственно.
В процессе испарения и сублимации наблюдается значительное изменение удельного объема ∆V и существенное изменение величины dP/dT. При плавлении, напротив, изменение ∆V невелико, и величина dP/dT незначительна.
Пример 1. Проведем расчет по уравнению Клапейрона–Клаузиуса температуры плавления фенола Тпл. Плотность твердого фенола ρтв при атмосферном давлении составляет 1,072∙10 3 кг/м 3 , а жидкого ρж = 1,056∙10 3 кг/м 3 ; теплота плавления ∆Hпл = 1,045∙10 5 Дж/кг; температура замерзания 314,2 К. Определим dP/dT и температуру плавления при Р = 5,065∙10 7 Па:
Прирост температуры плавления при повышении давления на 1 атм ( 1,013∙10 5 Па) составляет 4,525∙10 -8 град/Па. При увеличении давления до 5,065∙10 7 Па температура плавления увеличивается на ∆T = (dT/dP)∆P = 4,525∙10 -8 ∙ 5,065∙10 7 = 2,29 К, т.е. составит Тпл = 314,2+2,29 = 316,49 К.
Следует иметь в виду, что в процессе плавления у большинства веществ Vж > Vтв , тогда ∆V>0 и при повышении давления Р↑ температура плавления повышается Т↑.
Однако, такие вещества как вода (Н2О), висмут (Bi), имеют объем твердой фазы Vтв больше, чем объем жидкой фазы Vж уд = 10 -3 м 3 /кг и Vтв уд = 1,091·10 -3 м 3 /кг; теплота плавления ∆Hпл = 332,4 кДж/кг:
Это значение показывает, что для понижения температуры таяния льда на один градус Кельвина необходимо увеличить давление на 1,34∙10 7 Па, т.е. примерно на 134 атмосферы, что нереально, поскольку такое давление лед не выдерживает – трескается.
Таяние льда происходит в основном в результате трения и превращения работы в теплоту при скольжении конька по льду, а не за счет повышения давления на лед.
Уравнение для процесса испарения 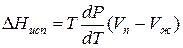
Пар подчиняется законам идеального газа: PV=RT 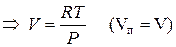
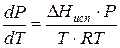
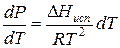
Проведем интегрирование уравнения (1) в пределах от Т1 до Т2 и соответственно от Р1 до Р2 при условии, что в области невысоких давлений пара ∆Нисп ≈ const; в результате интегрирования получим:
∆Нисп / R = const, выносим за знак интеграла
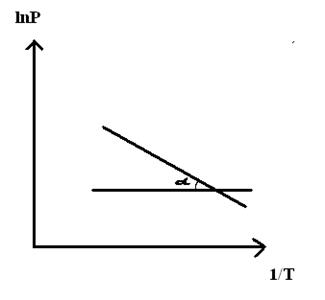
При помощи уравнения (2) можно графически определить значения теплоты испарения, если известны давления Р1 и Р2 и соответствующие им температуры испарения Т1 и Т2 . Для этого необходимо отложить на оси абсцисс значения обратной температуры, а на оси ординат – lnP.
Зависимость lnP от 1/Т будет линейной, а тангенс угла наклона этой прямой равен 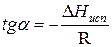
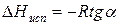
Расчетные значения ∆Нисп получаются с достаточной для практики точностью, не уступающей точности непосредственного измерения. Возможно использование уравнения (2) для обратного расчета, когда по значению ∆Нисп определяют изменение давления при изменении температуры в процессе испарения.
Теплоту фазовых переходов можно определить и по величине стандартной энтальпии образования, в зависимости от фазового состояния продуктов реакции.
Пример. Лучше всего это показать на примере теплоты образования воды из газообразных кислорода и водорода, которая составляет
для водяного пара ∆Н(г) 0 = -241,82 кДж/моль; для воды в жидком состоянии ∆Н(ж) 0 = -285,83 кДж/моль; для льда ∆Н(тв) 0 = -291,82 кДж/моль. Теплота конденсации воды равна:
а теплота превращения воды в лед:
Как видно, тепловой эффект фазовых переходов значительно меньше теплоты образования веществ.
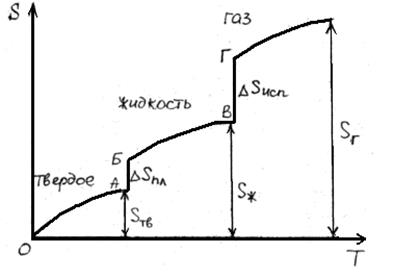
В результате фазовых переходов происходит изменение энтропии. Такие изменения в зависимости от температуры представим на рисунке.
Как известно, энтропия идеального кристалла при абсолютном нуле равна нулю. С ростом температуры атомы (ионы) флуктуировать относительно равновесного положения, число возможных способов их размещения растет, и энтропия увеличивается (ΔS>0). При достижении температуры плавления (точка А на рисунке) кристаллическая решетка разрушается скачкообразно (отрезок АБ), увеличивается термодинамическая вероятность системы W, а в соответствии с формулой S=k∙lnW (где k – постоянная Больцмана) энтропия при переходе от твердого в жидкое состояние растет. Более значительный скачок энтропии имеет место при переходе из жидкого состояния в газообразное (отрезок ВГ), когда ближний порядок расположения частиц друг относительно друга нарушается, и движение частиц становится хаотичным.
Пример. Оценим скачок энтропии на примере фазовых переходов воды:
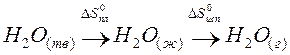
когда известны стандартные абсолютные значения энтропии Sтв 0 =39,4; Sж 0 =69,9; Sг 0 =188,7 Дж/(моль·К).
В соответствии с рисунком для воды
По известной энтальпии фазового перехода можно рассчитать изменение энтропии в соответствии с формулой
Пример.Вычислим изменение энтропии в процессе парообразования 1 моля этилхлорида при 12,3 0 С, когда теплота испарения ∆Нисп =24,16 кДж/моль.
Молекулярная масса 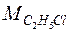
В заключение отмечу, что мы рассматривали лишь фазовые переходы I рода. При фазовых переходах I рода свойства веществ, выражаемые, например, через химический потенциал, первыми производными одной из характеристических функций, изменяются скачком при непрерывном изменении соответствующих параметров: температуры, давления, объема и энтропии. При этом выделяется или поглощается теплота перехода ∆Нпер в соответствии с уравнением Клапейрона–Клаузиуса.
Кроме них, однако, существуют фазовые переходы II рода. Они не сопровождаются выделением или поглощением теплоты, для них уравнение Клапейрона–Клаузиуса теряет смысл. Эти переходы характеризуют изменения в системе, которые не определяются объемом и запасом энергии. В этом случае первые производные одной из характеристических функций непрерывны, а вторые производные (например, теплоемкость) изменяются скачком. К фазовым переходам II рода относятся переходы парамагнетика в ферромагнетик, диэлектрика в сегнетоэлектрик, а также процессы возникновения сверхтекучести, сверхпроводимости и др.
В настоящее время насчитывается около 400 твердых минералов, для которых наблюдаются фазовые переходы II рода: рутил, анатаз, алмаз и особенно кварц, который имеет семь модификаций, причем наряду с фазовыми переходами I рода наблюдаются фазовые переходы II рода. Так, при 573 0 С и переходе модификации кварца β 
| | | следующая лекция ==> | |
| ДИАГРАММА СОСТОЯНИЯ СЕРЫ. | | | ХАРАКТЕРИСТИКА И СВОЙСТВА РАСТВОРОВ. |
Дата добавления: 2016-02-02 ; просмотров: 3141 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- ВЫВОД И АНАЛИЗ УРАВНЕНИЯ КЛАПЕЙРОНА – КЛАУЗИУСА.
- Уравнение Клаузиуса-Клапейрона: для чего оно нужно, примеры, упражнения
- Содержание:
- Для чего нужно уравнение Клаузису-Клапейрона?
- Расчет изменений давления и энтальпий парообразования
- Определение фазовых переходов
- Примеры использования
- Решенные упражнения
- — Упражнение 1
- — Упражнение 2.
- Ссылки
- 🌟 Видео
Видео:Физика. МКТ: Уравнение Менделеева-Клапейрона для идеального газа. Центр онлайн-обучения «Фоксфорд»Скачать

ВЫВОД И АНАЛИЗ УРАВНЕНИЯ КЛАПЕЙРОНА – КЛАУЗИУСА.
ТЕПЛОВЫЕ ЭФФЕКТЫ ФАЗОВЫХ ПЕРЕХОДОВ.
УРАВНЕНИЕ КЛАПЕЙРОНА – КЛАУЗИУСА.
Переход компонента из одной фазы в другую сопровождается выделением или поглощением теплоты, которую можно определить количественно на основе фундаментального уравнения термодинамики:

ВЫВОД И АНАЛИЗ УРАВНЕНИЯ КЛАПЕЙРОНА – КЛАУЗИУСА.
Для любого равновесного перехода вещества из одной фазы α в другую фазу β, применяя уравнение (*) к каждой из фаз, можно написать
Индексы α и β отражают принадлежность параметров к соответствующей фазе. В равновесных условиях между фазами α и β изменение энергии Гиббса отсутствует, т.е.


Для равновесного обратимого процесса согласно уравнениям 


а уравнение (3) примет вид

где ∆Hпер – теплота фазового перехода.
Тепловой эффект, сопровождающий фазовый переход, определяется следующим образом:

где ∆V – изменение объема в результате фазового перехода; dP/dT – изменение давления в зависимости от температуры при сохранении равновесия между двумя фазами.
Уравнение Клапейрона–Клаузиуса связывает тепловой эффект процесса с изменением давления насыщенного пара, температурой и изменением объема в процессе фазового перехода.
Для процессов испарения ж→п и сублимации тв→п уравнение Клапейрона–Клаузиуса можно представить следующим образом:
где ∆Hисп , ∆Hсуб – теплоты испарения и сублимации; Vп, Vж, Vтв – мольные объемы пара, жидкости и твердого тела соответственно.
В процессе испарения и сублимации наблюдается значительное изменение удельного объема ∆V и существенное изменение величины dP/dT. При плавлении, напротив, изменение ∆V невелико, и величина dP/dT незначительна.
Пример 1. Проведем расчет по уравнению Клапейрона–Клаузиуса температуры плавления фенола Тпл. Плотность твердого фенола ρтв при атмосферном давлении составляет 1,072∙10 3 кг/м 3 , а жидкого ρж = 1,056∙10 3 кг/м 3 ; теплота плавления ∆Hпл = 1,045∙10 5 Дж/кг; температура замерзания 314,2 К. Определим dP/dT и температуру плавления при Р = 5,065∙10 7 Па:
Прирост температуры плавления при повышении давления на 1 атм ( 1,013∙10 5 Па) составляет 4,525∙10 -8 град/Па. При увеличении давления до 5,065∙10 7 Па температура плавления увеличивается на ∆T = (dT/dP)∆P = 4,525∙10 -8 ∙ 5,065∙10 7 = 2,29 К, т.е. составит Тпл = 314,2+2,29 = 316,49 К.
Следует иметь в виду, что в процессе плавления у большинства веществ Vж > Vтв , тогда ∆V>0 и при повышении давления Р↑ температура плавления повышается Т↑.
Однако, такие вещества как вода (Н2О), висмут (Bi), имеют объем твердой фазы Vтв больше, чем объем жидкой фазы Vж уд = 10 -3 м 3 /кг и Vтв уд = 1,091·10 -3 м 3 /кг; теплота плавления ∆Hпл = 332,4 кДж/кг:
Это значение показывает, что для понижения температуры таяния льда на один градус Кельвина необходимо увеличить давление на 1,34∙10 7 Па, т.е. примерно на 134 атмосферы, что нереально, поскольку такое давление лед не выдерживает – трескается.
Таяние льда происходит в основном в результате трения и превращения работы в теплоту при скольжении конька по льду, а не за счет повышения давления на лед.
Уравнение для процесса испарения 
Пар подчиняется законам идеального газа: PV=RT 


Проведем интегрирование уравнения (1) в пределах от Т1 до Т2 и соответственно от Р1 до Р2 при условии, что в области невысоких давлений пара ∆Нисп ≈ const; в результате интегрирования получим:
∆Нисп / R = const, выносим за знак интеграла
При помощи уравнения (2) можно графически определить значения теплоты испарения, если известны давления Р1 и Р2 и соответствующие им температуры испарения Т1 и Т2 . Для этого необходимо отложить на оси абсцисс значения обратной температуры, а на оси ординат – lnP.
Зависимость lnP от 1/Т будет линейной, а тангенс угла наклона этой прямой равен 

Расчетные значения ∆Нисп получаются с достаточной для практики точностью, не уступающей точности непосредственного измерения. Возможно использование уравнения (2) для обратного расчета, когда по значению ∆Нисп определяют изменение давления при изменении температуры в процессе испарения.
Теплоту фазовых переходов можно определить и по величине стандартной энтальпии образования, в зависимости от фазового состояния продуктов реакции.
Пример. Лучше всего это показать на примере теплоты образования воды из газообразных кислорода и водорода, которая составляет
для водяного пара ∆Н(г) 0 = -241,82 кДж/моль; для воды в жидком состоянии ∆Н(ж) 0 = -285,83 кДж/моль; для льда ∆Н(тв) 0 = -291,82 кДж/моль. Теплота конденсации воды равна:
а теплота превращения воды в лед:
Как видно, тепловой эффект фазовых переходов значительно меньше теплоты образования веществ.
В результате фазовых переходов происходит изменение энтропии. Такие изменения в зависимости от температуры представим на рисунке.
Как известно, энтропия идеального кристалла при абсолютном нуле равна нулю. С ростом температуры атомы (ионы) флуктуировать относительно равновесного положения, число возможных способов их размещения растет, и энтропия увеличивается (ΔS>0). При достижении температуры плавления (точка А на рисунке) кристаллическая решетка разрушается скачкообразно (отрезок АБ), увеличивается термодинамическая вероятность системы W, а в соответствии с формулой S=k∙lnW (где k – постоянная Больцмана) энтропия при переходе от твердого в жидкое состояние растет. Более значительный скачок энтропии имеет место при переходе из жидкого состояния в газообразное (отрезок ВГ), когда ближний порядок расположения частиц друг относительно друга нарушается, и движение частиц становится хаотичным.
Пример. Оценим скачок энтропии на примере фазовых переходов воды:

когда известны стандартные абсолютные значения энтропии Sтв 0 =39,4; Sж 0 =69,9; Sг 0 =188,7 Дж/(моль·К).
В соответствии с рисунком для воды
По известной энтальпии фазового перехода можно рассчитать изменение энтропии в соответствии с формулой
Пример.Вычислим изменение энтропии в процессе парообразования 1 моля этилхлорида при 12,3 0 С, когда теплота испарения ∆Нисп =24,16 кДж/моль.
Молекулярная масса 
В заключение отмечу, что мы рассматривали лишь фазовые переходы I рода. При фазовых переходах I рода свойства веществ, выражаемые, например, через химический потенциал, первыми производными одной из характеристических функций, изменяются скачком при непрерывном изменении соответствующих параметров: температуры, давления, объема и энтропии. При этом выделяется или поглощается теплота перехода ∆Нпер в соответствии с уравнением Клапейрона–Клаузиуса.
Кроме них, однако, существуют фазовые переходы II рода. Они не сопровождаются выделением или поглощением теплоты, для них уравнение Клапейрона–Клаузиуса теряет смысл. Эти переходы характеризуют изменения в системе, которые не определяются объемом и запасом энергии. В этом случае первые производные одной из характеристических функций непрерывны, а вторые производные (например, теплоемкость) изменяются скачком. К фазовым переходам II рода относятся переходы парамагнетика в ферромагнетик, диэлектрика в сегнетоэлектрик, а также процессы возникновения сверхтекучести, сверхпроводимости и др.
В настоящее время насчитывается около 400 твердых минералов, для которых наблюдаются фазовые переходы II рода: рутил, анатаз, алмаз и особенно кварц, который имеет семь модификаций, причем наряду с фазовыми переходами I рода наблюдаются фазовые переходы II рода. Так, при 573 0 С и переходе модификации кварца β 
Видео:Физическая химия # 2. Вывод уравнения Клаузиуса-КлапейронаСкачать

Уравнение Клаузиуса-Клапейрона: для чего оно нужно, примеры, упражнения
Уравнение Клаузиуса-Клапейрона: для чего оно нужно, примеры, упражнения — Наука
Видео:Урок 156. Уравнение состояния идеального газа. Квазистатические процессыСкачать

Содержание:
В Уравнение Клаузиуса-Клапейрона Он связывает изменения давления пара и температуры с фазовым переходом или изменением состояния. Это применимо для сублимации, испарения, плавления или даже при изменении кристаллической фазы. Стоит отметить, что это уравнение применимо к чистому веществу, которое находится в равновесии.
Это уравнение выводится из термодинамических законов и диаграмм P-T для вещества, где наблюдается линия сосуществования; то, что разделяет две разные фазы (жидкость-пар, твердое тело-жидкость и т. д.). Чтобы пересечь эту линию, необходим приток или потеря тепла, например, энтальпия парообразования ΔHvap.
На изображении выше показано уравнение Клаузиуса-Клапейрона до его интегрирования. Обычно применяется для систем жидкость-пар, где используется ΔH.vap и вы хотите рассчитать, каким будет давление пара жидкости при определенной температуре. Он также служит для вычисления ΔHvap определенной жидкости в диапазоне температур.
Уравнение Клаузису-Клапейрона также довольно часто используется для изучения изменений давления в летучих твердых телах; то есть энтальпия сублимации ΔHсуб.
Видео:Уравнение КЛАПЕЙРОНА-КЛАЗИУСА | МОЛЕКУЛЯРКА (лекция) - КАРАВАЕВ В. А. ФизФак МГУСкачать

Для чего нужно уравнение Клаузису-Клапейрона?
Видео:Теплофизика Л7. Фазовые переходы. Уравнение Клапейрона - Клаузиуса. Уравнение Ван-дер-ВаальсаСкачать

Расчет изменений давления и энтальпий парообразования
Из приведенного выше уравнения Клаузиуса-Клапейрона мы переходим к некоторым математическим соображениям, чтобы наконец выполнить интегрирование. Например, для системы жидкость-пар предполагается, что ΔHvap не меняется с температурой, и что ΔV соответствует исключительно объему пара, без учета объема жидкости (Vпар-Vжидкость = Vпар).
Предполагая, что пар ведет себя как идеальный газ и интегрирует, получается интегральное уравнение Клаузиуса-Клапейрона:
Это уравнение соответствует уравнению линии, изображенной на графике:
Ln P против 1 / T
И отрицательный наклон которой равен (ΔH / R). Следовательно, чтобы это уравнение выполнялось, ΔH должна быть постоянной в интервале температур (T2-T1), в котором измеряется давление пара в равновесии с жидкостью.
Таким образом, если предположить, что ΔH мало изменяется в пределах малых температурных интервалов, можно использовать уравнение этой линии для прогнозирования изменений давления пара жидкости; и даже больше, его ΔH испарения может быть определено.
Чем больше рассматриваемые диапазоны температур, тем больше отклонение этого уравнения от экспериментальных данных и тем меньше оно будет верным.
Видео:Бушина Т. А. - Молекулярная физика - Реальные газы. Уравнение Ван-дер-ВаальсаСкачать

Определение фазовых переходов
Таким образом, уравнение Клаузиуса-Клапейрона становится развитием касательной к линии сосуществования двух физических фаз, которая наблюдается на любой диаграмме P-T для вещества.
Если происходит изменение фазы, будет изменение крутизны, и ΔH не будет прежним. Поэтому, когда очевидны сильные отклонения и уравнение не удается в течение длительного времени, это признак того, что в данном температурном диапазоне вещество претерпевает еще один фазовый переход. Другими словами, это уже не система жидкость-пар, поскольку она проходит линию сосуществования, соответствующую равновесию твердое тело-жидкость или твердое тело-пар.
Видео:Фазовые диаграммы. Тройная точка. Критическое состояние вещества. 10 класс.Скачать

Примеры использования
— Уравнение Клаузиуса-Клапейрона использовалось в метеорологии для изучения поведения облаков, даже тех, которые присутствуют на других планетах или лунах с атмосферой.
— Он использовался для определения энтальпии плавления различных металлов, таких как натрий и галлий, и для экстраполяции их давления паров при очень высоких температурах.
— Он также использовался для определения энтальпии испарения таких веществ, как газообразный хлор, четыреххлористый углерод, жидкая вода, лед и йод.
— Он также служил для изучения фазовых изменений в кристаллических структурах. В этом последнем примере интегрированное уравнение Клаузиуса-Клапейрона выглядит заметно иначе, поскольку для ΔV нельзя сделать те же соображения, что и для системы жидкость-пар. На этот раз изменения объема от одной фазы к другой невелики.
Видео:Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Решенные упражнения
Видео:Второе начало термодинамики. Часть 4. Неравенство Клаузиуса.Скачать

— Упражнение 1
Давление паров льда составляет 4,58 торр при 0 ° C и 1,95 торр при -10 ° C. Какова его энтальпия сублимации в этом температурном диапазоне?
Обратите внимание, что у нас есть два давления и две температуры:
Т1 = 0 ° C + 273 = 273 К
Т2 = -10 ° C + 273 = 263 К
Мы переводим единицы температуры из ° C в K, так как газовая постоянная R имеет K в своих единицах:
Таким образом, мы используем интегрированное уравнение Клаузиуса-Клапейрона и решаем относительно ΔHсуб, который будет выглядеть так:
Для большего удобства мы перейдем к замене только числами, но зная, что последней единицей будет Джоуль:
ΔHсуб = — (8,314) Ln (1,95 / 4,58) / (1/263 — 1/273)
Или 51,07 Дж с учетом нескольких десятичных знаков. Это значение будет показывать колебания в зависимости от интервалов T2-T1 и определенное давление пара.
Видео:Коробов М. В. - Физическая химия. Часть 1 - Фазовые диаграммы. Фазовые переходыСкачать

— Упражнение 2.
Температура кипения этанола при давлении 760 торр (1 атм) составляет 78,3 ° C, а его энтальпия испарения составляет 39,3 кДж. Каким будет давление его пара при температуре 46 ° C?
Т1 = 78,3 ° С + 273 = 351,3 К
Т2 = 46 ° С + 273 = 319 К
ΔHvap = 39,3 кДж или 39300 Дж
Таким образом, мы должны найти P2 интегрированного уравнения Клаузиуса-Клапейрона. Опять же, единицы измерения будут опущены для удобства, и расчеты будут проводиться поэтапно:
Ln (P2/760) = -(39300/8.314) (1/319 – 1/351.3)
Применяя экспоненциальную функцию к обеим сторонам уравнения, чтобы иметь возможность найти P2 Мы будем иметь:
Чем ниже температура (46 ° C), тем ниже давление пара (195 торр). Фактически, поскольку этанол имеет давление 760 торр при 78,3 ° C, мы говорим о его нормальной температуре кипения. Это ожидаемое поведение для всех жидкостей.
В целом упражнения Клаузиуса-Клапейрона этого типа состоят из очистки P2, Т2 или ΔH испарения или сублимации. Расчеты заметно меняются, когда необходимо учитывать ΔV, особенно когда речь идет о системах или равновесиях твердое тело-жидкость.
Видео:Бушина Т. А. - Молекулярная физика - Фазовые переходыСкачать

Ссылки
- Уиттен, Дэвис, Пек и Стэнли. (2008). Химия. (8-е изд.). CENGAGE Обучение.
- Википедия. (2020). Соотношение Клаузиуса-Клапейрона. Получено с: en.wikipedia.org
- Государственный университет Сан-Хосе. (н.д.). Уравнение Клаузиуса-Клапейрона:
Его вывод и применение в метеорологии. Получено с: sjsu.edu - Боднер Групп. (н.д.). Уравнение Клаузиуса-Клапейрона. Получено с: chemed.chem.purdue.edu
- Чие К. и Ценсулло А. (18 мая 2020 г.). Уравнение Клаузиуса-Клапейрона. Химия LibreTexts. Получено с: chem.libretexts.org
- Уолтер Дж. Мур. (1962). Физическая химия. (Четвертый выпуск). Лонгманс.
Как мотивировать команду на работе: 8 советов
Тюк обыкновенный: характеристика, среда обитания, размножение, кормление
🌟 Видео
Термодинамика | уравнение МайераСкачать

Коробов М. В. - Физическая химия. Часть 1 - Фазовое равновесиеСкачать

Грибов В.А. - Термодинамика и статистическая физика I - Равновесие фаз в ТД-системахСкачать

Грибов В.А. - Термодинамика и статистическая физика I - Фазовые переходы 2-го родаСкачать

Консультация по термодинамике. Часть 2. Билеты 11-17Скачать

Лекция №6 (Булыгин В.С.)Скачать

Законы Термодинамики. Что Такое Термодинамика?Скачать

Лекция №6 "Фазовые переходы. Газ Ван-дер-Ваальса"Скачать

Коробов М. В. - Физическая химия. Часть 1 - Основные понятия, свойства системыСкачать