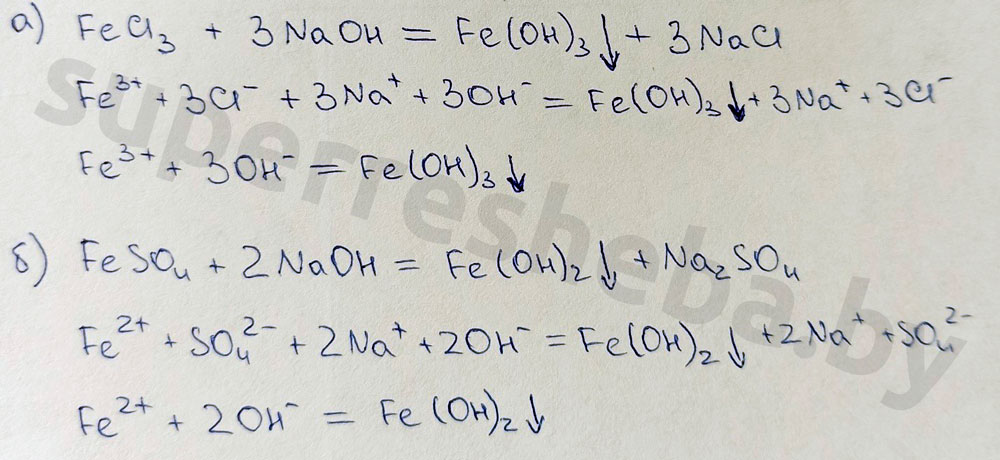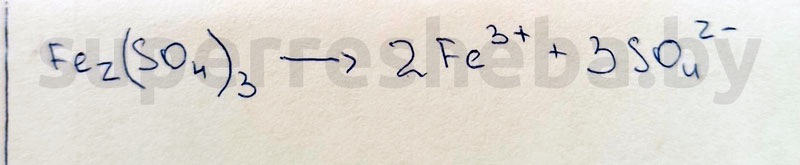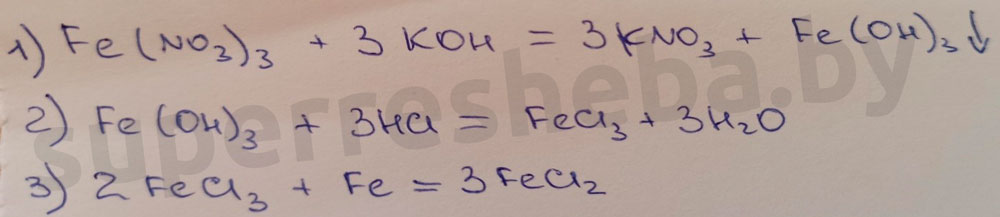Ионы железа ( III ) в растворе можно определить с помощью качественных реакций. Проведем некоторые из них. Возьмем для опыта раствор хлорида железа ( III ).
1. Качественная реакция на ион железа ( III )– реакция со щелочью.
Если в растворе есть ионы железа ( III ), образуется гидроксид железа ( III ) Fe(OH)3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа ( II ) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа ( III ).
Видео:Реакция железа(III) c роданид-ионом: качественная реакция на ионы Fe(3+)Скачать

FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl
2. Качественная реакция на ион железа ( III ) – реакция с желтой кровяной солью.
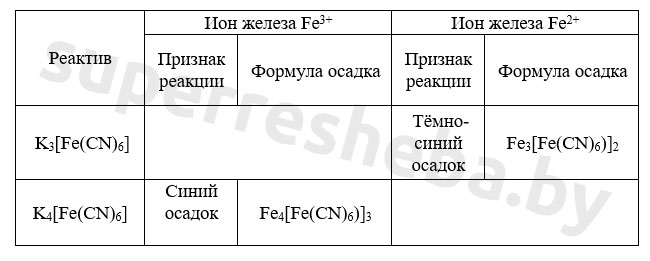
Желтая кровяная соль – это гексацианоферрат калия K 4 [ Fe ( CN )6]. (Для определения железа ( II ) используют красную кровяную соль K 3 [ Fe ( CN )6]). К порции раствора хлорида железа прильем раствор желтой кровяной соли. Синий осадок берлинской лазури* показывает на присутствие в исходном растворе ионов трехвалентного железа.
3. Качественная реакция на ион железа ( III ) – реакция с роданидом калия.
Вначале разбавляем испытуемый раствор – иначе не увидим ожидаемой окраски. В присутствии иона железа ( III ) при добавлении роданида калия образуется вещество красного цвета. Это ‑ роданид железа ( III ). Роданид от греческого «родеос» — красный.
Берлинская лазурь была получена случайно в начале 18 века в Берлине красильных дел мастером Дисбахом. Дисбах купил у торговца необычный поташ (карбонат калия): раствор этого поташа при добавлении солей железа получался синим. При проверке поташа оказалось, что он был прокален с бычьей кровью. Краска оказалась подходящей для тканей: яркой, устойчивой и недорогой. Вскоре стал известен и рецепт получения краски: поташ сплавляли с высушенной кровью животных и железными опилками. Выщелачиванием такого сплава получали желтую кровяную соль. Сейчас берлинскую лазурь используют для получения печатной краски и подкрашивания полимеров .
Оборудование: колбы, пипетка.
Техника безопасности . Соблюдать правила обращения с растворами щелочей и растворами гексацианоферратов. Не допускать контакта растворов гексацианоферратов с концентрированными кислотами.
Постановка опыта – Елена Махиненко, текст – к.п.н. Павел Беспалов.
Видео:Химия 9 классы, тема "Качественные реакции на ион Fe 3+" (урок Швецовой Елены Евгеньевны)Скачать

Лаб. 13
Составьте уравнение химических реакций обнаружения ионов железа в молекулярном и ионном виде:
Составьте уравнения химических реакций в молекулярном виде, назовите продукты реакций.
В результате качественных реакций на ионы железа со щелочью мы наблюдаем выпадение бурого осадка гидроксида железа (III) и белого осадка гидроксида железа (II). А в результате реакций с гексацианоферратами калия образуются осадки синего цвета: турнбулева синь и берлинская лазурь. Все реакции протекают в растворе или расплаве.
1. Составьте уравнение электролитической диссоциации сульфата железа (III).
2. Укажите возможные степени окисления железа и приведите формулы соответствующих веществ.
+6 – H2FeO4 (в свободном виде не существует)
3. Как доказать качественный состав сульфата железа (II). Составьте уравнения химических реакций
4. Составьте уравнения химических реакций для осуществления превращений F e ( N O 3 ) 3 → F e ( O H ) 3 → F e C l 3 → F e C l 2 . mathrm. F e ( N O 3 ) 3 → F e ( O H ) 3 → F e C l 3 → F e C l 2 .
5. В пробирки с растворами солей по каплям добавили гидроксид натрия до появления признаков реакции. Заполните таблицу, указав признаки возможных реакций.
Видео:Химия. 9 класс. Качественные реакции на катионы Fe2+, Fe3+, CU2+, взаимодействие со щелочамиСкачать

Генетические ряды железа Fe2+ и Fe3+. Качественные реакции на ионы Fe2+ и Fe3+
Разделы: Химия
Цель урока: Актуализация и углубление знаний учащихся о химических свойствах железа и его соединений.
Задачи:
- Образовательные – на основании полученных ранее знаний о строении атомов, основных классах соединений, химических свойствах веществ, составить генетические ряды железа (II),(III). Научить определять опытным путем катионы железа и совершенствовать умения обучающихся, записывать химические реакции в молекулярном, ионном видах;
- Развивающие – продолжить развитие логического мышление у учащихся, способность самостоятельно мыслить и делать выводы, формулировать гипотезы и проводить их опытную проверку, опираясь на знания химии; совершенствовать умения работать с лабораторным оборудованием и реактивами;
- Воспитательные – формирование положительной мотивации учения и здорового образа жизни; продолжить формирование научного мировоззрения учащихся; воспитывать культуру общения через работу в группах; воспитывать наблюдательность, пытливость, инициативность, стремление к самостоятельному поиску.
Тип урока: комбинированный (системно-деятельностный подход)
Методы и методические приемы обучения: проблемно-поисковый, исследовательский, словесный.
Оборудование и реактивы:
- Лист – инструкция, карточки
- Пробирки, пластмассовые штативы.
- Растворы: FeSO4, FeCl3, NaOH, K3[Fe(CN)6], K4[Fe(CN)6], KSCN.
Ход урока
1. Организационный момент. (слайд 1) – заставка.
— Здравствуйте. Сегодня на уроке нам предстоит открыть новые знания, и актуализировать известное.
2. Актуализация полученных знаний
— Тему урока мы сформулируем вместе в процессе работы. Я загадаю Вам загадку, а Вы должны угадать, о чем пойдет речь на уроке.
“Загадка”: (слайд 2 )
Очень древний я металл,
Счёт столетьям потерял.
Был нескромным я не в меру,
Тысячи лет до нашей эры.
А за блеск, мерцавший холодом,
Люди там платили золотом!
Я давно в названии века, (слайд 3 )
В организме человека.
Называют мной характер,
Из меня почти весь трактор.
Очень в яблоке полезно,
И зовут меня . (Железо)
Железо — атом химического элемента из ПСХЭ Д.И. Менделеева.
3. Фронтальный опрос:
Какие формы существования характерные для железа вы знаете? — (атомы или ионы); (слайд 4 )
- ион – это ?(заряженная частица);
- какую валентность в основном проявляет железо? — (II, III);
- а степень окисления? — (+2,+3).
В каком виде железо встречается в природе? -(в виде соединений, в чистом виде – метеоритное железо) (слайд 5).
Сегодня мы с вами проведём научное исследование и узнаем много нового про железо- жизненно важный элемент. А кто -нибудь из вас сможет мне сказать почему я его назвала жизненно важным. (ответы учащихся).
А как вы думаете в наших с вами организмах железо в какой форме существует? (соединений, ионной) (ответы учащихся)
Железо один из химических элементов, который играет огромную роль, как в живой так и в неживой природе.
В организме (слайд 6) каждого человека есть кровь, в состав которой входят красные кровяные тельца – (эритроциты), а их количество зависит от количества гемоглобина – образованного ионом железа (+2). Железо не синтезируется в нашем организме, а поступает к нам с пищей. (слайд 7) Это значит, что мы с вами должны правильно — сбалансированно питаться. Чтобы количество ионов железа поступающих в наш организм и соответственно гемоглобина синтезирующегося в организме было достаточным.
В неживой природе (слайд 8 ) мы с вами сталкиваемся с различными соединениями железа, которые находят применение в промышленности, а следовательно в жизни каждого человека.
Наш Кузбасс (слайд 9 ) – промышленный регион, в котором развита металлургическая промышленность, Новокузнецк – город в котором несколько крупнейших металлургических гигантов Сибири.
Вспомните, как называются соединения железа, которые вы видите(слайд 10 ), у вас на столах в двух стопках лежат карточки с формулами соединений железа. Я вас попрошу распределить карточки на 2 группы и объяснить, какой признак вы брали за основу. На доске необходимо выполнить, это задание.
А как вы думаете, эти вещества как – то связаны друг с другом? Сейчас попробуйте проследить эту связь, и разместить соединения железа в определённой последовательности. (слайд 11 )Кто выполнит это задание на доске? Составление цепочки веществ. Работа в парах. Что же вы сейчас составили? Можно ли дать какую – то характеристику данному ряду? (варианты ответов). Подвести к понятию генетического ряда(генетика – ген).
Вот мы с вами и сформулировали первую часть темы нашего урока.
Генетические ряды железа Fe +2 и Fe +3 . А как вы думаете, что мы ещё научимся делать на уроке. Если есть Fe +2 и Fe +3 , то мы должны их как- то различить? Как мы можем это сделать? Определить состав? Значит, провести реакции, с помощью которых мы можем распознать ионы Fe +2 и Fe +3 , а такие реакции называются – качественными. ответы учащихся.(слайд 12 )
Качественные реакции на катионы железа Fe +2 и Fe +3 . Вот мы с вами и сформулировали тему урока. Запишите её в тетрадь.
Тема нашего урока: Генетические ряды железа Fe +2 и Fe +3 .
Качественные реакции на катионы железа.
Вы самостоятельно составили генетические ряды железа. Запишем их в тетрадь, составив уравнения реакций к данным схемам превращения. (слайд 13 )
Заострить внимание на составе и цвете осадков(качественное определение ионов).Химия это наука – которая учит правильно использовать вещества, обращаться с веществами. Сейчас мы с вами вспомним, правила при работе с химическими реактивами и оборудованием.(слайд 14) Вот и пришло время, которое отличает химию от всех остальных наук. Вы станете исследователями. Вы проведёте химический эксперимент. Не забывая про технику безопасности. Возьмите, пожалуйста, лист – инструкцию (Приложение 1), к проведению лабораторных опытов. (слайд 15)
Уважаемые, учёные — исследователи сформулируем цель наших опытов, а теперь задачи, которые помогут, осуществит данную цель.
Ваш первый опыт качественные реакции на катионы железа.
4. Постановка проблемы.
Л.о. №1. Качественные реакции на катионы железа. Используя химические реактивы, находящиеся у вас на столах и пробирки, с растворами солей железа вы сейчас проведёте качественные реакции на катионы железа. Возьмите пробирку с хлоридом железа (слайд 15 ). Не подписаны? Как нам быть? Предложения учащихся. Значит, мы должны что-то прилить в пробирки и наблюдать признаки химических реакций, (слайд) позволяющие нам качественно определить ионы, правильно гидроксид натрия.
Приступаете к исследованию веществ в пробирках в соответствии с инструкциями к данному опыту. Уравнения реакции запишите в молекулярном виде. Сделайте вывод. (слайд 16) Дома вы допишите в ионных видах.
(слайд 17 ) Но данные реакции не единственные, являющиеся качественными реакциями на катионы железа. Для определения ионов железа используют очень красочные реакции, вы сами в этом убедитесь. Используя лист – инструкцию проведём ещё реакции с помощью которых, можно доказать в растворах наличие ионов железа. Не забываем про технику безопасности. Сложность данных опытов в том, что одно из реагирующих веществ, является комплексным соединением, подробно изучать вы их будете в старших классах. Такие названия как :красная кровяная соль, жёлтая кровяная соль, турнбулева синь, берлинская лазурь называются историческими названиями, каждое из этих веществ имеет ещё и химическое название. Осуществляем реакции, записываем наблюдения, молекулярные уравнения реакции у вас записаны ионные вы составите дома, правильно это выполнить вам поможет инструктивная карта на вашем листе. Выполнение опытов. (слайд 18) Формулирование вывода. Обсуждение качественных реакций. (слайд 19 ) Наши исследования завершились. Где ваши знания, умения и навыки могут пригодиться? (слайд 20)
Вот наш и заканчивается наш урок. (слайд 21 ) Запишите в дневники домашнее задание: параграф 14 читать, к молекулярным уравнениям л.р. составить ионные, решить схемы превращений в тетради.
За работу на сегодняшнем уроке, мне очень приятно поставить “отличные ” отметки . (слайд 22 )
А сейчас я попрошу вас обратить внимание на слайд, может быть кто – то продолжит, то предложение, которое нравится.
Спасибо за урок. (слайд 23)
По вопросу презентации обращайтесь к автору.
📹 Видео
Качественная реакция на ион двухвалентной медиСкачать

Опыты по химии. Качественные реакции на ионы железа (II) и (III)Скачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Качественные реакции на катионы. 9 класс.Скачать

Качественная реакция на ион трехвалентного железаСкачать

Качественная реакция на ионы железа (III)Скачать

Качественная реакция на ион железа (III) I ЕГЭ по химииСкачать

Качественные реакции на железо IIIСкачать

Качественные реакции на ион аммонияСкачать

Качественные реакции на анионы. 9 класс.Скачать
Опыты по химии. Качественные реакции на нитрат-ион: взаимодействие с дифениламиномСкачать

Качественные реакции на катионы и анионы. Практическая часть. 9 класс.Скачать

Катион железа 3+. Качественная реакция.Скачать

Опыты по химии. Качественная реакция на хлорид-ионСкачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Качественная реакция на ионы железа IIIСкачать

Качественная реакция на сульфат- и карбонат-ионы.Скачать