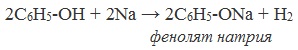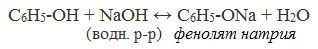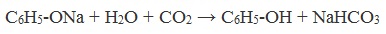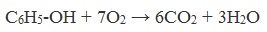При добавлении бромной воды к фенолувыпадает белый осадок трибромфенола со специфическим запахом. Бромная вода позволяет обнаруживать фенол в растворах.
Обесцвечивание бромной воды — качественная реакция на фенол.
- Взаимодействие фенола с хлоридом железа (III)
- Уравнение качественной реакции фенола с раствором хлорида железа 3
- I. Реакции с участием гидроксильной группы
- II . Реакции, с участием бензольного кольца
- III. Реакция окисления
- IV. Качественная реакция! — обнаружение фенола
- Уравнение качественной реакции фенола с раствором хлорида железа 3
- 🌟 Видео
Видео:Опыты по химии. Взаимодействие фенола с раствором хлорида железа (III)Скачать

Взаимодействие фенола с хлоридом железа (III)
При добавлении раствору фенола раствора средней соли — хлорида железа (III) FeCl3, наблюдается окрашивание жидкости в пробирке в темно-фиолетовый цвет — это качественная реакция на фенол. Реакция очень чувствительная, поэтому данный метод считается самым лучшим для обнаружения фенола.
Хлорид железа (III) является качественным реактивом для глицерина, фенола и альдегидов.
Видео:Качественная реакция на фенол (С ХЛОРИДОМ ЖЕЛЕЗА 3)Скачать

Уравнение качественной реакции фенола с раствором хлорида железа 3
Химические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца.
I. Реакции с участием гидроксильной группы
Фенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается.
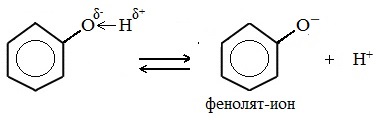
Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода:
Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет.
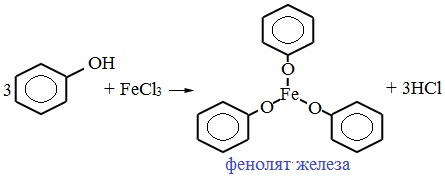
1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами)
Видеоопыт «Взаимодействие фенола с металлическим натрием»
2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов)
Видеоопыт «Взаимодействие фенола с раствором щелочи»
Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой:
По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей
C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия.
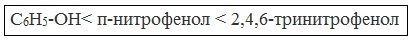
Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — )
2,4,6-тринитрофенол или пикриновая кислота сильнее угольной.
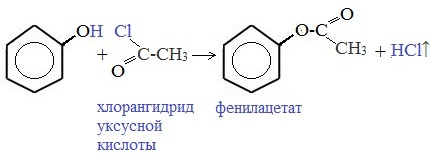
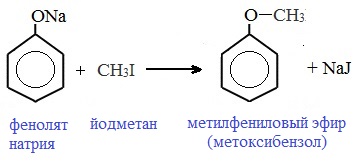
3) Образование сложных и простых эфиров
Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот:
Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами:
II . Реакции, с участием бензольного кольца
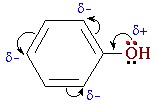
Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы):
Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце.
Реакции замещения
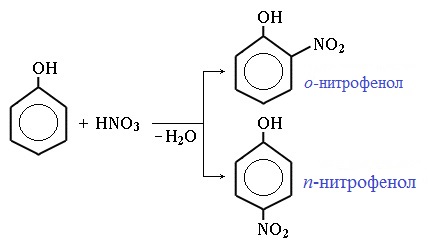
1) Нитрование
Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов:
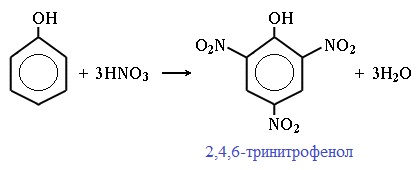
При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота):
У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной.
Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы.
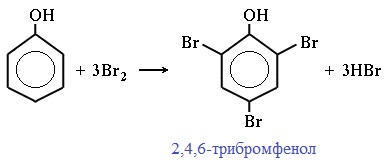
2) Галогенирование
Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ):
Образуется белый осадок трибромфенола.
Видеоопыт «Взаимодействие фенола с бромной водой»
3) Сульфирование
Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: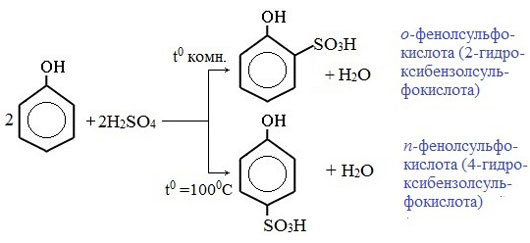
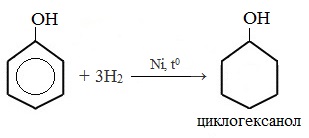
1) Гидрирование фенола
Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол).
2) Конденсация с альдегидами
При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола.
Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол.
III. Реакция окисления
Фенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет.
1) Горение (полное окисление)
Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды.
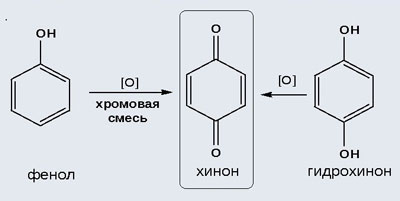
2) Окисление хромовой смесью
При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон:
IV. Качественная реакция! — обнаружение фенола
Для обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
Видеоопыт «Качественная реакция на фенол»
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол:
Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения.
Видео:Качественная реакция на фенол с хлоридом железа (qualitative reaction for phenol)Скачать

Уравнение качественной реакции фенола с раствором хлорида железа 3
Фенолы, в том числе и природные, образуют с хлоридом железа комплексные соединения с интенсивной окраской — черной, темно-синей, фиолетовой. Например, в случае простейшего фенола реакция имеет вид:
Образуется темно-фиолетовый комплекс железа (III) и фенола.
Данную реакцию используют для качественного обнаружения фенолов. В журнале уже был описан опыт по взаимодействию хлорида железа (III) FeCl3 с зеленым чаем [1]. К сожалению, разрешение видео было тогда низким. Повторим этот эксперимент и проведем некоторые аналогичные опыты.
Я заварил 3 ложки зеленого чая в 400 мл воды. Окраска оказалась слишком интенсивной, поэтому добавил к заварке равный объем воды. Налил заварку в колбу и стал по каплям прибавлять насыщенный раствор хлорида железа (III). Содержимое колбы быстро окрасилось в черный цвет. Чай содержит таннины (танины, танниды, или дубильные вещества), которые являются природными полифенолами и дают интенсивно-окрашенные комплексы с хлоридом железа (III).
__________________________________________________
1 См. статью Химические водоросли, зеленый чай и. дубовые орешки. Chemical Gardens (Colloidal Garden), Green Tea and. Galls [ссылка]
 Green Tea and Iron (III) Chloride Зеленый чай и хлорид железа (III) |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 Таннин (танин) Сложная смесь фенолов растительного происхождения (таннины, дубильные вещества). Таннины содержатся в коре, древесине, листьях, плодах (иногда семенах, корнях, клубнях) многих растений — дуба, каштана, акации, ели, лиственницы, тсуги канадской, эвкалипта, гранатового дерева, хурмы и хинного деревьев, сумаха, квебрахо и других; придают листьям и плодам терпкий вкус. Значительное количество таннинов содержится в чае, какао и кожуре граната. Таннины подавляют рост патогенных для многих растений микроорганизмов, защищают растения от поедания животными. |
 Таннин (танин) |
 Таниновая кислота (Танниновая кислота), Tannic acid — Структура |
Реакция фенолов и хлорида железа (III) ч.2 Чернильные орешки, или дубовые галлы (Gallnuts, Oak Galls) содержат много танинов (дубильных веществ) — аналогично зеленому чаю. Танины представляют собой природные полифенолы, поэтому они образуют ярко окрашенные комплексы с ионами трехвалентного железа (что характерно для соединений фенольной природы). Чернильные орешки, или дубовые галлы образуются на листьях дуба в результате жизнедеятельности насекомых-паразитов семейства орехотворок (Cynipidae). Галлы могут образовываться не только на дубе, но и на других растениях под действием разнообразных паразитов: вирусов, бактерий, нематод, грибов, но наиболее частая причина появления галлов — различные членистоногие (клещи, тли, галлицы, орехотворки). |
| Чернильные орешки, или дубовые галлы (Gallnuts, Oak Galls) |
| |
| |
| |
| |
| |
| |
| Разрезанные чернильные орешки |
| |
| |
| |
 Galls (Gallnuts) and Iron (III) Chloride. Interaction of Iron (III) with Tannin Чернильные орешки и хлорид железа (III). Взаимодействие железа (III) с танином |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 Таниновая кислота (Танниновая кислота). Tannic acid Один из компонентов танина. Раньше из сульфата двухвалентного железа и дубовых галлов получали чернила (Iron gall ink, iron gall nut ink, oak gall ink). Соли двухвалентного железа постепенно окисляются на воздухе, поэтому в них присутствует также трехвалентное железо. Кроме сульфата железа для приготовления чернил использовались и другие источники железа. 🌟 ВидеоКачественная реакция на фенол с FeCl3Скачать  Качественная реакция на фенолСкачать  Качественная реакция на ион трехвалентного железаСкачать  Получение ФТОРИДА ЖЕЛЕЗА(3) - FeF3. Реакция Фторида Натрия и Хлорида Железа. Реакция NaF и FeCl3.Скачать  Качественная реакция на фенолыСкачать  9.3. Фенол: Химические свойстваСкачать  Цветные реакции различных феноловСкачать  Качественная реакция на фенол I ЕГЭ по химииСкачать  Получение хлорида железа 3Скачать  Опыты по химии. Свойства фенолаСкачать  Получение Ацетата Железа. Fe(CH3COO)3. Реакция Уксусной Кислоты, Карбоната Натрия и Хлорида Железа.Скачать  9.2. Фенол: Способы полученияСкачать  Качественная реакция на соли железа (III) 3+Скачать  Равновесие в растворе роданида железаСкачать  ПОЛУЧЕНИЕ хлоридов железа (II и III)Скачать  Качественная реакция на хлорид, бромид, йодид ион.Скачать  Качественные реакции для обнаружения этанола, фенола и многоатомных спиртовСкачать  |