Константа равновесия определяют условия равновесия, когда концентрация (парциальные давления) является равновесными. В каком направлении пойдёт химическая реакция, если парциальное давление исходных веществ и продуктов реакции отличаются от равновесных? Ответить на этот вопрос поможет уравнение изотермы химической реакции.
Рассмотрим уравнение реакции: aA + bB ↔ cC + dD
Для изобарно-изотермического процесса изменение Гиббса равно:
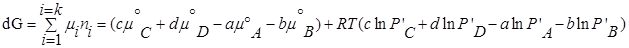
где 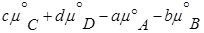
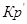
( 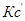
АНАЛИЗ ИЗОТЕРМЫ ВАНТ-ГОФФА
1. Главное значение изотермы реакции состоит в том, что она позволяет рассчитать ∆Gили ∆Fобратимый реакции для заданного состава реакционной смеси и определить, в каком направлении, и до какого предела протекает реакция при известных условиях.
а) Если Кр˃Кр’, то lnКр˃lnКр’; ∆G˂0- реакция идет самопроизвольно в прямом направлении.
б) Если Кр˂Кр’, то lnКр˂lnКр’; ∆G˃0- реакция протекает самопроизвольно в обратном направлении, в сторону образования продуктов.
в) Если Кр=Кр’, то lnКр=lnКр’; ∆G=0- равновесие.
Если парциальное давление всех участников реакции в данный момент времени равны атмосферному давлению
Пусть PA’=PB’=PC’=PD’=1( 1,013*10 5 Па), тоKp’=1; Тогда логарифм этого выражения будет равен нулю (lnKp’=0), а уравнение изотермы Вант – Гоффа примет вид:
∆G⁰=RTlnKp-стандартная энергия Гиббса
Выразм константу равновесия из последнего уравнения и получим:

В объеме 10л, взяли: 320(г) О2 , 10(г) Н2 и 180(г) паров воды . Определите, в какую направлении пойдёт химическая реакция: 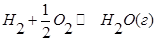
(Кс=10). Процесс изохорный.
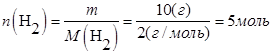
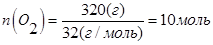
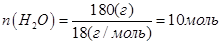
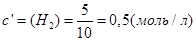
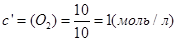
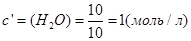
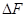
ВЛИЯНИЕ ВНЕШНИХ УСЛОВИЙ НА КОНСТАНТУ
РАВНОВЕСИЯ. УРАВНЕНИЕ ИЗОБАРЫ И ИЗОХОРЫ ВАНТ-ГОФФА (В-Г)
Константы равновесия — это величины постоянные при данной температуре. При изменении температуры константа равновесия изменяется, и довольно существенно.
Изменение константы равновесия и направления химической реакции в зависимости от температуры количественно характеризует уравнение изобары изохоры химической реакции.
ВЫВОД УРАВНЕНИЯ ИЗОБАРЫ И ИЗОХОРЫ
Разделим уравнение изотермы Вант- Гоффа на температуру:
Продифференцируем его по Т и перепишем:
Представим уравнение Гиббса – Гельмгольца в виде:
Из уравнения (1) вычтем уравнение (2):
Эти уравнения показывают влияния температуры на константу равновесия, где определяющим фактором является тепловой эффект химической реакции.
Влияние температуры на константу равновесия определяется типом реакци.
1. Если тепловой эффект реакци ∆H(∆U)˃0(эндотермическая, поглощение), то 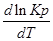
В обратном — Т↓,Кр↓.
2. Если ∆H(∆U)˂0 (экзотермическая, выделение), то 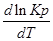
В обратном — Т↑,Кр↓.
3. Если ∆H(∆U)=0 , тов этом случае константа равновесия не зависит от температуры Кp ≠ f(T).
ИНТЕГРИРОВАНИЕ ИЗОБАРЫ В-Г
1. Приближенное интегрирование ∆Н ≠ f(Т),
тогда 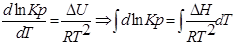
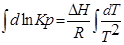
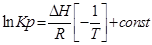
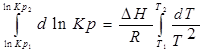
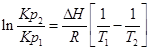
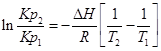
С помощью этого уравнения можно найти:
1. ∆Н (тепловой эффект реакции), если известны равновесия при двух различных температурах (Кр1(Т1) и Кр2(Т2))
2. Кр2(Т2) – константу равновесия при температуре Т2, если известна константа равновесия при другой температуре и тепловой эффект реакции (Кр1(Т1) и ∆Н).
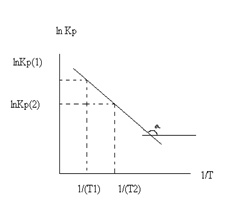
Так как после интегрирования мы получили уравнение прямой, то эта зависимость может быть представлена на графике: lnKp(1) lnKp(2)
Тангенс угла наклона прямой реакции, исходя из уравнения прямой:
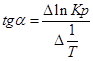
Зависимость теплового эффекта от температуры выражается уравнением:
Подставим это уравнение в уравнение изобары Вант- Гоффа:
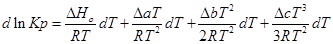
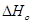
Проинтегрируем это уравнение и получим:
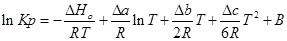
где В — постоянная интегрирования, для нахождения необходимо знать значения константы равновесия Кр при любой фиксированной температуре.
Однако проводить расчеты с использованием данного уравнения довольно сложно и используется довольно редко.
Пример. Определим изменение эффекта реакции Fe+H2O+FeO+H2, если для Т1=900К, Кр1=1,452, а для Т2=1025К Кр2=1,285.
Используем уравнение:
При повышении температуры от 900 до 1025К выделится дополнительно 7,5 кДж/моль теплоты.
| | | следующая лекция ==> | |
| Метод статистического моделирования нагрузки на ЭВМ | | | Строение и характеристика макроэргических соединений на примереАТФ |
Дата добавления: 2016-02-02 ; просмотров: 9753 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Видео:Закон Вант-ГОФФАСкачать

Уравнение изотермы вант гоффа формула с объяснением
Состояние системы, которое характеризуется равенством скоростей прямой и обратной реакции и постоянством концентрации всех веществ называется химическим равновесием.
Константа равновесия зависит от природы веществ и температуры и не зависит от исходных концентраций. В небольших количествах (1 – 2 атм) давление на константу равновесия не влияет.
Изменение константы равновесия с температурой определяется изменения энтальпии. Если D Н D Н > 0, то с увеличением температуры константа равновесия увеличивается.
Смещение равновесия – переход системы из одного равновесного состояния в другое при изменении внешних условий.
Если изменить одно из условий, при которых система находится в равновесии, то в системе усилится та реакция которая противодействует производственному изменению. На конденсированные системы давление существенного влияния не оказывает.
Будем рассматривать гетерогенные системы, много-компонентные, в которых протекают химические процессы.
С термодинамической точки зрения существуют системы изометрий закрытые. В изомерных массообменах термическая и барическая связь отсутствует. Критерием самопроизвольно протекающих процессов изомерных систем может служить изменение энтропии, как было показано, этот критерий для закрытых систем не годится, так как в закрытых системах массообмена нет, но существует термическая и барическая связь. В таких системах V , Р, С являются контролируемыми величинами, и в качестве критерия самопроизвольности процесса обычно пользуются термодинамическим потенциалом F , G .

В случае протекания химического процесса изучение системы начинают с его фазового состояния – правило фаз Гиббса. По этому правилу определяют число степеней свободы – число параметров, которые можно изменить, чтобы число фаз не изменялось. Это число свободы не контролируется в ходе процесса.
В связи с тем, что в ходе химического процесса фазовое равновесие и фазовое состояние не нарушается, такие понятия как активность и летучесть можно использовать и при рассмотрении химического равновесия.
Обычно для грубой оценки возможности простого химического процесса используются величины теплового эффекта. Однако такая оценка является в большинстве случаев не совсем точной, так как известно много реакций идущих с поглощением тепла, поэтому наиболее правильно следует в качестве критерия считать 



Самопроизвольный процесс возможен, если 








Это может иметь место в том случае, если 
Вывод: в общем случае не могут величины тепла процессов являться критериями самопроизвольности процессов.
Чтобы ответить на вопрос, при каких условиях энтропийным членом м o жно пренебречь, надо рассмотреть уравнение (1). 
Раскроем смысл всех величин уравнения (1):


Т.о., для нахождения 

Существуют три способа нахождения 
1. Исходим из сотоношения (1) и третьего начала термодинамики.
2. Основан на уравнениях изотермы, изобары и изохоры Вант-Гоффа.
3. Базируется на определении ЭДС гальванических элементов.
Она состоит из теоремы Нерста и постулатов Планка.
Теорема: согласно теореме, при 


Постулаты: при 


Постулаты Планка не распространяются на все твердые вещества.
Неправильно построенные и аморфные тела не дают нулевой энтропии, однако энтропия их при абсолютном нуле не невелика, т.о. абсолютное значение величины 



Чтобы использовать соотношение (1) 

абсолютное значение энтропии было найдено следующим образом:



но, в соответствии с третьем началом термодинамики, последнее уравнение можно преобразовать для идеально твердого тела, если принять 
Это уравнение дает возможность рассчитать абсолютное значение энтропии.
Зная энтропию для твердого тела, можно найти энтропию для жидких и газообразных веществ. Это практически делается так:
1 – обозначат энтропию твердого вещества, далее, при переходе веществ в жидкое состояние, энтропия возрастает на величину приведенной теплоты, появляется 2 член.
В подинтегральную величину входит теплоемкость – С ; затем идет испарение жидкости при Р = const .
Делается это следующим образом :
такие зависимости строятся для каждого вещества, участвующего в реакции.


Видео:Решение задач на тему: "Правило Вант-Гоффа". 1 часть. 10 класс.Скачать

Вопрос № 6.Химические реакции металлургических процессов. Оценка самопроизвольности их протекания. Уравнение изотермы Вант- Гоффа.
Читайте также:
|
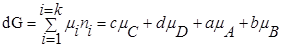
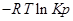
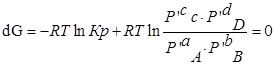
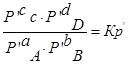
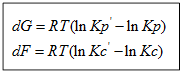
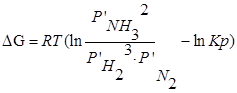
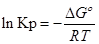
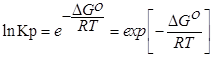
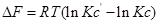
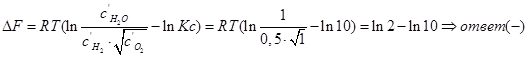
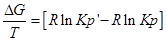
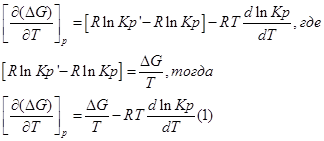
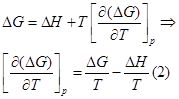
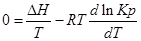
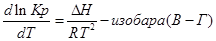
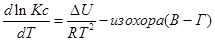
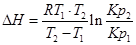
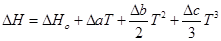
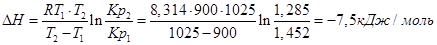














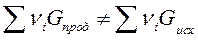
 то реакция может идти вправо.
то реакция может идти вправо. для любой реакции рассчитывается так: от потенциала веществ продуктов реакции вычитают химические потенциалы исходных веществ.
для любой реакции рассчитывается так: от потенциала веществ продуктов реакции вычитают химические потенциалы исходных веществ.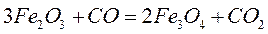

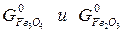
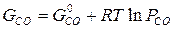
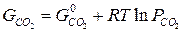
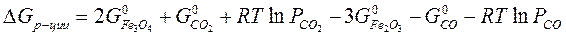
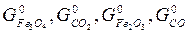 для каждой определенной температуры являются строго определенными, их разность при заданной температуре всегда одна и та же.
для каждой определенной температуры являются строго определенными, их разность при заданной температуре всегда одна и та же.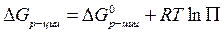 -уравнение изотермы Вант-Гоффа
-уравнение изотермы Вант-Гоффа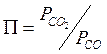 в данном случае.
в данном случае.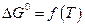 и
и 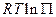 . Степень влияния зависит как от состава химической системы, так и от исходного состояния;
. Степень влияния зависит как от состава химической системы, так и от исходного состояния;