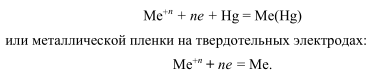2.4. Вольтамперометрический метод анализа
2.4.1. Основные законы и формулы
Методы анализа, основанные на расшифровке поляризационных кривых (вольтамперограмм), получаемых в электролитической ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения, называют вольтамперометрическим. Вольтамперограмма позволяет одновременно получить качественную и количественную информацию о веществах, восстанавливающихся или окисляющихся на микроэлектроде (деполяризаторах), а также о характере электродного процесса.
В качестве поляризующегося микроэлектрода часто применяют ртутный капельный электрод, а сам метод называют в этом случае полярографией, следуя термину, который предложил Я. Гейровский, разработавший этот метод в 1922 г .
При небольшом потенциале катода сила тока сначала медленно увеличивается с возрастанием потенциала – это так называемый остаточный ток, его значение имеет порядок 10 -7 А. По достижении потенциала восстановления на катоде начинается разряд ионов, определяемый диффузией, и сила тока резко возрастает, а затем становится постоянной – это предельный диффузионный ток.
Принципиальная схема полярографической установки: анализируемый раствор 1 находится в электролизере 2, на дне которого имеется слой ртути 3, являющийся анодом. Катодом служит ртутный капельный электрод 4, соединенный с резервауром ртути 5. Через электролизер протекает ток, напряжение которого, подаваемое на электроды, можно плавно менять с помощью реохорда или делителя напряжения 7 и измерять при этом гальванометром 6 силу тока, проходящего через раствор.
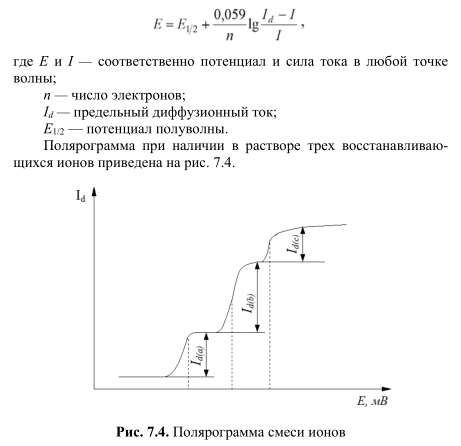
Зависимость тока I от приложенного напряжения Е при обратимом электродном процессе передается уравнением полярографической волны:
Е = Е 1/2 + ( R T / n F ) ln ( I d – I ) / I , (1)
Где Е 1/2 – потенциал полуволны; Id – диффузионный ток.
При I = Id / 2 уравнение (1) переходит в
Это соотношение показывает независимость потенциала полуволны от тока и, следовательно, от концентрации восстанавливающегося иона. Потенциал полуволны является, таким образом, качественной характеристикой иона в растворе данного фонового электролита, и определение потенциала полуволны составляет основу качественного полярографического анализа.
Количественный полярографический анализ основан на уравнении Ильковича, которое связывает диффузионный ток Id с концентрацией иона с и рядом других величин:
Id = 605 z D 1/2 m 2/3 t 1/6 c (3)
Где z — заряд иона; D – коэффициент диффузии; m – масса ртути, вытекающей из капилляра за 1 с, мг; t – время образования капли (периода капания), с.
В практике количественного полярографического анализа коэффициент пропорциональности межу концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов. При постоянных условиях полярографирования D , m , и t постоянны, поэтому уравнение (3) переходит в
При анализе некоторых систем, для которых применимость уравнения (4) установлена вполне надежно, часто используют менее трудоемкий метод стандартных растворов. Так же широко распространен в количественной полярографии и метод добавок.
Особое место в полярографическом анализе занимает амперометрическое титрование.
Амперометрическое титрование представляет собой разновидность полярографического метода анализа. Амперометрическое титрование проводится следующим образом: часть исследуемого раствора помещают в электролизер, снабженный индикаторным электродом и электродом сравнения. Между электродами устанавливают напряжение на 0,3 – 0,5 В больше потенциала полуволны (или редокс-потенциала) исследуемого вещества и приступают к титрованию. В процессе титрования отмечают показания гальванометра, на основании результатов строят кривую амперометрического титрования, откладывая на оси ординат показания гальванометра, а на оси абсцисс – объем титранта. Точка перегиба соответствует объему титранта в точке эквивалентности. Содержание определяемого вещества вычисляют по объему титранта, израсходованному в точке эквивалентности. Концентрация титранта должна превышать концентрацию раствора титруемого вещества в 10-15 раз.
При амперометрическом титровании индикаторными электродами могут быть ртутный капельный электрод, платиновый вращающийся и другие электроды. В качестве электродов сравнения применяют насыщенный каломельный, хлорсеребряный и другие электроды.
Вид кривой амперометрического титрования будет зависеть от того, какой компонент реакции титрования вступает в электродную реакцию и при каком потенциале ведется титрование. Сама реакция титрования, естественно, будет протекать независимо от этих условий.
Амперометрическое титрование следует проводить при потенциале, отвечающем области диффузионного тока. Обычно титруют при потенциале на 0,2-0,3 В более отрицательном, чем потенциал полуволны полярографически активного соединения.
Полярографическая установка служит для получения полярограмм, т.е . кривых зависимости силы тока, протекающего через раствор, от потенциала, приложенного к рабочему электроду. Прибор состоит из трех основных узлов: электролитической ячейки с рабочим электродом и электродом сравнения, источника напряжения для поляризации рабочего электрода и устройства для регистрации тока. В качестве неполяризующегося электрода сравнения используется слой ртути на дне ячейки. Применяются также и другие электроды сравнения: каломельный, ртутно-сульфатный, хлорсеребряный и др. Рабочим электродом может быть также твердый микроэлектрод, изготавливаемый из платины, золота, графита и других материалов.
Установка для амперометрического титрования может быть собрана на основе любого полярографа. Обычно для этой цели используется самая простая полярографическая установка. При этом рабочим может быть как ртутный капающий, так и твердый микроэлектрод. В качестве источников тока могут применяться аккумуляторные батареи и различные выпрямительные устройства. В комплект установки для титрования входят также микробюретка и магнитная мешалка.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Кулонометрия. Вольтамперометрия. Полярография
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Кулонометрия
Электролиз — химическая реакция окисления или восстановления на электроде под действием электрического тока. Для измерения количества, прошедшего через ячейку заряда, применяются кулонометры или электронные интеграторы. В кулонометре протекает известная реакция с 100%-ным выходом по току. Измерение массы образовавшегося в кулонометре вещества позволяет рассчитать прошедший заряд. Если будем проводить расчеты по массе выделившегося вещества, то это будет метод электрогравиметрии.
Кулонометрический метод анализа базируется на законах электролиза Фарадея:
1. Количество восстановленного или окисленного в результате электролиза вещества прямо пропорционально количеству прошедшего электричества.
2. Массы различных веществ, выделенных на электроде при прохождении 96500 Кл электричества, равны их электрохимическим эквивалентам:
Если раствор содержит несколько компонентов, имеющих различные потенциалы разложения, можно выделять их из смеси в определенной последовательности, регулируя напряжение. При увеличении напряжения сначала выделяются на катоде металлы, имеющие меньший потенциал разложения. Например, из раствора ионов Pb+2 и Cd+2 (с единичными активностями) сначала будут восстанавливаться на катоде ионы свинца (E 0 Pb = –0,126 В, Е 0 Сd = –0,402 В). Если потенциал катода сделать равным –0,35 В, то будут восстанавливаться только ионы свинца, а ионы кадмия останутся в растворе.
Кулонометрия — высокочувствительный и точный метод анализа, позволяющий определить до 10 –9 г вещества. Однако необходимо правильно подобрать напряжение (потенциал) электролиза, для того чтобы исключить протекание побочных реакций. 7.5.
Вольтамперометрия
Это электрохимический метод анализа, основанный на использовании вольтамперных зависимостей I = f(E), которые получают в процессе электролиза на поляризуемом электроде. Метод основан на расшифровке кривых зависимости тока от потенциала (поляризационных кривых), измеренных в ячейке с поляризующимся индикаторным электродом и неполяризующимся электродом сравнения.
Если к системе электродов, погруженных в раствор, приложить напряжение, то по цепи будет проходить электрический ток. На электродах будут протекать электрохимические реакции окисления на аноде и восстановления на катоде. Ион может вступать в электрохимическую реакцию, только если достигается соответствующий окислительно-восстановительный потенциал. Нередко электрохимическая реакция все равно не протекает.
Причина этого в сложном механизме электрохимического процесса, который включает:
1) перенос вещества к поверхности электрода;
2) передачу электрона (данная стадия может быть обратимой и необратимой)
— реакция Fe3+ + е – = Fe2+ обратима;
— реакция MnO4 – + 8H+ + 5 е – = Mn2+ + 4H2O необратима);
3) отвод продуктов реакции
— перенос вещества от поверхности обратно в раствор;
— растворение вещества в материале электрода (в случае ртутного электрода);
— электрокристаллизация на поверхности электрода;
— выделение газа.
Скорость электрохимического процесса определяется самой медленной его стадией. Если скорость какой-либо из стадий равна нулю, процесс вообще не протекает. Графит, платина, свинец, цинк и ртуть обладают наибольшей поляризацией, а хлоридсеребряный, каломельный и медный электроды не поляризуются. Поляризация определяется рядом параметров, ее невозможно рассчитать, необходимо установить опытным путем.
Поляризация существенно влияет на ток, протекающий через электрохимическую ячейку. Рассмотрим две электродные системы, помещенные в раствор инертного фонового электролита. Система из медного рабочего электрода и неполяризованного электрода сравнения зависит от напряжения и описывается законом Ома. Такая электродная система не представляет интереса для электрохимического анализа.
Во второй электродной системе в качестве рабочего используется поляризуемый ртутный электрод. В области потенциалов от +0,2 до –2,0 В ток через электроды практически не протекает. За пределами этого диапазона ток резко увеличивается. (Катодный ток в области отрицательных потенциалов обусловлен восстановлением ионов водорода. В положительной области потенциалов анодный ток вызван растворением ртути в результате электрохимической реакции.)
В вольтамперометрии используются ячейки, состоящие из поляризуемого рабочего и неполяризуемого электрода сравнения. Требования к рабочему электроду:
- ● площадь рабочего электрода должна быть небольшой;
- ● электрод должен быть поляризован как можно в более широкой области потенциалов;
- ● желательно, чтобы поверхность электрода постоянно обновлялась.
Если первое требование легко выполняется за счет конструкции электрода, то второе целиком зависит от материала. Электроды из благородных металлов (платины, золота) и графита поляризованы в области потенциалов от +1,3 до –1,0 В. Катодный ток связан с восстановлением ионов водорода, а анодный — с выделением кислорода. Эти электроды имеют преимущество в анодной области потенциалов. В катодной области их использование ограничено.
Анализ проводится следующим образом. На электролитическую ячейку подают плавно возрастающее напряжение от внешнего источника и регистрируют протекающий в ней ток. Если в растворе отсутствуют электрохимически активные ионы, то получается зависимость I = f(Е).
Если в растворе присутствует электрохимически активные ионы, то наблюдается волна. Если потенциал рабочего электрода меньше потенциала выделения электрохимически активного компонента, то электрохимическая реакция на нем не протекает. Незначительный ток, протекающий через ячейку, связан с образованием на поверхности электрода двойного электрического слоя (ДЭС), который можно уподобить конденсатору. Чем больше ток ДЭС, тем ниже чувствительность метода.
Когда потенциал электрода достигает величины, равной потенциалу выделения электрохимически активного компонента, происходит деполяризация рабочего электрода. Ионы начинают разряжаться на рабочем электроде с образованием амальгам на ртутном электроде:
Через электрод протекает ток электролиза (фарадеев ток), который пропорционален напряжению. Концентрация ионов в приэлектродном слое уменьшается. Происходит перенос вещества из объема раствора к поверхности электрода. При этом ток достаточно мал (порядка 10 –5 А) и не влияет на концентрацию ионов в глубине раствора. Перенос вещества протекает исключительно за счет диффузии. На электроде разряжаются все поступающие из глубины раствора ионы. Протекающий через электрод ток зависит только от скорости диффузии, которая зависит не от напряжения электрода, а от концентрации раствора, коэффициента диффузии, формы и размера электрода.
Полярография.
В 1922 г. чешским ученым Я. Гейровским был разработан полярографический метод анализа. Он использовал ртутный капающий электрод. Вольтамперометрия, использующая ртутный капающий электрод, стала называться полярографией. За открытие и развитие полярографического метода анализа в 1959 г. Я. Гейровскому была присуждена Нобелевская премия. Зависимость между приложенным напряжением и силой тока в любой точке волны описывается уравнением Гейровского — Ильковича:
Потенциал полуволны не зависит от величины диффузионного тока и является качественной характеристикой иона. Если в растворе присутствует несколько ионов, потенциалы полуволн которых различаются более чем на 100 мВ, то на полярограмме наблюдается несколько волн. Величина потенциала полуволны обычно отличается от нормального окислительно-восстановительного потенциала вследствие:
● кинетической поляризации электрода;
● влияния адсорбционных явлений;
● влияния реакций комплексообразования и осаждения.
Величины полуволн различных ионов в различных фоновых растворах при использовании различных электродов приведены в справочной литературе. Таким образом можно провести качественный анализ состава раствора по величине Е 12 . Количественной характеристикой полярограммы является величина предельного диффузионного тока, которая зависит не только от концентрации иона, но и от конструкции рабочего электрода. Для ртутного капающего электрода величина диффузионного тока связана с концентрацией уравнением Ильковича:
Большинство параметров уравнения зависят от свойств рабочего электрода и в процессе работы не изменяются. Поэтому их объединяют в константу k. В этом случае уравнение преобразуется к виду I = kс. Среди величин, включаемых в k, труднее всего экспериментально определить коэффициент диффузии. Поэтому коэффициент пропорциональности между концентрацией вещества и силой диффузионного тока обычно устанавливают с помощью стандартных растворов.
На твердотельных электродах наблюдаются максимумы, возникающие из-за высокой скорости наложения потенциала. Они подавляются подбором оптимальных условий записи полярограмм. Максимумы, связанные с осаждением вещества на электроде, не устраняются. Твердые электроды после записи каждой волны необходимо чистить.
Полярография применима не только для определения катионов, но и для органических веществ, способных восстанавливаться, например альдегидов, кетонов, перекисей, молекул с группами C=N–, –NO 2 , –NHOH, –S–S–. Это высокочувствительный и быстрый метод определения неорганических и органических веществ, один из универсальных методов определения следовых количеств веществ, позволяющий одновременно определять несколько компонентов в смеси. На рис. 7.5 приведен внешний вид одного из наиболее часто используемых полярографов.
Рис. 7.5. Полярограф АВС 1.1
По разнообразию решаемых задач вольтамперометрические методы являются наиболее универсальными среди методов электрохимического анализа. Они позволяют одновременно получать качественную и количественную информацию о находящихся в растворе электроактивных веществах, т. е. способных вступать в химические реакции под действием электрического тока.
Подбором соответствующих условий (растворителя, материала электродов, реагентов) самые различные вещества могут быть переведены в электроактивное состояние. Поэтому на сегодняшний день разработаны способы вольтамперометрического определения большинства элементов и весьма широкого круга неорганических и органических соединений в диапазоне концентраций от 10 –3 до 10 –11 мольл.
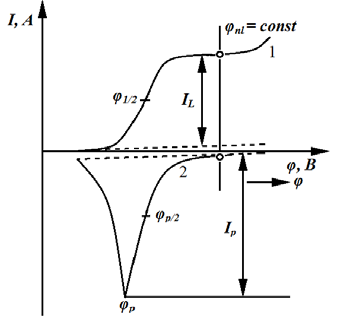
Инверсионная вольтамперометрия позволяет существенно увеличить чувствительность метода. Метод инверсионной полярографии заключается в выделении определяемого элемента из очень разбавленного раствора на ртутной капле, тонкой пленке ртути на графитовом электроде или просто на графитовом электроде электролизом с последующим анодным растворением полученного продукта. Процесс накопления определяемого компонента проходит при потенциале φ (рис. 7.6), соответствующем предельному току I /L.
Рис. 7.6. Принцип электрохомического инверсионного определения 1 — стадия накопления; 2 — стадия растворения
Зависимость силы тока I от потенциала φ при анодном растворении имеет максимум пика Ip , высота которого пропорциональна концентрации определяемого иона, а потенциал максимума φр определяется природой иона. Чем больше продолжительность накопительного электролиза, тем большее количество ионов металла переходит из раствора на электрод и тем больше возрастает чувствительность метода.
В настоящее время инверсионная вольтамперометрия является одним из важнейших методов определения следовых содержаний органических и неорганических соединений в растворах, а также анализа твердых материалов. Ее достоинства по сравнению с другими методами:
- ● возможность определения значительного числа (более 40) химических элементов и многих органических веществ;
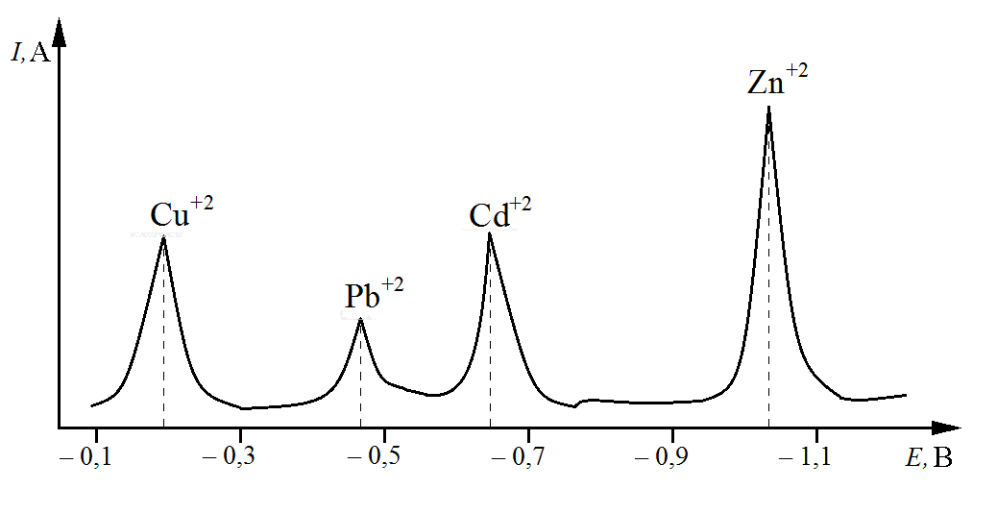
- ● возможность одновременного определения нескольких ионов металлов (рис. 7.7);
- ● низкие пределы обнаружения, достигающие для некоторых элементов (например, Cd, Bi, Tl, Pb, Sb) и органических веществ (10 –9 –10 –10 мольл);
- ● достаточно высокая селективность и хорошие метрологические характеристики;
- ● легкость компьютеризации и автоматизации аналитических определений;
- ● сравнительно невысокая стоимость приборов для инверсионной вольтамперометрии и относительная простота работы на них.
Амперометрическое титрование (потециостатическое поляризационное титрование) — это разновидность вольтамперометрического метода (наряду с полярографией). Метод основан на измерении величины тока между электродами электрохимической ячейки, к которым приложено некоторое постоянное напряжение, как функции прибавленного титранта. Определяемое вещество должно быть электрохимически активным.
При прибавлении титранта в анализируемый раствор концентрация этого вещества уменьшается или увеличивается, соответственно падает или возрастает диффузионный ток. Точку эквивалентности фиксируют по резкому изменению падения или роста диффузионного тока, что отвечает окончанию реакции титруемого вещества с титрантом. Вид кривой титрования зависит от того, какое вещество вступает в электрохимическую реакцию (рис. 7.8).
Рис. 7.7. Одновременное определение нескольких ионов металлов методом инверсионной вольтамперометрии
Рис. 7.8. Кривые амперометрического титрования а — активно титруемое вещество; б — активен титрант; в — активны титруемое вещество и титрант; г — активен продукт реакции
При амперометрическом титровании используются реакции осаждения, комплексообразования и окислительно-восстановительные. Если ни титрант, ни продукт реакции, ни определяемое вещество не являются электрохимически активными, то используют амперометрический индикатор. Это вещества, которые восстанавливаются или окисляются на электроде и взаимодействуют с титрантом после того, как определяемое вещество количественно вступит в реакцию. Поэтому диффузионный ток при титровании определяемого вещества постоянен, а после точки эквавалентности уменьшается.
- — высокой чувствительностью (до 10 –6 моль/л);
- — большой точностью (до ±0,1 %);
- — селективностью;
- — возможностью проводить титрование мутных и окрашенных растворов.
Видео:Лекция 133 Полярограммы в аналитической химииСкачать

Уравнение ильковича и уравнение гейровского ильковича
Вольтамперометрия и родственные методы. Принципиальная схема установки. Амперометрическое титрование. Возможности метода.
Вольтамперометрия основана на изучении поляризационных или вольтамперных кривых (кривых зависимости силы тока от напряжения). Вольтамперометрию, связанную с использованием ртутного капающего электрода, называют полярографией За открытие и развитие этого метода Я. Гейровскому в 1959 г. была присуждена Нобелевская премия.
Обычно в вольтамперометрии предпочитают трехэлектродные ячейки.
Рис.1. Двух- и трехэлектродные ячейки для вольтамперометрии полярографии (РЭ – рабочий электрод, ВЭ – вспомогательный электрод, ЭС – электрод сравнения).
Требования к электродам:
Вспомогательный электрод проводит ток, тогда как электрод сравнения только контролирует потенциал, а ток не проводит. Вспомогательным электродом может служить платиновая или серебряная проволока или большой слой ртути.
В качестве рабочего электрода в вольтамперометрии используют инертный электрод, способный реагировать на присутствие в растворе любого электроактивного вещества: твердый вращающийся или вибрирующий электрод, а также капающий ртутный электрод. Выбор электрода определяется главным образом интервалом изучаемых потенциалов. Для потенциалов более положительных, чем потенциал НКЭ, лучшим является платиновый электрод. Ртуть можно использовать при потенциалах более отрицательных, чем примерно +0,25 В относительно НКЭ. Применение платины в области положительных потенциалов ограничивается реакцией окисления воды (2Н2О=О2+4Н + +4е), протекающей примерно при +0,65 В в зависимости от рН. В области же отрицательных потенциалов платину можно использовать только примерно до –0,45 В, т. е. до потенциала выделения водорода (2Н + +2е=Н2 или 2Н2О+2е=Н2+20Н — ), тогда как ртуть из-за высокого перенапряжения водорода можно применять до –1,8 В в кислых и до –2,3 В в щелочных средах.
В вольтамперометрии применяют твердые микроэлектроды, изготовляемые из благородных металлов (платины, золота и др.) или графита.
Достоинства твердых электродов:
1.Возможность работы в более положительной области потенциалов (до 1,3В), чем с ртутным электродом (ртутный капающий электрод от 0,3 до –2,0 В)
Недостатки стационарных твердых электродов:
1.Нет обновления поверхности электродов.
2.Медленно устанавливается предельный ток.
Более широкое применение имеют вращающиеся и вибрирующие платиновые микроэлектроды, на которых устойчивая сила тока устанавливается быстро. При работе таких электродов раствор непрерывно перемешивается, благодаря чему к поверхности электрода ионы доставляются не только за счет диффузии, но и за счет механического перемешивания. Это значительно (в 10. 20 раз) увеличивает предельный ток по сравнению с диффузионным. По точности методы с применением твердых электродов уступают методам, использующим ртутный капающий электрод.
Капающий ртутный микроэлектрод имеет вид непрерывного потока мельчайших капелек, вытекающих из очень тонкого стеклянного капилляра.
Преимущества по сравнению с твердыми микроэлектродами:
1. Высокое перенапряжение восстановления водорода.
2. Непрерывное возобновление поверхности электрода, что предотвращает ее загрязнение и отравление.
3. Увеличение площади поверхности капающего ртутного электрода (РКЭ) за время жизни каждой капли намного превышает уменьшение тока, предсказываемое уравнением Коттреля для электрода с фиксированной поверхностью, что более удобно для количественного анализа.
Кривые ток – время (при постоянном потенциале).
Предположим, что скорость вытекания ртути постоянна и что капля имеет правильную сферическую форму вплоть до момента отрыва от капилляра. На основании этих предположений можно прийти по уравнению Ильковича:
где Iд — диффузионный ток, m — скорость вытекания ртути (мг/с). В числовой множитель входят геометрические факторы, константа Фарадея и плотность ртути.
Если зависимость тока от времени изобразить графически, то наблюдаются флуктуации тока с периодом в несколько секунд. Период капания можно варьировать, изменяя высоту столбика ртути, или электромеханически, стряхивая капли с кончика капилляра через равномерные промежутки времени. Время жизни капли слабо зависит от величины наложенного потенциала, достигая максимума при потенциале около –0,5 В относительно НКЭ.
Хотя температура в явном виде не входит в уравнение Ильковича, тем не менее это очень важный параметр, так как каждый фактор (кроме п) в этом уравнении в какой-то степени зависит от температуры. Влияние температуры проявляется главным образом через коэффициент диффузии D. При повышении температуры на один градус в интервале комнатных температур диффузионный ток возрастает на 1 – 2 процента. Поэтому при точных измерениях температуру необходимо контролировать с точностью до нескольких десятых градуса. Для качественных же и полуколичественных работ это не обязательно.
Диффузионный ток зависит также от концентрации фонового электролита; если концентрация последнего в 25 или 30 раз ниже концентрации восстанавливающегося вещества, величина диффузионного тока отличается от его нормальной величины, потому что в этих условиях восстанавливающиеся ионы переносят заметную долю тока и в результате кулоновских взаимодействий ионов с РКЭ возникает миграционный ток и уравнение Ильковича не выполняется, поскольку диффузия уже не является единственным способом массопереноса восстанавливающихся частиц к электроду.
Полярография с разверткой потенциала.
В практической полярографии, полезную информацию получают, регистрируя величину тока как функцию изменяющегося потенциала ркэ. Такие кривые автоматически записываются на полярографе.
В простейшем полярографе напряжение, подаваемое на ячейку, непрерывно увеличивают обычно в сторону отрицательных потенциалов и регистрируют ток с помощью самописца. Поскольку потенциал во времени меняется линейно, а лента самописца движется с постоянной скоростью, получаемую кривую (подпрограмму) можно интерпретировать зависимость силы тока от потенциала.
Полярограмма имеет вид кривой (а) с серией глубоких впадин, обусловленных периодическим падением капель ртути, что осложняет интерпретацию кривых ток – потенциал. Для их уменьшения разработан ряд инструментальных методов, один из которых основан на использовании электронной стробирующей системы, замыкающей измерительную цепь только на долю секунды незадолго до отрыва каждой капли (“стробированная” или “таст”-полярография) (кривая б).
Кривую можно разделить на три участка. На участке 1 потенциал электрода слишком низок для восстановления одного из присутствующих веществНебольшой ток, протекающий через ячейку, называется остаточным током. Он складывается из тока восстановления следов примесей (обычно кислорода) и так называемого тока заряжения, обусловленного тем, что поверхность раздела ртуть – раствор с оболочкой из невосстанавливающихся ионов ведет себя как конденсатор.
По мере приближения к участку 2 ток начинает возрастать и становится больше остаточного тока. Этот дополнительный ток обусловлен восстановлением ионов из раствора и выделением их в виде металла на поверхности электрода. Убыль ионов в приэлектродном слое компенсируется за счет диффузии из глубины раствора.
На участке 2 ток достигает предельной величины вследствие полного исчезновения ионов вблизи поверхности РКЭ. В результате диффузии все больше ионов непрерывно достигают поверхности электрода, и по достижении устойчивого равновесия начинает протекать постоянный ток. Скорость диффузии определяется разницей между концентрацией в массе раствора и на поверхности электрода, где она равна нулю. Эта величина предельного тока, за вычетом остаточного тока, называется диффузионным током (Id). Диффузионный ток пропорционален концентрации восстанавливающейся частицы в массе раствора.
Уравнение полярографической волны Ильковича-Гейровского .
Рассмотрим электролиз в системе, где катодом служит ртутный капающий электрод, а анодом является практически неполяризуемый каломельный электрод. Если в растворе нет веществ, способных восстанавливаться под действием электрического тока, сила тока будет пропорциональна приложенному напряжению Е (закон Ома):1=E/R.
В присутствии веществ, способных восстанавливаться на ртутном электроде в области исследуемых напряжений по достижении потенциала восстановления ионы начнут разряжаться на ртутном катоде (нередко с образованием амальгамы):
М n+ +ne — + Hg=M (Hg)
Потенциал ртутного катода, на котором протекает обратимый процесс, выражается уравнением Нернста:
где Са – концентрация амальгамы; γa – ее коэффициент активности; См – концентрация восстанавливающихся ионов в приэлектродном слое (заряд иона для простоты опущен); γМ – его коэффициент активности; аHg – активность ртути в амальгаме;Е° – стандартный потенциал электрода.
В результате процесса сила тока в цепи начнет возрастать и концентрация восстанавливающихся ионов у поверхности ртутной капли уменьшится. Однако за счет диффузии из массы раствора к поверхности капли доставляются новые порции ионов. Сила тока в цепи будет зависеть от скорости диффузии, которая пропорциональна разности концентраций в массе раствора (С 0 М) и в приэлектродном слое (СМ). Сила тока будет пропорциональна этой разности:
Вклад других, недиффузионных механизмов поступления ионов в прикатодный слой ( например, миграция ионов к катоду под действием электрического поля в условиях большого избытка индифферентного фонового электролита пренебрежимо мал. При некотором потенциале катода концентрация ионов у поверхности ртутной капли См уменьшится до ничтожно малой по сравнению с концентрацией в массе раствора, и скорость разряда ионов на катоде станет равной скорости диффузии.
Концентрация восстанавливающегося иона в глубине раствора постоянна, а концентрация в прикатодном слое близка к нулю. Поэтому разность концентраций, определяющая скорость диффузии при данной температуре, будет постоянна, что и приводит к постоянной скорости поступления ионов к катоду и постоянной силое тока, не изменяющейся при дальнейшем увеличении напряжения. Этот постоянный ток, контролируемый диффузией, называют диффузионным : Iд =kМ сМ.
Потенциал полуволны является качественной характеристикой иона и зависит от среды:
1.Природы и концентрации фонового электролита.
2.Наличие в растворе веществ, способных к комплексообразованию с определяемым ионом. Присутствие в исследуемом растворе лиганда смещает потенциал полуволны в отрицательную область, что позволяет создавать условия для определения нескольких компонентов в одном растворе без их предварительного разделения. Например, в 1 М КС1 ионы свинца (II) и таллия (I) имеют потенциалы полуволны, соответственно, –0,435 и –0,483 В и их раздельное определение неосуществимо. В 1 М NaОН потенциал полуволны свинца становится равным –0,755 В, а у таллия остается практически без изменения.
Если в растворе находится несколько веществ, потенциалы полуволны которых различаются на 100 мВ и больше, то на полярограмме будет не одна волна, а несколько – по числу восстанавливающихся ионов, а возможно и больше, так как при ступенчатом восстановлении один ион может давать две.
Для идентификации неизвестного вещества можно этим методом определить потенциал полуволны и, пользуясь таблицей потенциалов полуволны или полярографическим спектром, установить наиболее вероятный элемент.
Схема полярографической установки.
Анализируемый раствор находится в электролизере, на дне которого имеется слой ртути являющийся анодом. Часто в качестве анода используют насыщенный каломельный электрод (НКЭ). Катодом служит ртутный капающий электрод, соединенный с резервуаром ртути. Внешнее напряжение, подаваемое на электроды, можно плавно менять с помощью реохорда или делителя напряжения и измерять при этом гальванометром силу тока, проходящего через раствор.
Количественный полярографический анализ.
Методы прямой полярографии основаны на непосредственном применении уравнения полярографической волны и уравнения Ильковича.
Метод градуировочного графика . График строят по данным полярографирования нескольких стандартных растворов. На оси ординат откладывается пропорциональная силе диффузионного тока высота полярографической волны, а по оси абсцисс — концентрация анализируемого вещества. Метод дает точные результаты при условии строгой идентичности условий полярографирования стандартных растворов и неизвестной пробы
Метод стандартчых растворов . В этом методе в строго одинаковых условиях снимают полярограммы стандартного и анализируемого растворов. неизвестную концентрацию рассчитывают из пропорции. Метод применим только в условиях строгой стандартизации условий полярографирования.
Метод добавок. Определяют диффузионный ток при полярографировании исследуемого раствора и его же с добавкой известного количества стандартного раствора Сст. неизвестную концентрацию рассчитывают из пропорции. Можно использовать также графический метод. В методе добавок автоматически учитывается влияние фона и третьих компонентов, что является важным достоинством метода.
Используется для анализа смесей, содержащих ионы или вещества с близкими noтенциалами полуволны. Получать дифференциальные полярограммы можно графическим дифференцированием обычных полярограмм или с помощью специальной электрической схемы, позволяющей непосредственно записывать дифференциальную кривую во время полярографирования. Дифференциальная полярография имеет значительно более высокую разрешающую способность.
Рис.8 Полярограмма раствора, содержащего РЬ(NОз)2 и ТlNОз на фоне 2 М КNО3.
Этим методом могут быть определены свинец и таллий, у которых потенциалы полуволны на фоне 2М КNОз различаются только на 0,06 В. На интегральной полярограмме оба иона образуют одну общую волну (рис.8а), а на дифференциальных кривых четко видны два максимума (рис.8б). Методы дифференциальной полярографии более точны
Хроноамперометрия с линейной разверткой потенциала.
Обычная скорость изменения потенциала в этом методе составляет до 50 мВ/с вместо 2. 3 мВ/с в классической полярографии. Для измерения силы тока здесь вместо гальванометра используют безынерционный осциллограф.
При достижении потенциала восстановления ток резко возрастает и достигает максимума, превышая величину Id классической полярографии, поскольку происходит электровосстановление практически всех ионов приэлектродного слоя, и затем падает, так как приэлектродный слой обедняется ионами, а скорость диффузии недостаточна, чтобы пополнить дефицит за столь короткое время. Потенциал максимума на этой кривой является качественной характеристикой иона, а высота максимума пропорциональна концентрации иона. Метод имеет более низкий предел обнаружения, чем обычная вольтамперометрия.
Рис.9.Осциллографическая Рис.10.Кривая анодного полярограмма растворения
Идея метода инверсионной полярографии состоит в выделении определяемого элемента из очень разбавленного раствора на ртутной капле или тонкой пленке ртути на графитовом электроде или просто на графитовом электроде электролизом с последующим анодным растворением полученной амальгамы. Процесс накопления происходит при потенциале, соответствующем предельному току. Зависимость силы тока от напряжения при анодном растворении имеет вид характерного пика (рис.), глубина которого h пропорциональна концентрации определяемого иона, а потенциал минимума определяется природой иона. Предел обнаружения в методике инверсионной вольтамперометрии на 2. 3 порядка ниже предела обнаружения в обычных полярографических методиках. Чем больше продолжительность накопительного электролиза, тем большее количество металла перейдет из раствора в ртутную каплю и тем больше возрастет чувствительность анализа.
Амперометрическое титрование с одним поляризуемым электродом.
В этом метоле замеряют силку тока текущего между одним поляризуемым и одним неполяризуемым электродами в зависимости от количества добавленного титранта. Выбирают величину приложенного напряжения, которое должно находиться в области предельного тока титруемого вещества (Td) или титранта (Тг). В зависимости от вольтамперной характеристики веществ, участвующих в реакции при титровании: Td + Тг = R, получаются различные кривые титрования. Практически точкой эквивалентности является точка пересечения продолженных прямолинейных участков кривой титрования.
Установка для проведения измерений состоит из регулируемого источника напряжения (аккумулятора и потенциометра), к которому последовательно подключены гальванометр и измерительная ячейка. В качестве рабочих электродов применяют ртутные капельные электроды, неподвижный или вращающийся платиновый и графитовый электроды.
Рис.11 Взаимосвязь между вольтамперными кривыми и кривыми амперометрического титрования с одним поляризуемым электродом.
Амперометрическое титрование с двумя поляризуемыми электродами ( методом мертвой конечной точки). Установка соответствует описанной выше за исключением того, что электрод сравнения заменен вторым поляризуемым электродом (такого же типа как первый).
В анализируемый раствор вводят два платиновых или иных инертных электрода под небольшим постоянным напряжением (порядка 10
2 В) и в ходе титрования отмечают силу тока. До начала титрования сила тока между электродами или очень мала, или вообще не наблюдается, так как в отсутствие окислительно-восстановительной пары при столь малой разности потенциалов электродные процессы не происходят. Введение титранта вызывает появление в анализируемом растворе двух окислительно-восстановительных пар, причем до точки эквивалентности в растворе в заметных количествах будут находиться компоненты пары, образованной титруемым веществом, а после точки эквивалентности компоненты, образованные титрантом. Вид кривой титрования будет определяться, в основном, электрохимической обратимостью этих пар. Если обе окислительно-восстановительные пары обратимы сила тока будет возрастать, пока не прореагирует примерно половина ионов, затем начнет уменьшаться и упадет почти до нуля в точке эквивалентности ток в цепи снова появится.
Если система, образуемая определяемым веществом, обратима, а титрантом – необратима, кривая титрования до точки эквивалентности не будет отличаться от предыдущей кривой так как в обоих случаях сила тока в системе до точки эквивалентности контролируется электрохимически обратимой системой. Однако после точки эквивалентности возрастания силы тока не произойдет.
Если титруется электрохимически необратимая система, а титрант образует обратимую окислительно-восстановительную пару, то до точки эквивалентности тока не будет, а после точки эквивалентности он резко возрастает.
Метод амперометрического титрования с двумя индикаторными электродами достаточно точен и чувствителен: он пригоден для анализа растворов с концентрацией определяемого вещества 10 -5 моль/л и менее. В аппаратурном отношении он проще, чем метод с одним индикаторным электродом. При титровании по этому методу часто отпадает необходимость в построении кривой титрования, так как точка эквивалентности может быть определена по резкому прекращению или появлению тока.

Рис.12. Взаимосвязь между вольтамперными кривыми и кривыми амперометрического титрования с двумя поляризуемыми электродами.
Вольтамнерометрический метод применяют для определения многих металлов: кадмий, кобальт, медь, свинец, марганец. никель, олово, цинк, железо, висмут, уран, ванадий; для определения хромат-, иодат-, молибдат-ионов, а также многих органических соединений: альдегидов, кетонов, азо- и нитросоединений.
Для амперометрического титрования характерна экспрессность, его можно проводить в разбавленных растворах (до 10
5 моль/л и меньше) и анализировать мутные и окрашенные растворы.
ОБЩАЯ ХАРАКТЕРИСТИКА МЕТОДА
1.Универсален и применим к многочисленному кругу объектов.
3.Возможность определения нескольких веществ в смеси без предварительного разделения.
4.Достаточно высокая точность. Погрешность полярографического анализа в обычных условиях составляет ±2 % для растворов концентрации порядка lO -3 .-.lO-4 моль/л и около ч; 5 % для более разбавленных.
5.Применимость к анализу небольших содержаний определяемого элемента
Амперометрическое титрование характеризуется более высокой точностью и более высокой чувствительностью, чем методы прямой вольтамперометрии. Аппаратурное оформление установок амперометрического титрования несложно, особенно просты установки для титрования с двумя индикаторными электродами. Для него характерна экспрессность, его можно проводить в разбавленных растворах (до 10
5 моль/л и меньше) и анализировать мутные и окрашенные растворы.
🌟 Видео
Лекция 132 Основные соотношения полярографического метоодаСкачать

19. Метод вариации произвольных постоянных. Линейные неоднородные диф уравнения 2-го порядкаСкачать

Урок 455. Уравнение ШрёдингераСкачать

Линейное неоднородное дифференциальное уравнение второго порядка с постоянными коэффициентамиСкачать

Дифференциальное уравнение. Формула ЭйлераСкачать

Принцип наименьшего действия #2 - Уравнение Эйлера-ЛагранжаСкачать

ЛОДУ 2 порядка c постоянными коэффициентамиСкачать

Химия | Молекулярные и ионные уравненияСкачать

Графический метод решения задачи линейного программирования (ЗЛП)Скачать

12. Интегрирующий множитель. Уравнения в полных дифференциалахСкачать

Математика без Ху!ни. Кривые второго порядка. Эллипс.Скачать

Решить задачу Коши для дифференциального уравнения с помощью формулы ДюамеляСкачать

Решите уравнение ★ y'-2y=e^(2x) ★ Линейное дифференциальное уравнение 1-го порядкаСкачать
№9. Элементы вариационного исчисления. Уравнения Лагранжа-Эйлера.Скачать

Дифференциальное уравнение от Бермана ★ Решите дифференциальное уравнение 2-го порядка ★ xy''=y'Скачать

Линейное однородное дифференциальное уравнение 2-го порядка с постоянными коэффициентами.Скачать

Дифференциальные уравнения, Ремизов А. О., лекция 1, 01.09.2023Скачать