Реакции ионного обмена — реакции в водных растворах между электролитами, протекающие без изменений степеней окисления образующих их элементов.
Необходимым условием протекания реакции между электролитами (солями, кислотами и основаниями) является образование малодиссоциирующего вещества (вода, слабая кислота, гидроксид аммония), осадка или газа.
Расcмотрим реакцию, в результате которой образуется вода. К таким реакциям относятся все реакции между любой кислотой и любым основанием. Например, взаимодействие азотной кислоты с гидроксидом калия:
Исходные вещества, т.е. азотная кислота и гидроксид калия, а также один из продуктов, а именно нитрат калия, являются сильными электролитами, т.е. в водном растворе они существуют практически только в виде ионов. Образовавшаяся вода относится к слабым электролитам, т.е. практически не распадается на ионы. Таким образом, более точно переписать уравнение выше можно, указав реальное состояние веществ в водном растворе, т.е. в виде ионов:
Как можно заметить из уравнения (2), что до реакции, что после в растворе находятся ионы NO3 − и K + . Другими словами, по сути, нитрат-ионы и ионы калия никак не участвовали в реакции. Реакция произошла только благодаря объединению частиц H + и OH − в молекулы воды. Таким образом, произведя алгебраически сокращение одинаковых ионов в уравнении (2):
Уравнения вида (3) называют сокращенными ионными уравнениями, вида (2) — полными ионными уравнениями, а вида (1) — молекулярными уравнениями реакций.
Фактически ионное уравнение реакции максимально отражает ее суть, именно то, благодаря чему становится возможным ее протекание. Следует отметить, что одному сокращенному ионному уравнению могут соответствовать множество различных реакций. Действительно, если взять, к примеру, не азотную кислоту, а соляную, а вместо гидроксида калия использовать, скажем, гидроксид бария, мы имеем следующее молекулярное уравнение реакции:
Соляная кислота, гидроксид бария и хлорид бария являются сильными электролитами, то есть существуют в растворе преимущественно в виде ионов. Вода, как уже обсуждалось выше, – слабый электролит, то есть существует в растворе практически только в виде молекул. Таким образом, полное ионное уравнение данной реакции будет выглядеть следующим образом:
2H + + 2Cl − + Ba 2+ + 2OH − = Ba 2+ + 2Cl − + 2H2O
Сократим одинаковые ионы слева и справа и получим:
Разделив и левую и правую часть на 2, получим:
Полученное сокращенное ионное уравнение полностью совпадает с сокращенными ионным уравнением взаимодействия азотной кислоты и гидроксида калия.
При составлении ионных уравнений в виде ионов записывают только формулы:
1) сильных кислот (HCl, HBr, HI, H2SO4, HNO3, HClO4 ) (список сильных кислот надо выучить!)
2) сильных оснований (гидроксиды щелочных (ЩМ) и щелочно-земельных металлов(ЩЗМ))
3) растворимых солей
В молекулярном виде записывают формулы:
1) Воды H2O
2) Слабых кислот (H2S, H2CO3, HF, HCN, CH3COOH (и др. практически все органические)).
3) Слабых оcнований («NH4OH» и практически все гидроксиды металлов кроме ЩМ и ЩЗМ.
4) Малорастворимых солей (↓) («М» или «Н» в таблице растворимости).
5) Оксидов (и др. веществ, не являющихся электролитами).
Попробуем записать уравнение между гидроксидом железа (III) и серной кислотой. В молекулярном виде уравнение их взаимодействия записывается следующим образом:
Гидроксиду железа (III) соответствует в таблице растворимости обозначение «Н», что говорит нам о его нерастворимости, т.е. в ионном уравнении его надо записывать целиком, т.е. как Fe(OH)3 . Серная кислота растворима и относится к сильным электролитам, то есть существует в растворе преимущественно в продиссоциированном состоянии. Сульфат железа (III), как и практически все другие соли, относится к сильным электролитам, и, поскольку он растворим в воде, в ионном уравнении его нужно писать в виде ионов. Учитывая все вышесказанное, получаем полное ионное уравнение следующего вида:
Сократив сульфат-ионы слева и справа, получаем:
разделив обе части уравнения на 2 получаем сокращенное ионное уравнение:
Теперь давайте рассмотрим реакцию ионного обмена, в результате которой образуется осадок. Например, взаимодействие двух растворимых солей :
Все три соли – карбонат натрия, хлорид кальция, хлорид натрия и карбонат кальция (да-да, и он тоже) – относятся к сильным электролитам и все, кроме карбоната кальция, растворимы в воде, т.е. есть участвуют в данной реакции в виде ионов:
2Na + + CO3 2- + Ca 2+ + 2Cl − = CaCO3↓+ 2Na + + 2Cl −
Сократив одинаковые ионы слева и справа в данном уравнении, получим сокращенное ионное:
Последнее уравнение отображает причину взаимодействия растворов карбоната натрия и хлорида кальция. Ионы кальция и карбонат-ионы объединяются в нейтральные молекулы карбоната кальция, которые, соединяясь друг с другом, порождают мелкие кристаллы осадка CaCO3 ионного строения.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакция соли1 с солью2 протекала, помимо базовых требований к протеканиям ионных реакций (газ, осадок или вода в продуктах реакции), на такие реакции накладывается еще одно требование – исходные соли должны быть растворимы. То есть, например,
реакция не идет, хотя FeS – потенциально мог бы дать осадок, т.к. нерастворим. Причина того что реакция не идет – нерастворимость одной из исходных солей (CuS).
протекает, так как карбонат кальция нерастворим и исходные соли растворимы.
То же самое касается взаимодействия солей с основаниями. Помимо базовых требований к протеканию реакций ионного обмена, для того чтобы соль с основанием реагировали необходима растворимость их обоих. Таким образом:
т.к. Cu(OH)2 нерастворим, хотя потенциальный продукт CuS был бы осадком.
А вот реакция между NaOH и Cu(NO3)2 протекает, так оба исходных вещества растворимы и дают осадок Cu(OH)2:
Внимание! Ни в коем случае не распространяйте требование растворимости исходных веществ дальше реакций соль1+ соль2 и соль + основание.
Например, с кислотами выполнение этого требования не обязательно. В частности, все растворимые кислоты прекрасно реагируют со всеми карбонатами, в том числе нерастворимыми.
1) Соль1+ соль2 — реакция идет если исходные соли растворимы, а в продуктах есть осадок
2) Соль + гидроксид металла – реакция идет, если в исходные вещества растворимы и в продуктах есть осадок или гидроксид аммония.
Рассмотрим третье условие протекания реакций ионного обмена – образование газа. Строго говоря, только в результате ионного обмена образование газа возможно лишь в редких случаях, например, при образовании газообразного сероводорода:
В большинстве же остальных случаев газ образуется в результате разложения одного из продуктов реакции ионного обмена. Например, нужно точно знать в рамках ЕГЭ, что с образованием газа в виду неустойчивости разлагаются такие продукты, как H2CO3, «NH4OH» и H2SO3:
(«NH4OH» — такая запись формулы в кавычках подразумевает, что в реальности вещества с такой формулой не существует. Формула используется для большей простоты промежуточных записей. В реальности вместо «гидроксида аммония» правильнее писать формулу гидрата аммиака NH3·H2O).
Другими словами, если в результате ионного обмена образуются угольная кислота, гидроксид аммония или сернистая кислота, реакция ионного обмена протекает благодаря образованию газообразного продукта:
Запишем ионные уравнения для всех указанных выше реакций, приводящих к образованию газов. 1) Для реакции:
В ионном виде будут записываться сульфид калия и бромид калия, т.к. являются растворимыми солями, а также бромоводородная кислота, т.к. относится к сильным кислотам. Сероводород же, являясь малорастворимым и плохо диссоциирцющим на ионы газом, запишется в молекулярном виде:
2K + + S 2- + 2H + + 2Br — = 2K + + 2Br — + H2S↑
Сократив одинаковые ионы получаем:
2) Для уравнения:
В ионном виде запишутся Na2CO3, Na2SO4 как хорошо растворимые соли и H2SO4 как сильная кислота. Вода является малодиссоциирующим веществом, а CO2 и вовсе неэлектролит, поэтому их формулы будут записываться в молекулярном виде:
3) для уравнения:
Молекулы воды и аммиака запишутся целиком, а NH4NO3, KNO3 и KOH запишутся в ионном виде , т.к. все нитраты являются хорошо растворимыми солями, а KOH является гидроксидом щелочного металла, т.е. сильным основанием:
Полное и сокращенное уравнение будут иметь вид:
- Реакции ионного обмена — это один из видов химических реакций. Правила, условия протекания и примеры
- Понятие о реакции
- Особенности взаимодействий
- Условия протекания
- Варианты классификации реакций
- Пример ионных уравнений, сопровождающихся выпадением осадка
- Пример процесса с образованием газа
- Получение малодиссоциируемого соединения
- Заключение
- Условия протекания реакций ионного обмена до конца
- 🎥 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции ионного обмена — это один из видов химических реакций. Правила, условия протекания и примеры
Реакции ионного обмена — это процессы, которые протекают между сложными веществами. Они должны сопровождаться появлением определенного результата: выпадением осадка, выделением газообразного соединения, образованием мало диссоциируемого вещества (например, воды).
Видео:Как понять что вещество выпадает в осадок или образуется газСкачать

Понятие о реакции
Курс органической химии рассматривает взаимодействия между соединениями, которые необходимы для жизнедеятельности человека и животных: белками, жирами, углеводами. Химическими принято называть такие процессы, которые протекают между веществами с получением иных соединений, отличающихся от исходных по свойствам и составу.

Реакции ионного обмена — это типичный пример химических процессов, так как они сопровождаются изменением окраски, появлением газа, выпадением осадка.
Реагентами именуют исходные соединения, а продуктами – конечные соединения.
Движущей силой процесса является природа реагентов, особенности продуктов, концентрация реагирующих компонентов, температура, давление.

Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Особенности взаимодействий
Реакции ионного обмена — это взаимодействие между веществами, взятыми в растворах. Как любые иные процессы химической природы, они протекают с выделением либо поглощением тепла, изменением окраски, агрегатного состояния.
В переводе с латинского языка «реакция» означает «ответное действие, отпор».
Именно поэтому реакции ионного обмена — это ответ одних веществ на атаку других.
Видео:11в. (В-О). Необратимая реакция (образование осадка)Скачать

Условия протекания
Среди тех факторов, которые необходимы для химического взаимодействия, выделяют:
- реагирующие соединения должны соприкасаться в максимальной степени;
- в некоторых случаях требуется повышение температуры;
- часть взаимодействий возможна только при воздействии электричества либо ультрафиолетового излучения.
Видео:Признак химических реакций - выпадение или растворение осадкаСкачать

Варианты классификации реакций
Сложно все процессы, сопровождающиеся изменением состава и свойств соединений, объединить в одну классификацию.
По возможности протекания процессов в прямом и обратном направлении неорганические и органические процессы делят на две группы.
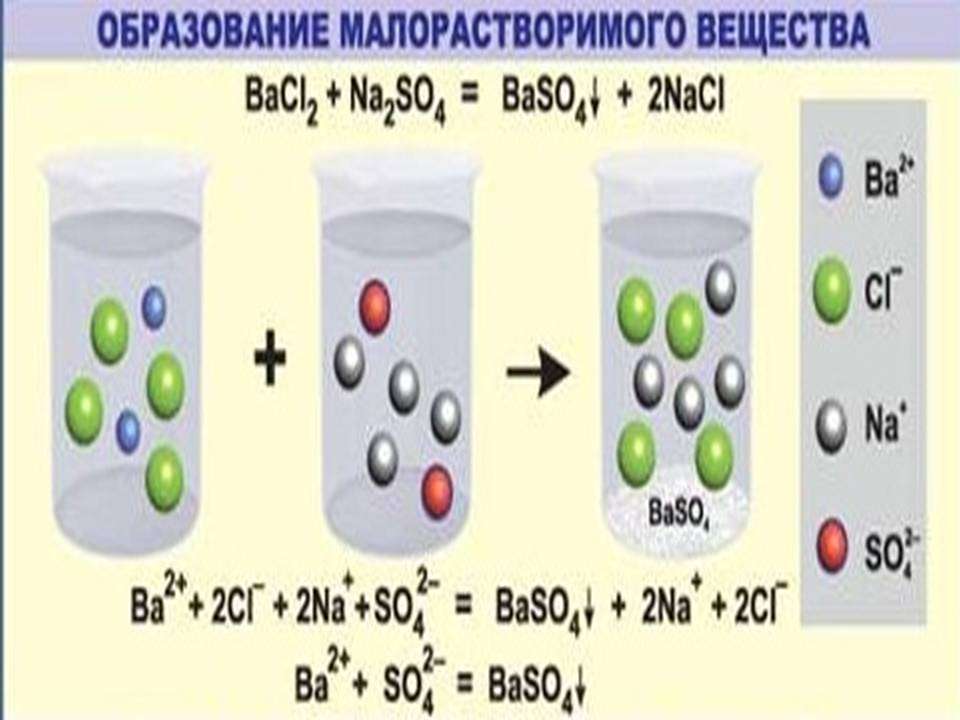
Необратимо протекает реакция ионного обмена между растворами растворимых соединений в том случае, когда между ними образуется нерастворимый продукт. Это применяется в аналитической химии для качественного определения катионов (анионов) в смеси растворов.
К примеру, для обнаружения катионов бария (Ba2+) используют раствор, содержащий сульфат анион (SO4 2-).
Видео:Демонстрация 6 "Химические реакции сопровожрающиеся выпадением осадка"Скачать

Пример ионных уравнений, сопровождающихся выпадением осадка
Как правильно составить уравнение процессов, характерных для этого случая? Рассмотрим на примере этой реакции ионного обмена сокращенные ионные уравнения. Данный вопрос входит в курс школьной программы, поэтому заслуживает пристального рассмотрения.
Первым этапом является написание процесса в молекулярном виде.
Чтобы понять, действительно ли необратимо протекает реакция ионного обмена между растворами этих веществ, потребуется таблица растворимости кислот, солей, оснований. Одним из продуктов является сульфат бария (средняя соль), которая является нерастворимым соединением. Следовательно, процесс действительно необратим, сопровождается выпадением осадка.
Вторым этапом является запись полного ионного уравнения. Каждое из исходных соединений, продуктов взаимодействия записывается в виде катионов и анионов.
Ba2++ 2Cl-+2Na+ +SO42-=BaSO4+2Na+ + 2Cl-
В левой и правой частях данного уравнения положительные и отрицательные ионы, которые не связаны в осадок, малодиссоциируемое или газообразное соединение. После их сокращения получаем вариант краткого ионного уравнения.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Пример процесса с образованием газа
Когда еще могут протекать реакции ионного обмена? Примеры с решением, предполагающим образование газообразного вещества, приведем для карбоната. Качественным реактивом на анион CO32- является взаимодействие с катионов водорода. Итогом процесса является образование углекислого газа.
Представим взаимодействие в молекулярном и ионном виде.
Продуктами реакции является углекислый газ и вода, которые не распадаются на ионы. Представим взаимодействие в полном ионном виде.
После сокращения ионов, повторяющихся в левой и правой частях, получаем следующий вид данного процесса:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Получение малодиссоциируемого соединения
Какими еще признаками могут сопровождаться реакции ионного обмена? Примеры с решением приведем для классического процесса нейтрализации между раствором щелочи и кислоты.
Взаимодействие раствора соляной кислоты с гидроксидом натрия сопровождается образованием воды (малодиссоциируемого соединения). Проверить полноту протекания процесса можно с помощью индикатора. Если первоначально к щелочи добавить спиртовой раствор фенолфталеина, по мере добавления к нему соляной кислоты окраска будет исчезать (идет нейтрализация).
В молекулярном виде процесс выглядит следующим образом:
Краткое ионное уравнение отражает процесс нейтрализации:
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Заключение
В отличие от других разновидностей химических процессов, ионный обмен происходит только между растворами сложных соединений. Также среди обязательных условий, которые связаны с подобными процессами, отметим их необратимость. В тех случаях, когда среди продуктов есть малодиссоциируемое соединение, газообразное вещество, осадок, то можно говорить о полноте протекания процесса.
Если в случае замещения у соединений меняются степени окисления, то в случае ионного обмена валентное состояние атомов не меняется. Такие процессы протекают между сложными веществами: солями, кислотами, основаниями, оксидами.
Частным случаем таких взаимодействий является нейтрализация между щелочью и кислотой. Они подчиняются законам химического равновесия, идут в том направлении, где одно из соединений удаляют из реакционной сферы в летучем, газообразном виде, или как малодиссоциируемое вещество.
Химическая реакция является сложным процессом, который предполагает превращение одних веществ в другие, которые отличаются от исходных по строению, составу. Только при наличии одного из трех признаков, перечисленных выше, можно вести речь о полноте протекания взаимодействия.
Видео:Реакции ионного обмена. 9 класс.Скачать

Условия протекания реакций ионного обмена до конца
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
На уроке будут рассмотрены условия протекания реакций ионного обмена до конца. Чтобы лучше понять, какие необходимо соблюдать условия протекания реакций ионного обмена до конца, будет проведено повторение, что собой представляют эти реакции, их сущность. Приводятся примеры на закрепление этих понятий.
🎥 Видео
Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

Задание 24: выполнение эксперимента | Химия ОГЭ 2023Скачать

Химия: выпадение осадка.Скачать

Как УРАВНИВАТЬ химические уравнения | Расстановка коэффициентов в химических реакцияхСкачать

ЧТО ТАКОЕ уравнение химической реакции? Все намного проще чем ты думал! #shorts #yotubeshortsСкачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

8 класс.Ч.1.Решение задач по уравнению реакций.Скачать