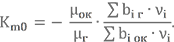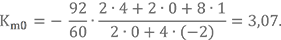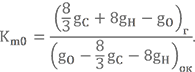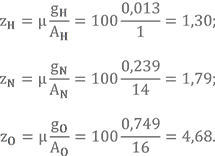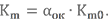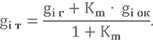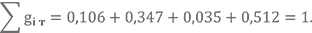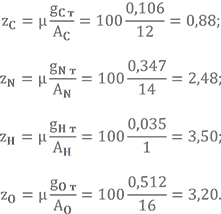Просто о том, что кажется сложным
- Урок 02. Определение параметров топлива (ч.1)
- Сага о ракетных топливах
- Предисловие.
- Часть №1-топлива для ЖРД или жидкие ракетные топлива.
- Горючие
- Отдельно упомяну твёрдый и металлический водород.
- Анамезон, антивещество, метастабильный гелий пока оставлю за кадром.
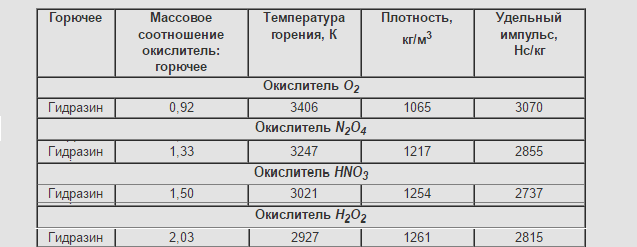
- Гидразин чрезвычайно ядовит
- Послесловие (нормальное):
- Сага о ракетных топливах
- Часть №1 — топлива для ЖРД или жидкие ракетные топлива
- Супер? Облом, а не «супер».
- Горючие
- Отдельно упомяну твёрдый и металлический водород.
- Анамезон, антивещество, метастабильный гелий пока оставлю за кадром.
- Гидразин чрезвычайно ядовит
- Послесловие:
- 💡 Видео
Видео:Влияние ракетного топлива на окружающую средуСкачать

Урок 02. Определение параметров топлива (ч.1)

В сегодняшнем уроке мы узнаем, как определить стехиометрическое соотношение компонентов и записать условную химическую формулу топлива.
Во-первых, давайте вспомним, что же это такое – стехиометрическое соотношение компонентов топлива. Оказывается, топливо может гореть по-разному. Причем не нужно воспринимать это горение как обычное горение дров в камине, где в качестве окислителя выступает кислород воздуха. Горение топлива в камере ракетного двигателя – это, в первую очередь, химическая реакция окисления с выделением тепла. А протекание химических реакций существенно зависит от того, сколько вещества вступает в реакцию. Если взять 1 кг какого-нибудь горючего и заставить его взаимодействовать с очень большим количеством окислителя, то после того, как этот 1 кг горючего закончится, химическая реакция горения прекратится, потому что окислителю просто нечего будет окислять.
Вопрос на засыпку.
На защите курсового проекта у студента спрашивают: что произойдёт с горючим, впрыскиваемым через пояс завесного охлаждения перед критическим сечением камеры? Распространённый ответ: оно сгорит. Это неверно. Ему не с чем там гореть. Весь окислитель уже прореагировал в камере сгорания. Горючее испарится, может разложиться, но сгореть не может.
Значит, для каждой топливной пары существует вполне определённое соотношение между количеством окислителя и горючего, при котором они взаимодействуют друг с другом без остатка. Именно такое соотношение называют стехиометрическим.
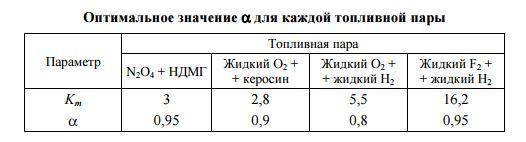
Количество компонента можно задать объёмом или массой. При расчёте топлив больше распространено массовое соотношение компонентов Km (индекс m как раз и указывает на это). Для обозначения стехиометрического соотношения добавляют индекс 0, т.е. – Km0. Каждая топливная пара имеет вполне определённое Km0. Его можно найти в справочной литературе. Однако в учебно-познавательных целях давайте рассмотрим, как его можно вычислить.
Значение Km0 зависит от валентности, которую могут проявлять химические элементы в теоретической форме уравнения химической реакции
Ну начинается – скажете Вы – опять формулы. Ну, куда же без них. На самом деле, если разобраться, то как бы и ничего сложного:
μок и μг – молекулярные массы окислителя и горючего (мы их уже считали в прошлом уроке);
bi – число грамм-атомов химического элемента в веществе, т.е. фактически количество атомов в химической формуле (грамм-атом – устаревшая единица измерения количества вещества);
νi – валентность элемента (νH = +1, νC = +4, νN = 0, νO = -2).
Возьмём топливную пару НДМГ + АТ и вычислим для неё Km0. Молекулярную массу НДМГ и АТ мы уже считали:
μ(C2N2H8) = 12·2 + 14·2 + 1·8 = 60 а.е.м.
μ(N2O4) = 14·2 + 16·4 = 92 а.е.м.
Количество атомов и валентности элементов известны. Подставляем в формулу
Но это наиболее общая формула. Она годится для любых веществ, но неудобна, если компонент представляет собой смесь. Придётся дополнительно определять его условную химическую формулу чтобы узнать bi.
Для определения Km0 при сгорании углеводородных топлив в учебнике Штехера, например, предлагается использовать более практичную формулу (для веществ, содержащих только C, H, N, O)
Найдём стехиометрическое соотношение компонентов для той же топливной пары НДМГ + АТ, но по другой формуле.
Массовые доли элементов в НДМГ были найдены в прошлом уроке gC = 0,400, gN = 0,467, gH = 0,133.
Для азотного тетраоксида gN = 0,304, gO = 0,696 (предлагаю Вам посчитать их самостоятельно).
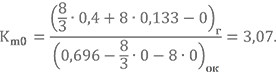
Вроде бы сошлось. 🙂
Если Вам всё же больше нравится первый вариант, то компонент нужно представить в виде условной химической формулы. При этом задаться условной молекулярной массой смеси (например, μ = 100 а.е.м.).
Количество атомов в формуле можно определить так:
Определим условную химическую формулу АК-20, рассмотренного в прошлом уроке.
Массовые доли gH = 0,013, gN = 0,239, gO = 0,749.
Получить условную химическую формулу топлива можно тем же способом.
Для определения массовых долей компонентов в топливе в целом нужно знать действительное соотношение компонентов Km. Прежде чем его вычислить, скажем несколько слов о такой величине, как коэффициент избытка окислителя αок.
Несмотря на то, что казалось бы сжигать компоненты при стехиометрии наиболее выгодно, по ряду причин реальные ЖРД обычно работают с некоторым избытком горючего (рассказ о причинах займёт довольно много времени, возможно этому вопросу будет посвящена отдельная статья в Базе знаний). Для различия между стехиометрическим и действительным соотношением компонентов топлива и вводится αок.
Зависимость крайне проста
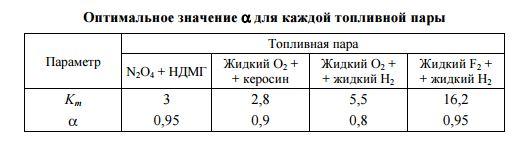
Коэффициент может принимать любые положительные значения. Если αок = 1, Km = Km0, при αок 1 – избыток окислителя.
Узнать наперед какое значение αок лучше выбрать, очень сложно. Поэтому им либо задаются из диапазона рекомендуемых значений, либо проводят серию тепловых расчетов при разных αок, а затем выбирают оптимальное, например, из условия максимума скорости истечения продуктов сгорания на срезе сопла.
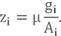
Зная значение коэффициента избытка окислителя, можно определить массовый состав топлива:
Определим массовый состав топливной пары НДМГ + АТ при αок = 0,91 и запишем её условную химическую формулу.
Значение Km0 получено в примерах выше. Массовые доли химических элементов в компонентах тоже уже известны.
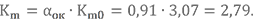
Количество атомов в условной химической формуле
На этом всё. Надеюсь, урок был полезным. В следующий раз поговорим об энтальпии топлива и плотности смесей.
Видео:Экзотическая химия ракетного топливаСкачать

Сага о ракетных топливах
Предисловие.
А его и не будет, что бы не спамить, всё описано в «послесловии». Обязательно его прочтите, что бы не было диссонанса с более ранними комментариями.
Статью пришлось переделать 01.03.2017 и она отличается от первоначальной.
Achtung! Не стоит рассматривать эту статью, как некий научный труд или претензия на нобелевку.
Тем более:
«… И нет ничего нового под солнцем»
(Экклизиаст 1:9).
О топливах, ракетах ракетных двигателях писалось, пишут и будут писать.
Одной из первых работ по топливам ЖРД можно считать книгу В.П.Глушко «Жидкое топливо для реактивных двигателей», изданную в 1936 г.
Для меня тема показалась интересной, связанной с моей бывшей специальностью и учёбой в ВУЗе, тем паче «приволок» её мой младший отпрыск «шеф давай замесим, что нить такое и запустим, а если лень, то мы сами сообразим». Видимо лавры Лин Индастриал» не дают покоя.
Так хочется правильно взорвать свой ракетный двигатель.
«Соображать» будем вместе, под строгим родительским контролем.
«Ключ на старт»… «Поехали»! (Ю.А. Гагарин& С.П. Королёв)
Какой бы тип РД (схема, характер процесса) не применялся в ракетной технике его целевое предназначение: создание тяги (силы), путём преобразования исходной энергии, запасённой в РТ в кинетическую энергию (Ек) реактивной струи рабочего тела.
Ек реактивной струи в РД преобразуются разные виды энергии (химическая, ядерная, электрическая).
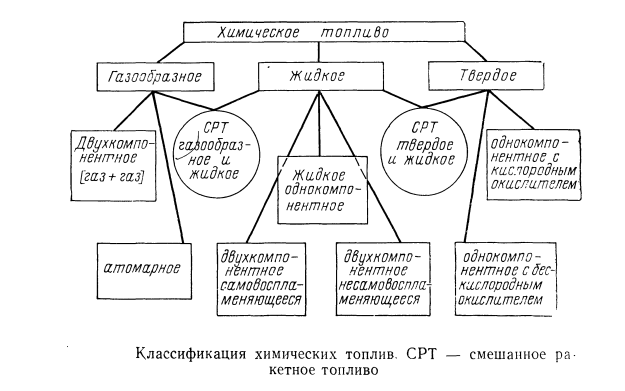
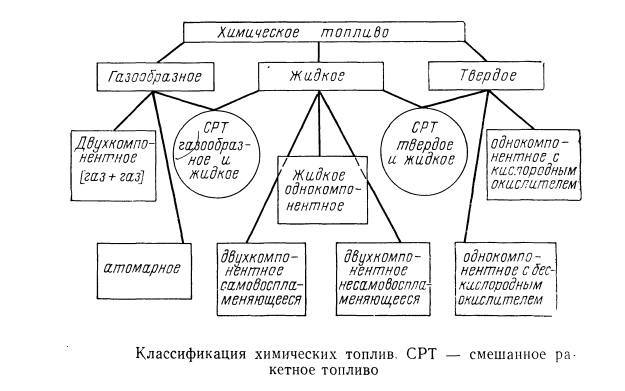
Для химических двигателей топливо можно разделить по фазовому состоянию: газообразное, жидкое, твёрдое, смешанное.
Видео:Как Сделать Ракетный двигатель из Обычной СОЛИ?Скачать

Часть №1-топлива для ЖРД или жидкие ракетные топлива.
Классификация химических топлив для ракетных двигателей (общепринятая):
ЖРД(РД)-жидкостный ракетный двигатель.
Тяга ЖРД—равнодействующая реактивной силы ЖРД и сил давления окружающей среды, действующих на его внешние поверхности, за исключением сил внешнего аэродинамического сопротивления. Различают тягу на земле (на уровне моря) и в пустоте.
Удельный импульс тяги ЖРД (удельный импульс ЖРД),- отношение тяги ЖРД к массовому расходу топлива ЖРД. Аналогично тяге удельный импульс ЖРД максимален в пустоте и соответственно уменьшается при наличии давления окружающей среды.
Удельная масса ЖРД — отношение массы залитого ЖРД к его наибольшей тяге на основном режиме, причем масса залитого ЖРД определяется массой ЖРД (массой конструкции ЖРД) и компонентов топлива, заполняющих его трубопроводы и агрегаты при работе.
Тип ЖРТ. Обычно каждую ДУ конструируют для вполне определенного топлива, причем от него в значительной степени зависят удельные параметры ЖРД и ДУ и эффективность их применения в составе ракеты (или ЛА).
Время работы ЖРД — время от первой команды на запуск ЖРД до первой команды на его выключение. Для ЖРД многократного включения время работы равно суммарному времени работы ЖРД, соответствующему всем циклам работы.
ХРТ-химическое ракетное топливо.
ЖРТ-жидкие ракетные топлива.
ТНА-турбонасосный агрегат.
КС- камера сгорания.
Удельный импульс (Iуд).
Реактивная тяга (Р или Fр).
КМ-конструкционные материалы.
ДУ-двигательная установка.
О-окислитель.
Г-горючее.
Ракетное топливо (ТК, чтобы не путать с РТ, см. ниже)-вещество, подвергающееся химическим, ядерным или термоэлектрическим реакциям в ракетном двигателе, для создания его тяги.
Рабочее тело (РТ) — вещество, с которым происходят различные физико-химические преобразования внутри РД, составляющие его рабочий процесс.
Стехиометрическое соотношение компонентов топлива (Km0)(подробнее-кликнуть)-отношение массы окислителя к массе горючего при стехиометрических реакциях.
Состав топлива-горючая и негорючая части (в общем случае).
Виды топлив(в общем случае).
Химическим источником тепловой энергии для РД в общем случае можно считать химическую реакцию компонентов РТ.
Начну вещать с Km0. Это очень важное соотношение для РД: топливо может гореть по-разному в РД (химическая реакция в РД-это не обычное горение дров в камине, где в качестве окислителя выступает кислород воздуха). Горение (точнее окисление) топлива в камере ракетного двигателя–это, в первую очередь, химическая реакция окисления с выделением тепла. А протекание химических реакций существенно зависит от того, сколько веществ (их соотношение) вступает в реакцию.
Как засыпаться на защите курсового проекта, экзамена или сдаче зачёта. / Дмитрий Завистовский
Значение Km0 зависит от валентности, которую могут проявлять химические элементы в теоретической форме уравнения химической реакции. Пример для ЖРТ: АТ+НДМГ.
Важный параметр-коэффициент избытка окислителя (обозн. греческой «α» с индексом «ок.») и массовое соотношение компонентов Kм.
Kм=(dmок./dt)/(dmг../dt), т.е. отношение массового расхода окислителя к массовому расходу горючего. Он специфичен для каждого топлива. В идеальном случае представляет собой стехиометрическое соотношение окислителя и горючего, т.е. показывает сколько кг окислителя нужно для окисления 1 кг горючего. Однако реальные значения отличаются от идеальных. Соотношение реального Kм к идеальному и есть коэффициент избытка окислителя.
Как правило αок. Пофантазируйте: вместо Н2О представьте ЖК (LOX).
Шугирование позволит увеличить общую плотность окислителя.
Пример захолаживания (переохлаждения) БР Р-9А: в качестве окислителя в ракете впервые было решено использовать переохлажденный жидкий кислород, что позволило уменьшить общее время подготовки ракеты к пуску и повысить степень ее боеготовности.
Озон-O3
Молекулярная масса=48 а.е.м., молярная масса=47,998 г/моль
Плотность жидкости при -188 °C (85,2 К) составляет 1,59(7) г/см³
Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см³
Температура плавления −197,2(2) °С (75,9 К)
Давно инженеры мучились с ним, пытаясь использовать в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике.
Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и Iуд. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 против 1,14 г/см³ соответственно), а его Ткипения выше (−112 °C и −183 °C соответственно).
Пока непреодолимым препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по Iуд на близкие к предельным значениям параметры и для повышения УИ осталось лишь одна возможность, связанная с переходом на новые виды топлива.
Состояние жидкость при н.у.
Молярная масса 63.012 г/моль (не важно, что я использую молярную массу или молекулярную массу-это не меняет сути)
Плотность 1,513 г/см³
Т. плав.=-41,59 °C, Т. кип.=82,6 °C
Для повышения уд.импульса в кислоту добавляют двуокись азота (NO2). Добавка диоксида азота в кислоту связывает попадающую в окислитель воду, что уменьшает коррозионную активность кислоты, увеличивается плотность раствора, достигая максимума при 14% растворенного NO2. Эту концентрацию использовали американцы для своих боевых ракет.
Мы почти 20 лет искали подходящую тару для азотной кислоты. Очень трудно при этом подобрать конструкционные материалы для баков, труб, камер сгорания ЖРД.
Вариант окислителя, что выбрали в США с 14 % двуокиси азота. А наши ракетчики поступили иначе. Надо было догонять США любой ценой, поэтому окислители советских марок – АК-20 и АК-27 – содержали 20 и 27 % тетраоксида.
Интересный факт: в первом советском ракетном истребителе БИ-1 были использованы для полетов азотная кислота и керосин.
Баки и трубы пришлось изготовлять из монель-металла: сплава никеля и меди, он стал очень популярным конструкционным материалом у ракетчиков. Советские рубли были почти на 95 % сделаны из этого сплава.
Недостатки: терпимая «гадость». Коррозионною активна. Удельный импульс недостаточно высок. В настоящее время в чистом виде почти не используется.
Азотный тетраоксид-АТ (N2O4)
«Принял эстафету» от азотной кислоты в военных двигателях. Обладает саомовоспламеняемостью с гидразином, НДМГ. Низкокипящий компонент, но может долго хранится при принятии особых мер.
Недостатки: такая же гадость, как и HNO3, но со своими причудами. Может разлагаться на окись азота. Токсичен. Низкий удельный импульс. Часто использовали и используют окислитель АК-NN. Это смесь азотной кислоты и азотного тетраоксида, иногда её называют «красной дымящейся азотной кислотой». Цифры обозначают процентное кол-во N2O4.
В основном эти окислители используются в ЖРД военного назначения и ЖРД КА благодаря своим свойствам: долгохранимость и самовоспламеняемость. Характерные горючие для АТ это НДМГ и гидразин.
Атомная масса=18,998403163 а. е. м. (г/моль)
Молярная масса F2, 37,997 г/моль
Температура плавления=53,53 К (−219,70 °C)
Температура кипения=85,03 К (−188,12 °C)
Плотность (для жидкой фазы), ρ=1,5127 г/см³
Химия фтора начала развиваться с 1930-х годов, особенно быстро-в годы 2-й мировой войны 1939-45 годов и после нее в связи с потребностями атомной промышленности и ракетной техники. Название «Фтор» (от греч. phthoros — разрушение, гибель), предложенное А. Ампером в 1810 году, употребляется только в русском языке; во многих странах принято название «флюор».
Это прекрасный окислитель с точки зрения химии. Окисляет и кислород, и воду. Расчеты показывают, что максимальный теоретический Iуд можно получить на паре F2-Be (бериллий)-порядка 6000 м/с!
Супер? Облом, а не «супер».
Чрезвычайно коррозионною активен, токсичен, склонен к взрывам при контакте с окисляющимися материалами. Криогенен. Любой продукт сгорания также имеет почти те же «грехи»: жутко коррозионны и токсичны.
Техника безопасности. Фтор токсичен, предельно допустимая концентрация его в воздухе примерно 2·10-4 мг/л, а предельно допустимая концентрация при экспозиции не более 1 ч составляет 1,5·10-3мг/л.
ЖРД 8Д21 применение пары фтор + аммиак давало удельный импульс на уровне 4000 м/с.
Для пары F2+H2 получается Iуд=4020 м/с!
Беда: HF-фтороводород на «выхлопе».
Стартовая позиция после запуска такого «энергичного движка»?
Лужа жидких металлов и прочих растворённых в плавиковой кислоте химических элементов!
Н2+2F=2HF, при комнатной температуре существует в виде димера H2F2.
Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. А использованию его в ЖРД КА не реально из-за сложностей хранения.
Всё то же самое относится и к остальным жидким галогенам, например к хлору.
Фтороводородный ЖРД тягой 25 т для оснащения обеих ступеней ракетного ускорителя АКС «Спираль» предполагалось разработать в ОКБ-456 В.П.Глушко на базе отработанного ЖРД тягой 10 т на фтороаммиачном (F2+NH3) топливе.
Перекись водорода-H2O2.
Она упомянута мною выше в однокомпонентных топливах.
Walter HWK 109-507: преимущества в простоте конструкции ЖРД. Яркий пример такого топлива-перекись водорода.
Перекись водорода для роскошных волос и еще 14 секретов применения.
Alles: список более менее реальных окислителей закончен. Акцентирую внимание на HClО4. Как самостоятельные окислители на основе хлорной кислоты представляют интерес только: моногидрат (Н2О+ClО4)-твёрдое кристаллическое вещество и дигидрат (2НО+НСlО4)-плотная вязкая жидкость.Хлорная кислота (которая из-за Iуд сама по себе бесперспективна), при этом представляет интерес в качестве добавки к окислителям, гарантирующей надёжность самовоспламенения топлива.
Окислители можно классифицировать и так:
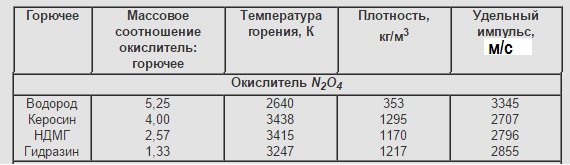
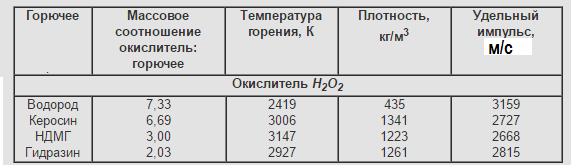
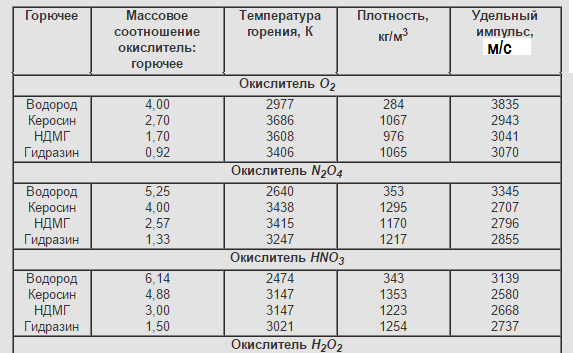
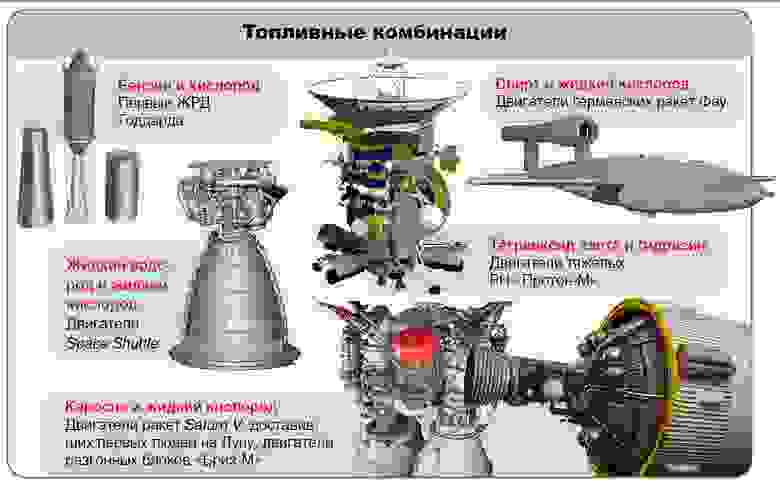
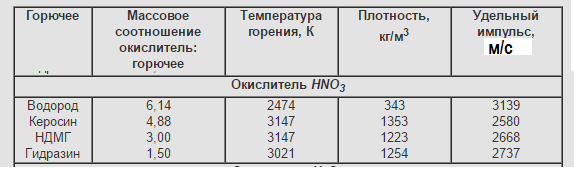
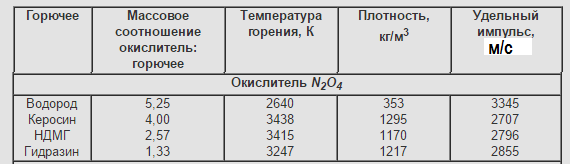
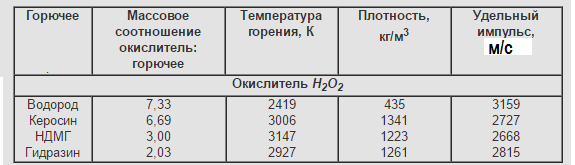
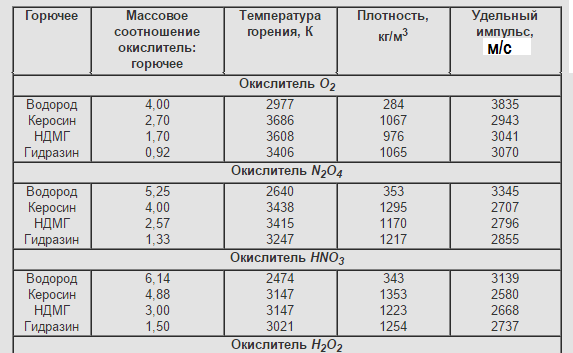
Итоговый (чаще используемый) список окислителей в связке с реальными же горючими:
Примечание: если хотите перевести один вариант удельного импульса в другой, то можно пользоваться простой формулой: 1 м/с = 9,81 с.
В отличие от них-горючих у нас «завались».
Видео:Допинг из ракетного топлива?!Скачать

Горючие
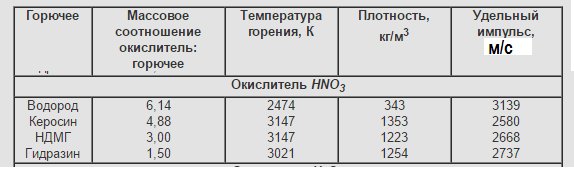
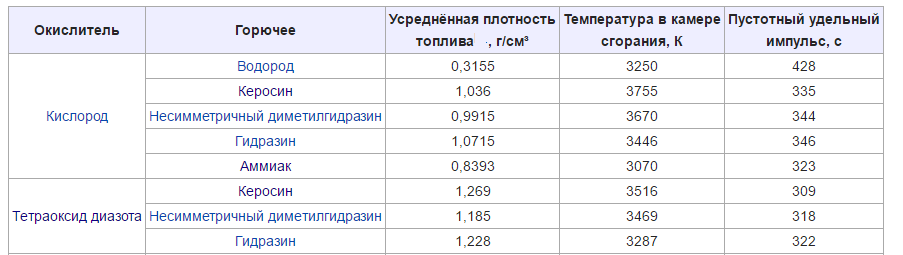
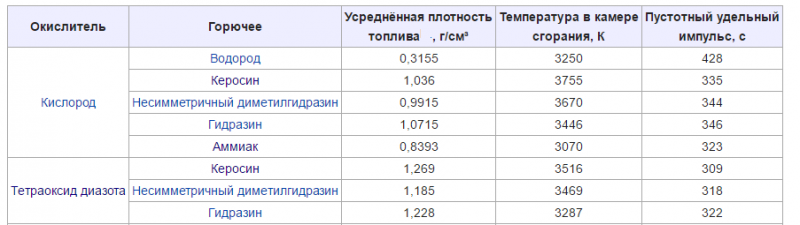
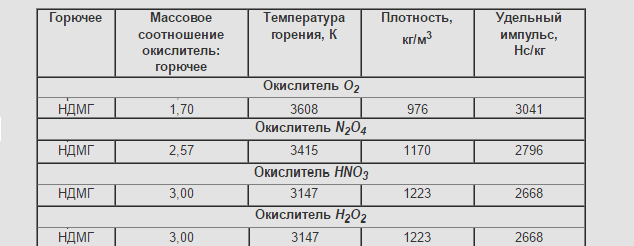
Основные характеристики двухкомпонентных ЖРТ при pк/pа=7/0,1 МПа
По физико-химическому составу их можно разбить на несколько групп.
Углеводородные горючие.
Низкомолекулярные углеводороды.
Простые вещества: атомарные и молекулярные.
Для этой темы пока практический интерес представляет лишь водород (Hydrogenium).
Na, Mg, Al, Bi, He, Ar, N2, Br2, Si, Cl2, I2 и др. я не буду рассматривать в этой статье.
Гидразиновые топлива («вонючки»).
Поиски оптимального горючего начались с освоения энтузиастами ЖРД.
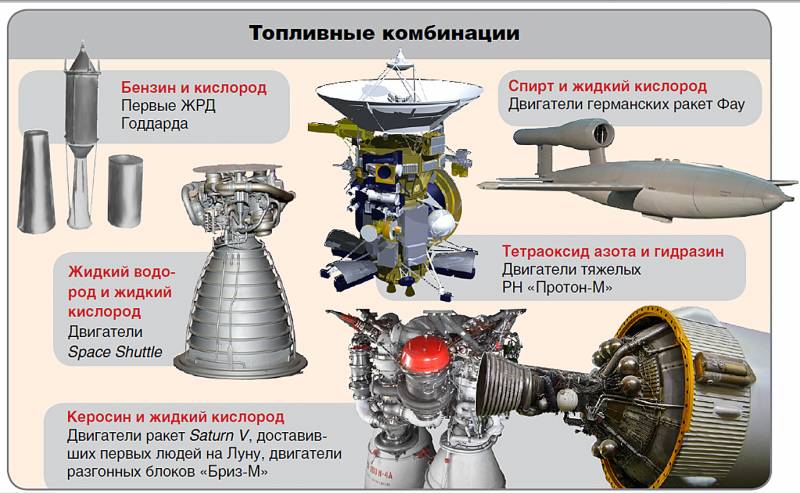
Первым широко использовавшимся горючим стал спирт (этиловый), применявшийся на первых
советских ракетах Р-1, Р-2, Р-5 («наследство» ФАУ-2) и на самой Vergeltungswaffe-2.
Вернее раствор 75% этилового спирта (этанол, этиловый спирт, метилкарбинол, винный спирт или алкоголь, часто в просторечии просто «спирт») — одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), другой вариант: CH3-CH2-OH
У этого горючего два серьёзных недостатка, которые очевидно не устраивали военных: низкие энергетические показатели и низкая стойкость личного состава к «отравлению» таким горючим.
Сторонники здорового образа жизни (спиртофобы) пытались использовать фурфуриловый спирт-ядовитая, подвижная, прозрачная, иногда желтоватая (до темно-коричневого), со временем краснеющая на воздухе жидкость. 
Хим. формула:C4H3OCH2OH, Рац. формула:C5H6O2. Отвратительная жижа.
К питью не предназначена.
Условная формула C7,2107H13,2936
Горючая смесь жидких углеводородов (от C8 до C15) с температурой кипения в интервале 150—250 °C, прозрачная, бесцветная (или слегка желтоватая), слегка маслянистая на ощупь
плотность — от 0,78 до 0,85 г/см³ (при температуре 20°С);
вязкость — от 1,2 – 4,5 мм²/с (при температуре 20°С);
температура вспышки — от 28°С до 72°С;
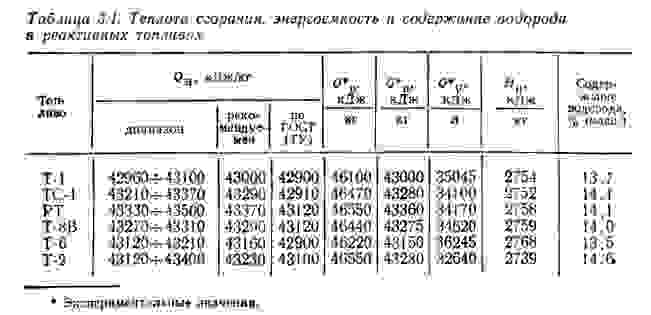
теплота сгорания — 43 Мдж/кг.
Моё мнение: о точной молярной массе писать бессмысленно
Керосин является смесью из различных углеводородов, поэтому появляются страшные дроби (в хим формуле) и «размазанная» температура кипения.
Удобное высококипящее горючее. Используется давно и успешно во всём мире в двигателях и в авиации. Именно на нем до сих пор летают «Союзы». Малотоксичен (пить настоятельно не рекомендую), стабилен. Всё же керосин опасен и вреден для здоровья (употребление внутрь).
А ведь находятся люди, которые им что только ни лечат! Минздрав категорически против!
Солдатские байки: хорошо помогает избавиться от противных Pthirus pubis.
Однако и он требует осторожности в обращении при эксплуатации: авария пассажирского самолёта
Существенные плюсы: сравнительно недорог, освоен в производстве.
Пара керосин-кислород идеальна для первой ступени. Ее удельный импульс на земле 3283 м/с, пустотный 3475 м/с. Недостатки. Относительно малая плотность.
Американские ракетные керосины Rocket Propellant-1 или Refined Petroleum-1 
Относительно дешёвый (был): 
Для повышения плотности лидерами освоения космоса были разработаны синтин (СССР) и RJ-5 (США).
Синтез синтина.
Керосин имеет склонность к отложению смолистых осадков в магистралях и тракте охлаждения, что отрицательно сказывается на охлаждении.
На это его свойство педалируют Мухин, Велюров @Co.
Керосиновые двигатели наиболее освоены в СССР.
Шедевр человеческого разума и инженерии наша «жемчужина» РД-170/171:
Теперь более корректным названием для горючих на основе керосина стал термин УВГ-«углеводородное горючее», т.к. от керосина, который жгли в безопасных керосиновых лампах И. Лукасевича и Я. Зеха, применяемое УВГ «ушло» очень далеко.
Как пример:нафтил.
Молярная масса: 16,04 г/моль
Плотность газ (0 °C) 0,7168 кг/м³;
жидкость (−164,6 °C) 415 кг/м³
Т. плав.=-182,49 °C
Т. кип.=-161,58 °C
— Удельный импульс у двигателя на СПГ высокий, но это преимущество нивелируется тем, что у метанового топлива меньшая плотность, поэтому в сумме получается незначительное энергетическое преимущество. С конструкционной точки зрения метан привлекателен. Чтобы освободить полости двигателя, нужно только пройти цикл испарения — то есть двигатель легче освобождается от остатков продуктов. За счет этого метановое топливо более приемлемо с точки зрения создания двигателя многоразового использования и летательного аппарата многоразового применения.
Недорог, распространен, устойчив, малотоксичен. По сравнению с водородом имеет более высокую температуру кипения, а удельный импульс в паре с кислородом выше, чем у керосина: около 3250-3300 м/с на земле.
Неплохой охладитель.
Недостатки. Низкая плотность (вдвое ниже чем у керосина). При некоторых режимах горения может разлагаться с выделением углерода в твердой фазе, что может привести к падению импульса из-за двухфазности течения и резкому ухудшению режима охлаждения в камере из-за отложения сажи на стенках КС. В последнее время идут активные НОР и НИОКР в области его применения (наряду с пропаном и природным газом) даже в направлении модификации уже сущ. ЖРД (в частности такие работы были проведены над РД-0120).
Или как «свежий» пример-американский Raptor engine от Space X:
К этим топливам можно отнести пропан и природный газ. Основные их характеристики, как горючих, близки (за исключением большей плотности и более высокой температуры кипения)к УВГ. И имеются такие же проблемы при их использования.
Особняком среди горючих позиционируется Водород-H2 (Жидкий: LH2).
Молярная масса водорода равна 2 016 г / моль или приближенно 2 г / моль.
Плотность (при н. у.)=0,0000899 (при 273 K (0 °C)) г/см³
Температура плавления=14,01K (-259,14 °C);
Температура кипения=20,28K (-252,87 °C);
Использование пары LOX-LH2 предложено еще Циолковским, но реализовано другими:
С точки зрения термодинамики Н2 идеальное рабочее тело как для самого ЖРД, так и для турбины ТНА. Отличный охладитель, при чем как в жидком, так и в газообразном состоянии. Последний факт позволяет не особо бояться кипения водорода в тракте охлаждения и использовать газифицированный таким образом водород для привода ТНА.
Такая схема реализована в Aerojet Rocketdyne RL-10-просто шикарный (с инженерной точки зрения) движок:
Наш аналог (даже лучше, т.к. моложе): РД-0146 (Д, ДМ) — безгазогенераторный жидкостный ракетный двигатель, разработанный Конструкторским бюро химавтоматики в Воронеже.
Особенно эффективен с сопловым насадком из материала «Граурис».
Высокий удельный импульс-в паре с кислородом 3835 м/с.
Из реально используемых это самый высокий показатель. Эти факторы обуславливают пристальный интерес к этому горючему. Экологически чист, на «выходе» в контакте с О2: вода (водяной пар).
Распространен, практически неограниченные запасы. Освоен в производстве. Нетоксичен.
Однако есть очень много ложек дегтя в этой бочке мёда.
1. Чрезвычайно низкая плотность. Все видели огромные водородные баки РН «Энергия» и МТКК «Шаттл». Из-за низкой плотности применим (как правило) на верхних ступенях РН. 
Кроме того низкая плотность ставит непростую задачу для насосов: насосы водорода многоступенчатые для того что бы обеспечить нужный массовый расход и при этом не кавитировать.
По этой же причине приходится ставить т.н. бустерные насосные агрегаты горючего (БНАГ) сразу за заборным устройством в баках, дабы облегчить жизнь основному ТНА.
Насосы водорода для оптимальных режимов требуют значительно высокой частоты вращения.
2. Низкая температура. Криогенное топливо. Перед заправкой необходимо проводить многочасовое захолаживание (и/или переохлаждение) баков и всего тракта. Баки РН «Falocn 9FT» взгляд изнутри:
Подробнее о «сюрпризах»:
«МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ТЕПЛОМАССООБМЕННЫХ ПРОЦЕССОВ В ВОДОРОДНЫХ СИСТЕМАХ» Н0Р В.А. ГордеевВ.П. Фирсов, А.П. Гневашев, Е.И. Постоюк
ФГУП «ГКНПЦ им. М.В. Хруничева, КБ «Салют»; «Московский авиационный институт (Государственный технический университет)
В работе дана характеристика основных математических моделей тепломассообменных процессов в баке и магистралях водорода кислородно-водородного разгонного блока 12КРБ. Выявлены аномалии в подаче водорода в ЖРД и предложено их математическое описание. Модели отработаны в ходе стендовых и летных испытаний, что дало возможность на их базе прогнозировать параметры серийных разгонных блоков различных модификаций и принимать необходимые технические решения по совершенствованию пневмогидравлических систем.
Низкая температура кипения затрудняет хранение этого топлива.
3. Жидкий водород обладает некоторыми свойствами газа:
Коэффициент сжимаемости (pv/RT)при 273,15 К: 1,0006 (0,1013 МПа), 1,0124 (2,0266 МПа), 1,0644 (10,133 МПа), 1,134 (20,266 МПа), 1,277 (40,532 МПа);
Водород может находиться в орто- и пара-состояниях. Ортоводород (о-Н2) имеет параллельную (одного знака) ориентацию ядерных спинов. Пара-водород (п-Н2)-антипараллельную.
При обычных и высоких температурах Н2 (нормальный водород, н-Н2) представляет собой смесь 75% орто- и 25% пара-модификаций, которые могут взаимно превращаться друг в друга (орто-пара-превращение). При превращении о-Н2 в п-Н2 выделяется тепло (1418 Дж/моль).
Это всё накладывает дополнительные трудности в проектировании магистралей, ЖРД, ТНА, циклограммы работы, и особенно насосов.
4. Газообразный водород быстрее других газов распространяется в пространстве, проходит через мелкие поры, при высоких температурах сравнительно легко проникает сквозь сталь и другие материалы. Н2г обладает высокой теплопроводностью, равной при 273,15 К и 1013 гПа 0,1717 Вт/(м*К) (7,3 по отношению к воздуху).
Водород в обычном состоянии при низких температурах малоактивен, без нагревания реагирует лишь с F2 и на свету с Сl2. С неметаллами водород взаимодействует активнее, чем с металлами. С кислородом реагирует практически необратимо, образуя воду с выделением 285,75 МДж/моль тепла;
5. Со щелочными и щелочно-земельными металлами, элементами III, IV, V и VI группы периодической системы, а также с интерметаллическими соединениями водород образует гидриды. Водород восстанавливает оксиды и галогениды многих металлов до металлов, ненасыщенные углеводороды – до насыщенных (см. Гидрирование).
Водород очень легко отдает свой электрон. В растворе отрывается в виде протона от многих соединений, обусловливая их кислотные свойства. В водных растворах Н+ образует с молекулой воды ион гидроксония Н3О. Входя в состав молекул различных соединений, водород склонен образовывать со многими электроотрицательными элементами (F, О, N, С, В, Cl, S, Р) водородную связь.
6. Пожароопастность и взрывоопасность. Можно не рассусоливать: гремучую смесь все знают.
Смесь водорода с воздухом взрывается от малейшей искры в любой концентрации — от 5 до 95 процентов.
Т.о. водород есть и Gut (даже Sehr Gut), и одновременно „головная боль“ (даже сильная боль головная).
Первый закон диалектики: „Единство и борьба противоположностей“ /Georg Wilhelm Friedrich Hegel/
Впечатляет Space Shuttle Main Engine (SSME)? 
Вероятно увидев это и посчитав его стоимость (стоимость вывода на орбиту 1 кг ПН) законодатели и те кто рулит бюджетом США и NASA в частности… решили „ну его нафиг“.
Ия их понимаю- на РН „Союз“ и дешевле и безопаснее, да использование РД-180/181 снимает многие проблемы американских РН и существенно экономит деньги налогоплательщиков.
Самый лучший ракетный двигатель — это такой двигатель, который вы можете произвести/купить, при этом он будет обладать тягой в требуемом вам диапазоне (не слишком большой или маленькой) и будет эффективным настолько(удельный импульс, давление в камере сгорания), что его цена не станет неподъемной для вас.
Наиболее освоены водородные двигатели в США.
Сейчас мы позиционируемся на 3-4 месте в „Водородном клубе“ (после Европы, Японии и Китая/Индии).
Отдельно упомяну твёрдый и металлический водород.
Твёрдый водород—твёрдое агрегатное состояние водорода.
Температура плавления −259,2 °C (14,16 К).
Плотностью 0,08667 г/см³ (при −262 °C).
Белая снегоподобная масса, кристаллы гексагональной сингонии.
Шотландский химик Дж. Дьюар в 1899 году впервые получил водород в твёрдом состоянии.
Для этого он использовал регенеративную охлаждающую машину, основанную на эффекте Джоуля—Томсона.
Беда с ним. Он постоянно теряется: »Ученые потеряли единственный в мире образец металлического водорода».
Почему-то мне это напомнило «нанотанк Чубайса». Это нано-чудо не могут найти уже лет 7 или больше.
Анамезон, антивещество, метастабильный гелий пока оставлю за кадром.
Состояние при н.у.- бесцветная жидкость
Молярная масса=32.05 г/моль
Плотность=1.01 г/см³
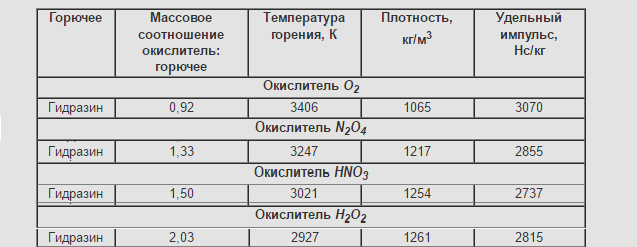
Очень распространенное топливо.
Хранится долго, и его за это «любят». Широко используется в ДУ КА и МБР, т.е. там, где долгохранимость имеет критическое значение.
Кого смутил Iуд в размерности Н*с/кг отвечаю: это военное обозначение.
Ньютон — производная единица, исходя из второго закона Ньютона она определяется как сила, изменяющая за 1 секунду скорость тела массой 1 кг на 1 м/с в направлении действия силы. Таким образом, 1 Н = 1 кг·м/с 2 .
Соответственно: 1 Н*с/кг =1 кг·м/с 2 *с/кг=м/с.
Освоен в производстве.
Недостатки: токсичен, вонючий.
Для человека степень токсичности гидразина не определена. По расчётам S. Krop опасной опасной концентрацией следует считать 0,4 мг/л. Ch. Comstock с сотрудниками полагает, что предельно допустимая концентрация не должна превышать 0,006 мг/л. Согласно более поздним американским данным, эта концентрация при 8-часовой экспозиции снижена до 0,0013 мг/л. Важно отметить при этом, что порог обонятельного ощущения гидразина человеком значительно превышает указанные числа и равен 0,014-0,030 мг/л. Существенным в этой связи является и тот факт, что характерный запах ряда гидразинопроизводных ощущается лишб в первые минуты контакта с ними. В дальнейшем вследствие адаптации органов обоняния, это ощущение исчезает, и человек, не замечая того, может длительное время находиться в зараженной атмосфере, содержащей токсические концентрации названного вещества.
Пары гидразина при адиабатном сжатии взрываются.Склонен к разложению, что однако позволяет его использовать как монотопливо для ЖРД малой тяги (ЖРДМТ). В силу освоенности производства более распространен в США.
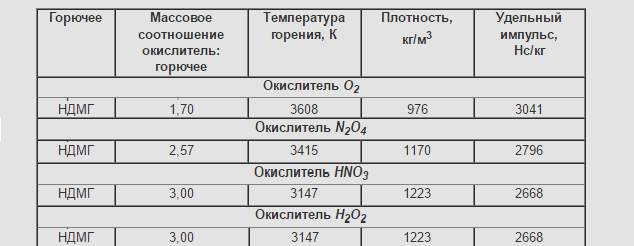
Несимметричный диметилгидразин (НДМГ)-H2N-N(CH3)2
Хим. формула:C2H8N2, Рац. формула:(CH3)2NNH2
Состояние при н.у.- жидкое
Молярная масса=60,1 г/моль
Плотность=0,79±0,01 г/см³
Широко используется на военных двигателях в следствие своей долгохранимости. При освоении технологии ампулирования-практически исчезли все проблемы.
Имеет более высокий импульс по сравнению с гидразином.
Плотность и удельный импульс с основными окислителями ниже керосина с теми же окислителями.
Самовоспламенятся с азотными окислителями. Освоен в производстве в СССР.
Любимое топливо В.П.Глушко. Не любимое топливо моего ОЗК и окружающей живой природы.
Могу написать целую статью про его гадкие свойства (на основе эксплуатации ЗРК С-200).
Используется, как правило, с азотными окислителями на ЖРД МБР, БРПЛ и КА.
Недостатки: крайне токсичен. Такая же «вонючка». На порядок дороже керосина.
Гидразин чрезвычайно ядовит
Для повышения плотности часто используют в смеси с гидразином-т.н. аэрозин-50, где 50-это процентное соотношение НДМГ. Более распространен в СССР.
А в реактивном двигателе французского истребителя-бомбардировщика Dassault Mirage III (хорошее видео-рекомендую) НДМГ используют как активизирующую добавку к традиционному топливу.
По поводу гидразиновых топлив.
Удельная тяга равна отношению тяги к весовому расходу топлива; в этом случае она измеряется в секундах (с = Н·с/Н = кгс·с/кгс). Для перевода весовой удельной тяги в массовую её надо умножить на ускорение свободного падения (примерно равное 9,81 м/с²)
За кадром остались:
Анилин, метил-, диметил-и триметиламины и CH3NHNH2-Метилгидразин (он же монометилгидразин или гептил) и пр.
Они не так распространены. Главное достоинство горючих группы гидразина-долгохранимость при использовании высококипящих окислителей. Работать с ними очень неприятно-токсичны горючие, агрессивные окислители, токсичны продукты сгорания.
На профессиональном жаргоне эти топлива называют «вонючими» или «вонючками».
Можно с высокой степенью уверенности сказать, что если на РН стоят «вонючие» двигатели, то «до замужества» она была боевой ракетой (МБР, БРПЛ или ЗУР-что уже редкость). Химия на службе армии. 
Исключение, пожалуй, лишь РН Ariane- изделие кооператива: Aérospatiale, Matra Marconi Space, Alenia, Spazio, DASA и др. Её миновала в «девичестве» подобная участь боевой.
Военные практически все перешли на РДТТ, как более удобные в эксплуатации. Ниша для «вонючих» топлив в космонавтике сузилась до использования в ДУ КА, где требуется долгое хранение без особых материальных или энергетических затрат.
Пожалуй кратко обзор можно выразить графически:
Активно работают ракетчики с метаном. Особых эксплуатационных трудностей нет: позволяет неплохо поднять давление в камере (до 40 МПа) и получить хорошие характеристики.
(РД0110МД, РД0162. Метановые проекты. Перспективные многоразовые ракеты-носители) и остальными природными газами (СПГ).
ЦСКБ «Прогресс» предлагает создать ракетный двигатель, работающий на СПГ
О прочих направления по повышению характеристик ЖРД (металлизация горючих, использование Не2, ацетам и прочем) я напишу позже. Если будет интерес.
Использование эффекта свободных радикалов-хорошая перспектива.
Детонационное горение-возможность для долгожданного прыжка на Марс.
Послесловие (нормальное):
вообще все ракетные ТК (кроме НТК), а так же попытка изготовить их в домашних условиях- очень опасны. Предлагаю внимательно ознакомиться:
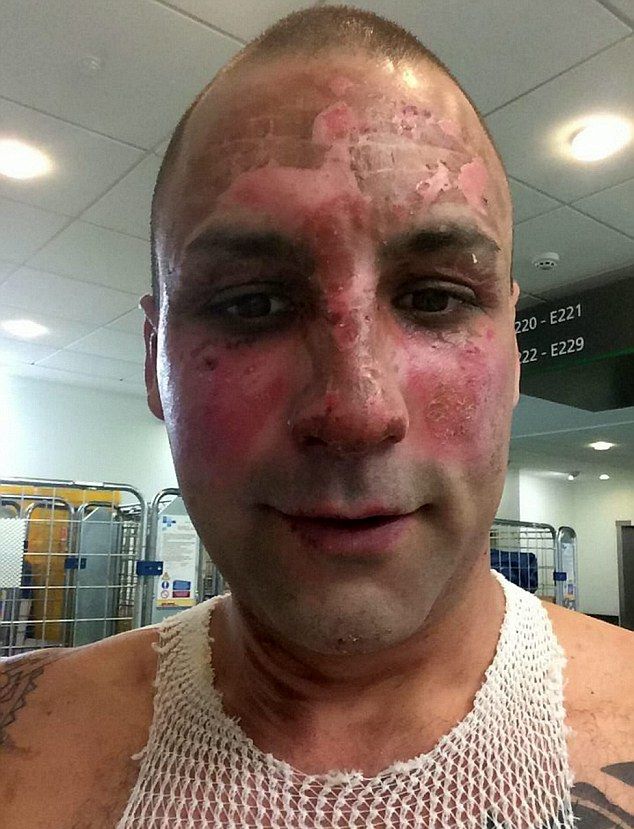
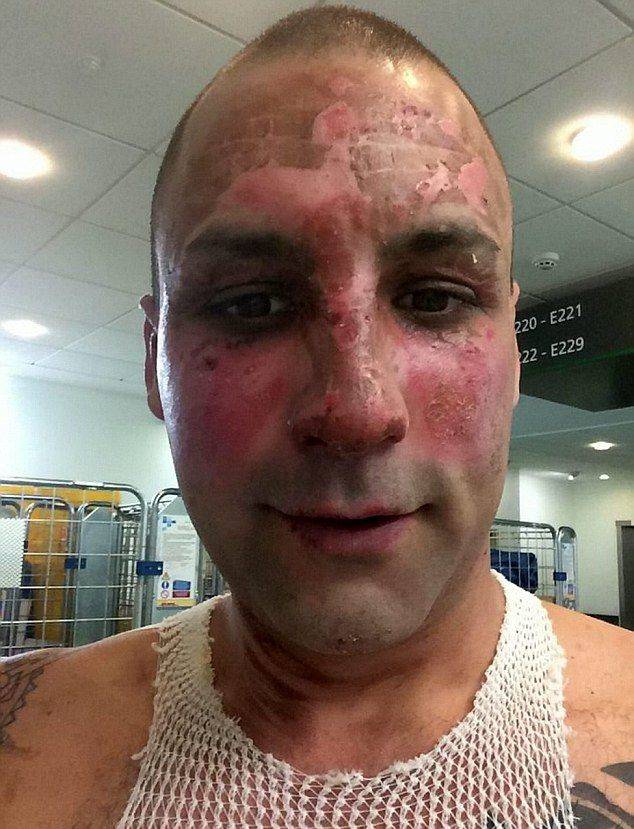
26-летний Крис Монгер, отец двоих детей, решил приготовить в домашних условиях ракетное топливо по инструкции, подсмотренной на YouTube. Смесь, которую он готовил на плите в кастрюле, ожидаемо взорвалась. В итоге мужик получил огромное количество ожогов и провел в больнице пять дней.
Все домашние (гаражные) манипуляции с такими химическими компонентами чрезвычайно опасны и к местам их разлива без ОЗК и противогаза-ЛУЧШЕ не подходить:
Как и с разлитой ртутью: звонить в МЧС, быстро приедут и всё профессионально подберут.
Послесловие, которое должно быть на самом деле
«украл», «не указывает источники», «не может ответить на элементарные вопросы » и т.д.
Я не упомянул монометилгидразин, метилгидразин и пр.
Химическая формула — О2 (мне нравится американское обозначение LOX).
У кого есть хотя бы один из значков: «Автор», «Звезда», «Легенда» или «Старожил»?
Видео:Новейшее топливо России/ как нельзя использовать ракетное топливо #ShortsСкачать

Сага о ракетных топливах
«. И нет ничего нового под солнцем»
О топливах, ракетах, ракетных двигателях писалось, пишут и будут писать.
Одной из первых работ по топливам ЖРД можно считать книгу В.П. Глушко «Жидкое топливо для реактивных двигателей», изданную в 1936 г.
Для меня тема показалась интересной, связанной с моей бывшей специальностью и учёбой в ВУЗе, тем паче «приволок» её мой младший отпрыск: «Шеф давай замесим, что нить такое и запустим, а если лень, то мы сами «сообразим». Видимо, лавры экстремалов из «Лин Индастриал» не дают покоя.
«Соображать» будем вместе, под строгим родительским контролем. Руки ноги должны быть целыми, чужие тем более.
«Ключ на старт». «Поехали»! (Ю.А. Гагарин& С.П. Королёв)
Какой бы тип РД (схема, характер процесса) не применялся в ракетной технике, его целевое предназначение: создание тяги (силы), путём преобразования исходной энергии, запасённой в РТ в кинетическую энергию (Ек) реактивной струи рабочего тела.
Ек реактивной струи в РД преобразуются разные виды энергии (химическая, ядерная, электрическая).
Для химических двигателей топливо можно разделить по фазовому состоянию: газообразное, жидкое, твёрдое, смешанное.
Видео:Всё о Ракетных двигателях. Часть 1Скачать

Часть №1 — топлива для ЖРД или жидкие ракетные топлива
Классификация химических топлив для ракетных двигателей (общепринятая):
—>Термины и сокращения.
Дополнительно (HTML-теги на TopWar не той системы, посему spoilerЫ и каты приходится так организовывать):
Удельный импульс (Iуд).
Реактивная тяга (Р или Fр).
Стехиометрическое соотношение компонентов топлива (Km0)(подробнее-кликнуть)-отношение массы окислителя к массе горючего при стехиометрических реакциях.
Состав топлива-горючая и негорючая части (в общем случае).
Виды топлив(в общем случае).
Химическим источником тепловой энергии для РД в общем случае можно считать химическую реакцию компонентов РТ.
Начну вещать с Km0. Это очень важное соотношение для РД: топливо может гореть по-разному в РД (химическая реакция в РД-это не обычное горение дров в камине, где в качестве окислителя выступает кислород воздуха). Горение (точнее окисление) топлива в камере ракетного двигателя – это, в первую очередь, химическая реакция окисления с выделением тепла. А протекание химических реакций существенно зависит от того, сколько веществ (их соотношение) вступает в реакцию.
Значение Km0 зависит от валентности, которую могут проявлять химические элементы в теоретической форме уравнения химической реакции. Пример для ЖРТ: АТ+НДМГ.
Важный параметр — коэффициент избытка окислителя (обозн. греческой «α» с индексом «ок.») и массовое соотношение компонентов Kм.
Kм=(dmок./dt)/(dmг../dt), т.е. отношение массового расхода окислителя к массовому расходу горючего. Он специфичен для каждого топлива. В идеальном случае представляет собой стехиометрическое соотношение окислителя и горючего, т.е. показывает сколько кг окислителя нужно для окисления 1 кг горючего. Однако реальные значения отличаются от идеальных. Соотношение реального Kм к идеальному и есть коэффициент избытка окислителя.
Как правило, αок. Пофантазируйте: вместо Н2О представьте ЖК (LOX).
Шугирование позволит увеличить общую плотность окислителя.
Пример захолаживания (переохлаждения) БР Р-9А: в качестве окислителя в ракете впервые было решено использовать переохлажденный жидкий кислород, что позволило уменьшить общее время подготовки ракеты к пуску и повысить степень ее боеготовности.
Давно инженеры мучились с ним, пытаясь использовать в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике.
Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и Iуд. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 против 1,14 г/см³ соответственно), а его Т кипения выше (−112 °C и −183 °C соответственно).
Пока непреодолимым препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см2 (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс для водородных двигателей, по сравнению с озон-водородными. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по Iуд на близкие к предельным значениям параметры и для повышения УИ осталось лишь одна возможность, связанная с переходом на новые виды топлива.
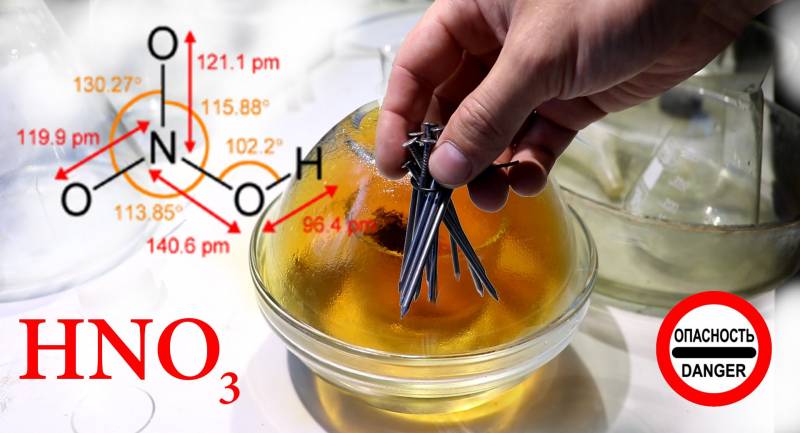
HNO3 имеет высокую плотность, невысокую стоимость, производится в больших количествах, достаточно стабильна, в том числе при высоких температурах, пожаро- и взрывобезопасная. Главное ее преимущество перед жидким кислородом в высокой температуре кипения, а, следовательно, в возможности неограниченно долго храниться без всякой теплоизоляции. Молекула азотной кислоты HNO3 – почти идеальный окислитель. Она содержит в качестве “балласта” атом азота и “половинку” молекулы воды, а два с половиной атома кислорода можно использовать для окисления топлива. Но не тут-то было! Азотная кислота настолько агрессивное вещество, что непрерывно реагирует само с собой–атомы водорода отщепляются от одной молекулы кислоты и присоединяются к соседним, образуя непрочные, но чрезвычайно химически активные агрегаты. Даже самые стойкие сорта нержавеющей стали медленно разрушаются концентрированной азотной кислотой (в результате на дне бака образовывался густой зеленоватый «кисель», смесь солей металлов). Для уменьшения коррозионной активности в азотную кислоту стали добавлять различные вещества, всего 0,5% плавиковой (фтористоводородной) кислоты уменьшают скорость коррозии нержавеющей стали в десять раз.
Мы почти 20 лет искали подходящую тару для азотной кислоты. Очень трудно при этом подобрать конструкционные материалы для баков, труб, камер сгорания ЖРД.
Вариант окислителя, что выбрали в США, с 14 % двуокиси азота. А наши ракетчики поступили иначе. Надо было догонять США любой ценой, поэтому окислители советских марок – АК-20 и АК-27 – содержали 20 и 27 % тетраоксида.
Интересный факт: в первом советском ракетном истребителе БИ-1 были использованы для полетов азотная кислота и керосин.
Баки и трубы пришлось изготовлять из монель-металла: сплава никеля и меди, он стал очень популярным конструкционным материалом у ракетчиков. Советские рубли были почти на 95 % сделаны из этого сплава.
Недостатки: терпимая «гадость». Коррозионною активна. Удельный импульс недостаточно высок. В настоящее время в чистом виде почти не используется.
«Принял эстафету» от азотной кислоты в военных двигателях. Обладает саомовоспламеняемостью с гидразином, НДМГ. Низкокипящий компонент, но может долго хранится при принятии особых мер.
Недостатки: такая же гадость, как и HNO3, но со своими причудами. Может разлагаться на окись азота. Токсичен. Низкий удельный импульс. Часто использовали и используют окислитель АК-NN. Это смесь азотной кислоты и азотного тетраоксида, иногда её называют «красной дымящейся азотной кислотой». Цифры обозначают процентное кол-во N2O4.
В основном эти окислители используются в ЖРД военного назначения и ЖРД КА благодаря своим свойствам: долгохранимость и самовоспламеняемость. Характерные горючие для АТ это НДМГ и гидразин.
Химия фтора начала развиваться с 1930-х годов, особенно быстро — в годы 2-й мировой войны 1939-45 годов и после нее в связи с потребностями атомной промышленности и ракетной техники. Название «Фтор» (от греч. phthoros — разрушение, гибель), предложенное А. Ампером в 1810 году, употребляется только в русском языке; во многих странах принято название «флюор». Это прекрасный окислитель с точки зрения химии. Окисляет и кислород, и воду, и вообще практически всё. Расчеты показывают, что максимальный теоретический Iуд можно получить на паре F2-Be (бериллий)-порядка 6000 м/с!
Супер? Облом, а не «супер».
Врагу такой окислитель не пожелаешь.
Чрезвычайно коррозионною активен, токсичен, склонен к взрывам при контакте с окисляющимися материалами. Криогенен. Любой продукт сгорания также имеет почти те же «грехи»: жутко коррозионны и токсичны.
Техника безопасности. Фтор токсичен, предельно допустимая концентрация его в воздухе примерно 2·10-4 мг/л, а предельно допустимая концентрация при экспозиции не более 1 ч составляет 1,5·10-3мг/л.
ЖРД 8Д21 применение пары фтор + аммиак давало удельный импульс на уровне 4000 м/с.
Для пары F2+H2 получается Iуд=4020 м/с!
Беда: HF-фтороводород на «выхлопе».
Стартовая позиция после запуска такого «энергичного движка»?
Лужа жидких металлов и прочих растворённых в плавиковой кислоте химических и органических объектов!
Н2+2F=2HF, при комнатной температуре существует в виде димера H2F2.
Смешивается с водой в любом отношении с образованием фтороводородной (плавиковой) кислоты. А использованию его в ЖРД КА не реально из-за убийственной сложности хранения и разрушительного действия продуктов сгорания.
Всё то же самое относится и к остальным жидким галогенам, например, к хлору.
Фтороводородный ЖРД тягой 25 т для оснащения обеих ступеней ракетного ускорителя АКС «Спираль» предполагалось разработать в ОКБ-456 В.П. Глушко на базе отработанного ЖРД тягой 10 т на фтороаммиачном (F2+NH3) топливе.
Она упомянута мною выше в однокомпонентных топливах.
Walter HWK 109-507: преимущества в простоте конструкции ЖРД. Яркий пример такого топлива — перекись водорода.
Alles: список более-менее реальных окислителей закончен. Акцентирую внимание на HClО4. Как самостоятельные окислители на основе хлорной кислоты представляют интерес только: моногидрат (Н2О+ClО4)-твёрдое кристаллическое вещество и дигидрат (2НО+НСlО4)-плотная вязкая жидкость. Хлорная кислота (которая из-за Iуд сама по себе бесперспективна), при этом представляет интерес в качестве добавки к окислителям, гарантирующей надёжность самовоспламенения топлива.
Окислители можно классифицировать и так:
Итоговый (чаще используемый) список окислителей в связке с реальными же горючими:
Примечание: если хотите перевести один вариант удельного импульса в другой, то можно пользоваться простой формулой: 1 м/с = 9,81 с.
В отличие от них — горючих у нас «завались».
Видео:Энергонасыщенные материалы: пороха и ракетные топливаСкачать

Горючие
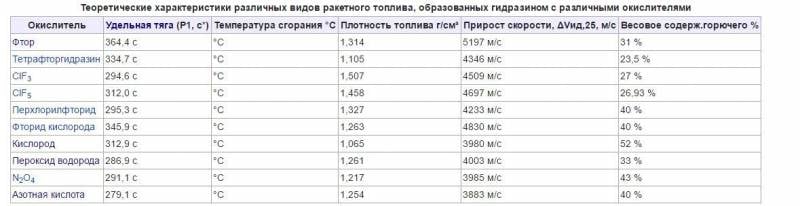
Основные характеристики двухкомпонентных ЖРТ при pк/pа=7/0,1 МПа
По физико-химическому составу их можно разбить на несколько групп:
Углеводородные горючие.
Низкомолекулярные углеводороды.
Простые вещества: атомарные и молекулярные.
Для этой темы пока практический интерес представляет лишь водород (Hydrogenium).
Na, Mg, Al, Bi, He, Ar, N2, Br2, Si, Cl2, I2 и др. я не буду рассматривать в этой статье.
Гидразиновые топлива («вонючки»).
Просыпайтесь сони — мы добрались уже до спирта(С2Н5ОН).
Поиски оптимального горючего начались с освоения энтузиастами ЖРД. Первым широко использовавшимся горючим стал спирт (этиловый), применявшийся на первых
советских ракетах Р-1, Р-2, Р-5 («наследство» ФАУ-2) и на самой Vergeltungswaffe-2.
Вернее раствор 75% этилового спирта (этанол, этиловый спирт, метилкарбинол, винный спирт или алкоголь, часто в просторечии просто «спирт») — одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), другой вариант: CH3-CH2-OH
У этого горючего два серьёзных недостатка, которые очевидно не устраивали военных: низкие энергетические показатели и низкая стойкость личного состава к «отравлению» таким горючим.
Сторонники здорового образа жизни (спиртофобы) пытались решить вторую проблему с помощью фурфурилового спирта. Это ядовитая, подвижная, прозрачная, иногда желтоватая (до темно-коричневого), со временем краснеющая на воздухе жидкость. ВАРВАРЫ!
Условная формула C7,2107H13,2936
Горючая смесь жидких углеводородов (от C8 до C15) с температурой кипения в интервале 150—250 °C, прозрачная, бесцветная (или слегка желтоватая), слегка маслянистая на ощупь
плотность — от 0,78 до 0,85 г/см³ (при температуре 20°С);
вязкость — от 1,2 – 4,5 мм²/с (при температуре 20°С);
температура вспышки — от 28°С до 72°С;
теплота сгорания — 43 Мдж/кг.
Моё мнение: о точной молярной массе писать бессмысленно
Керосин является смесью из различных углеводородов, поэтому появляются страшные дроби (в хим. формуле) и «размазанная» температура кипения. Удобное высококипящее горючее. Используется давно и успешно во всём мире в двигателях и в авиации. Именно на нем до сих пор летают «Союзы». Малотоксичен (пить настоятельно не рекомендую), стабилен. Всё же керосин опасен и вреден для здоровья (употребление внутрь).
А ведь находятся люди, которые им что только ни лечат! Минздрав категорически против!
Солдатские байки: хорошо помогает избавиться от противных Pthirus pubis.
Однако и он требует осторожности в обращении при эксплуатации: видео аварии пассажирского самолёта
Существенные плюсы: сравнительно недорог, освоен в производстве. Пара керосин-кислород идеальна для первой ступени. Ее удельный импульс на земле 3283 м/с, пустотный 3475 м/с. Недостатки. Относительно малая плотность.
Американские ракетные керосины Rocket Propellant-1 или Refined Petroleum-1
Относительно дешёвый был раньше.
Для повышения плотности лидерами освоения космоса были разработаны синтин (СССР) и RJ-5 (США).
Синтез синтина.
Керосин имеет склонность к отложению смолистых осадков в магистралях и тракте охлаждения, что отрицательно сказывается на охлаждении. На это его нехорошее свойство педалируют Мухин, Велюров @Co.
Керосиновые двигатели наиболее освоены в СССР.
Шедевр человеческого разума и инженерии наша «жемчужина» РД-170/171:
Теперь более корректным названием для горючих на основе керосина стал термин УВГ-«углеводородное горючее», т.к. от керосина, который жгли в безопасных керосиновых лампах И. Лукасевича и Я. Зеха, применяемое УВГ «ушло» очень далеко.
На самом деле «Роскосмос» дезу выдаёт:
Всеми сейчас рассматривается как перспективное и дешёвое топливо, как альтернатива керосину и водороду.
Главный конструктор НПО «Энергомаш» Владимир Чванов:
Недорог, распространен, устойчив, малотоксичен. По сравнению с водородом имеет более высокую температуру кипения, а удельный импульс в паре с кислородом выше, чем у керосина: около 3250-3300 м/с на земле. Неплохой охладитель.
Недостатки. Низкая плотность (вдвое ниже чем у керосина). При некоторых режимах горения может разлагаться с выделением углерода в твердой фазе, что может привести к падению импульса из-за двухфазности течения и резкому ухудшению режима охлаждения в камере из-за отложения сажи на стенках КС. В последнее время идут активные НОР и НИОКР в области его применения (наряду с пропаном и природным газом) даже в направлении модификации уже сущ. ЖРД (в частности такие работы были проведены над РД-0120).
Или «Kinder Surpeis», как пример: американский Raptor engine от Space X:
К этим топливам можно отнести пропан и природный газ. Основные их характеристики, как горючих, близки (за исключением большей плотности и более высокой температуры кипения) к УВГ. И имеются такие же проблемы при их использовании.
Особняком среди горючих позиционируется Водород-H2 (Жидкий: LH2).
Использование пары LOX-LH2 предложено еще Циолковским, но реализовано другими:
С точки зрения термодинамики Н2 идеальное рабочее тело как для самого ЖРД, так и для турбины ТНА. Отличный охладитель, при чем как в жидком, так и в газообразном состоянии. Последний факт позволяет не особо бояться кипения водорода в тракте охлаждения и использовать газифицированный таким образом водород для привода ТНА.
Такая схема реализована в Aerojet Rocketdyne RL-10-просто шикарный (с инженерной точки зрения) движок:
Наш аналог (даже лучше, т.к. моложе): РД-0146 (Д, ДМ) — безгазогенераторный жидкостный ракетный двигатель, разработанный Конструкторским бюро химавтоматики в Воронеже.
Особенно эффективен с сопловым насадком из материала «Граурис». Но пока не летает
Этот ТК обеспечивает высокий удельный импульс-в паре с кислородом 3835 м/с.
Из реально используемых это самый высокий показатель. Эти факторы обуславливают пристальный интерес к этому горючему. Экологически чист, на «выходе» в контакте с О2: вода (водяной пар). Распространен, практически неограниченные запасы. Освоен в производстве. Нетоксичен. Однако есть очень много ложек дегтя в этой бочке мёда.
1. Чрезвычайно низкая плотность. Все видели огромные водородные баки РН «Энергия» и МТКК «Шаттл». Из-за низкой плотности применим (как правило) на верхних ступенях РН.
Кроме того, низкая плотность ставит непростую задачу для насосов: насосы водорода многоступенчатые для того что бы обеспечить нужный массовый расход и при этом не кавитировать.
По этой же причине приходится ставить т.н. бустерные насосные агрегаты горючего (БНАГ) сразу за заборным устройством в баках, дабы облегчить жизнь основному ТНА.
Ещё насосы водорода для оптимальных режимов требуют значительно большей частоты вращения ТНА.
2. Низкая температура. Криогенное топливо. Перед заправкой необходимо проводить многочасовое захолаживание (и/или переохлаждение) баков и всего тракта. Баки РН «Falocn 9FT» — взгляд изнутри:
Подробнее о «сюрпризах»:
«МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ТЕПЛОМАССООБМЕННЫХ ПРОЦЕССОВ В ВОДОРОДНЫХ СИСТЕМАХ» Н0Р В.А. ГордеевВ.П. Фирсов, А.П. Гневашев, Е.И. Постоюк
ФГУП «ГКНПЦ им. М.В. Хруничева, КБ «Салют»; «Московский авиационный институт (Государственный технический университет)
Низкая температура кипения затрудняет и закачку в баки и хранение этого топлива в баках и хранилищах.
3. Жидкий водород обладает некоторыми свойствами газа:
Коэффициент сжимаемости (pv/RT) при 273,15 К : 1,0006 (0,1013 МПа), 1,0124 (2,0266 МПа), 1,0644 (10,133 МПа), 1,134 (20,266 МПа), 1,277 (40,532 МПа);
Водород может находиться в орто- и пара-состояниях. Ортоводород (о-Н2) имеет параллельную (одного знака) ориентацию ядерных спинов. Пара-водород (п-Н2)-антипараллельную.
При обычных и высоких температурах Н2 (нормальный водород, н-Н2) представляет собой смесь 75% орто- и 25% пара-модификаций, которые могут взаимно превращаться друг в друга (орто-пара-превращение). При превращении о-Н2 в п-Н2 выделяется тепло (1418 Дж/моль).
Это всё накладывает дополнительные трудности в проектировании магистралей, ЖРД, ТНА, циклограммы работы, и особенно насосов.
4. Газообразный водород быстрее других газов распространяется в пространстве, проходит через мелкие поры, при высоких температурах сравнительно легко проникает сквозь сталь и другие материалы. Н2г обладает высокой теплопроводностью, равной при 273,15 К и 1013 гПа 0,1717 Вт/(м*К) (7,3 по отношению к воздуху).
Водород в обычном состоянии при низких температурах малоактивен, без нагревания реагирует лишь с F2 и на свету с Сl2. С неметаллами водород взаимодействует активнее, чем с металлами. С кислородом реагирует практически необратимо, образуя воду с выделением 285,75 МДж/моль тепла;
5. Со щелочными и щелочно-земельными металлами, элементами III, IV, V и VI группы периодической системы, а также с интерметаллическими соединениями водород образует гидриды. Водород восстанавливает оксиды и галогениды многих металлов до металлов, ненасыщенные углеводороды – до насыщенных (см. Гидрирование).
Водород очень легко отдает свой электрон. В растворе отрывается в виде протона от многих соединений, обусловливая их кислотные свойства. В водных растворах Н+ образует с молекулой воды ион гидроксония Н3О. Входя в состав молекул различных соединений, водород склонен образовывать со многими электроотрицательными элементами (F, О, N, С, В, Cl, S, Р) водородную связь.
6. Пожароопастность и взрывоопасность. Можно не рассусоливать: гремучую смесь все знают.
Смесь водорода с воздухом взрывается от малейшей искры в любой концентрации — от 5 до 95 процентов.
Т.о. водород есть и Gut (даже Sehr Gut), и одновременно «головная боль» (даже сильная боль головная).
Первый закон диалектики: «Единство и борьба противоположностей» /Georg Wilhelm Friedrich Hegel/
Впечатляет Space Shuttle Main Engine (SSME)?
Теперь прикиньте его стоимость!
Вероятно, увидев это и посчитав затраты (стоимость вывода на орбиту 1 кг ПН), законодатели и те кто рулит бюджетом США и NASA в частности. решили «ну его на фиг».
И я их понимаю — на РН «Союз» и дешевле, и безопаснее, да использование РД-180/181 снимает многие проблемы американских РН и существенно экономит деньги налогоплательщиков самой богатой страны мира.
Наиболее освоены водородные двигатели в США.
Сейчас мы позиционируемся на 3-4 месте в «Водородном клубе» (после Европы, Японии и Китая/Индии).
Отдельно упомяну твёрдый и металлический водород.
Твердый водород кристаллизуется в гексагональной решетке (а = = 0,378 нм, с = 0,6167 нм), в узлах которой расположены молекулы Н2, связанные между собой слабыми межмолекулярными силами; плотность 86,67 кг/м³; С° 4,618 Дж/(моль*К) при 13 К; диэлектрик. При давлении свыше 10000 МПа предполагается фазовый переход с образованием структуры, построенной из атомов и обладающей металлическими свойствами. Теоретически предсказана возможность сверхпроводимости «металлический водород».
Шотландский химик Дж. Дьюар в 1899 году впервые получил водород в твёрдом состоянии. Для этого он использовал регенеративную охлаждающую машину, основанную на эффекте Джоуля—Томсона.
Беда с ним. Он постоянно теряется: «Ученые потеряли единственный в мире образец металлического водорода». Оно и понятно: получен кубик из молекул: 6х6х6. Просто «гигантские» объёмы — прям хоть сейчас «заправляй» ракету. Почему-то мне это напомнило «нанотанк Чубайса». Это нано-чудо не могут найти уже лет 7 или больше.
Анамезон, антивещество, метастабильный гелий пока оставлю за кадром.
Кого смутил Iуд в размерности Н*с/кг отвечаю: это обозначение «любят» военные.
Ньютон — производная единица, исходя из второго закона Ньютона она определяется как сила, изменяющая за 1 секунду скорость тела массой 1 кг на 1 м/с в направлении действия силы. Таким образом, 1 Н = 1 кг·м/с 2 .
Соответственно: 1 Н*с/кг =1 кг·м/с 2 *с/кг=м/с.
Освоен в производстве.
Недостатки: токсичен, вонючий.
Пары гидразина при адиабатном сжатии взрываются. Склонен к разложению, что однако позволяет его использовать как монотопливо для ЖРД малой тяги (ЖРДМТ). В силу освоенности производства более распространен в США.
Широко используется на военных двигателях в следствие своей долгохранимости. При освоении технологии ампулирования — практически исчезли все проблемы (кроме утилизации и аварий припусках).
Имеет более высокий импульс по сравнению с гидразином.
Плотность и удельный импульс с основными окислителями ниже керосина с теми же окислителями. Самовоспламенятся с азотными окислителями. Освоен в производстве в СССР.
Любимое топливо В.П.Глушко. Не любимое топливо моего ОЗК и окружающей живой природы.
Могу написать целую статью про его гадкие свойства (на основе эксплуатации ЗРК С-200).
Используется, как правило, с азотными окислителями на ЖРД МБР, БРПЛ, КА и на нашей РН «Протон-*».
Недостатки: крайне токсичен. Такая же «вонючка», как и остальные «вонючки». На порядок дороже керосина.
Гидразин чрезвычайно ядовит
Для повышения плотности часто используют в смеси с гидразином-т.н. аэрозин-50, где 50-это процентное соотношение НДМГ. Более распространен в СССР.
А в реактивном двигателе французского истребителя-бомбардировщика Dassault Mirage III (хорошее видео-рекомендую) НДМГ используют как активизирующую добавку к традиционному топливу.
По поводу гидразиновых топлив.
Удельная тяга равна отношению тяги к весовому расходу топлива; в этом случае она измеряется в секундах (с = Н·с/Н = кгс·с/кгс). Для перевода весовой удельной тяги в массовую её надо умножить на ускорение свободного падения (примерно равное 9,81 м/с²)
За кадром остались:
Анилин, метил-, диметил- и триметиламины и CH3NHNH2-Метилгидразин (он же монометилгидразин или гептил) и пр.
На профессиональном жаргоне эти топлива называют «вонючими» или «вонючками».
Можно с высокой степенью уверенности сказать, что если на РН стоят «вонючие» двигатели, то «до замужества» она была боевой ракетой (МБР, БРПЛ или ЗУР — что уже редкость). Химия на службе и армии и гражданки.
Исключение, пожалуй, лишь РН Ariane — творение кооператива: Aérospatiale, Matra Marconi Space, Alenia, Spazio, DASA и др. Её миновала в «девичестве» подобная боевая участь.
Военные практически все перешли на РДТТ, как более удобные в эксплуатации. Ниша для «вонючих» топлив в космонавтике сузилась до использования в ДУ КА, где требуется долгое хранение без особых материальных или энергетических затрат.
Пожалуй, кратко обзор можно выразить графически:
Активно работают ракетчики и с метаном. Особых эксплуатационных трудностей нет: позволяет неплохо поднять давление в камере (до 40 МПа) и получить хорошие характеристики.
(РД0110МД, РД0162. Метановые проекты. Перспективные многоразовые ракеты-носители) и остальными природными газами (СПГ).
О прочих направления по повышению характеристик ЖРД (металлизация горючих, использование Не2, ацетама и прочем) я напишу позже. Если будет интерес.
Послесловие:
Все домашние (гаражные) манипуляции с такими химическими компонентами чрезвычайно опасны, а порой и противозаконны. К местам их разлива без ОЗК и противогаза ЛУЧШЕ не подходить:
Как и с разлитой ртутью: звонить в МЧС, быстро приедут и всё профессионально подберут.
Всем спасибо, кто смог вытерпеть всё это до конца.
💡 Видео
Карамельный домик из ракетного топлива - Что будет если зажечь ?Скачать

Ракетное топливо из строительной пены Твердое ракетное топливо содержит окислитель и топливо, которыСкачать

Жидкое ракетное топливо - История созданияСкачать

ИСПЫТАНИЕ РАКЕТНОГО ТОПЛИВА НА САХАРЕСкачать

Беларусь избавляется от некондиционного ракетного топливаСкачать

Гептил. Самое опасное вещество СССРСкачать

Владимир Судаков — Принципы работы ракетных двигателейСкачать

Ракетное топливо из СНЕГА! /Простые экспериментыСкачать

Я Купил ГЕПТИЛ - Самое Опасное Вещество!Скачать

Утилизация ракетного топливаСкачать

горение H2O2-ракетного топлива космических кораблей, как альтернативное топливо для обогрева в печахСкачать

Если перегреть карамельное ракетное топливо. Что будет?Скачать

Испытания ракетного топлива ПХА (Перхлорат аммония, алюминий, связующие, 70, 10{a329736f53869e824b8271027cdbd5608b8ecc194298e98cСкачать