Химическая коррозия — разрушение металла за счет его окисления веществами, содержащимися в окружающей среде, без возникновения в системе электрического тока в соответствии с уравнением в общем виде:
По условиям протекания коррозионного процесса (характеру агрессивной среды) различают:
а) газовую коррозию — в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах. Примером газовой коррозии может служить окисление металла кислородом воздуха при высоких температурах
nМе + 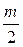
или в среде различных агрессивных газов. Например, в среде иода на поверхности меди происходит окислительно-восстановительная реакция:
2 │Cu – 1ē → Сu + окисление
1 │I2 + 2ē → 2I – восстановление.
б) коррозию в неэлектролитах — агрессивных органических жидкостях, таких, как сернистая нефть и др.
Кинетика химической коррозии. Скорость химической коррозии, в первую очередь, зависит от свойств образующихся продуктов коррозии. В процессе окисления на поверхности металла образуется твердая пленка оксидов. Для дальнейшего продолжения коррозии необходимо, чтобы ионы металла или кислород (или оба одновременно) диффундировали через эту пленку. Обычно с поверхности раздела металл—оксид в направлении от металла к внешней поверхности пленки происходит диффузия ионов металла, а не атомов, так как ионы металлов по размерам меньше атомов. Одновременно в этом же направлении должны перемещаться электроны. Ионы О 2– имеют больший радиус, чем атомы, поэтому с поверхности раздела оксид—газ в глубь пленки двигаются не ионы, а атомы кислорода, которые в пленке ионизируются:
и, встречаясь с ионами металла, образуют оксиды.
Для щелочных и щелочноземельных металлов наблюдается линейный закон роста толщины пленок во времени:
где y — толщина пленки, k — постоянная, зависящая от природы металла, t — время окисления.
При повышении температуры реакция окисления таких металлов начинает резко ускоряться вследствие плохого отвода теплоты.
Для металлов Fе, Со, Ni, Мn, Тi по мере утолщения пленки дальнейший рост её будет все время замедляться. Рост пленки для этих металлов характеризуется параболической зависимостью и описывается выражением:
где D — коэффициент диффузии; CO2— концентрация кислорода.
Для металлов Zn, Аl, Cr установлена логарифмическая зависимость роста пленки во времени:
где k — постоянная, зависящая от природы металла. Пленки на таких металлах обладают высокими защитными свойствами.
Помимо кислорода сильными окислителями являются фтор, диоксид серы, хлор, сероводород. Их агрессивность по отношению к различным металлам неодинакова. Так например, алюминий и его сплавы, хром и стали с высоким содержанием хрома устойчивы в атмосфере кислорода, но становятся неустойчивыми в атмосфере хлора. Никель неустойчив в атмосфере диоксида серы, а медь вполне устойчива. Различная скорость коррозии металлов в разных средах обусловлена прежде всего свойствами образующихся на поверхности металлов оксидных пленок. При изменении состава внешней среды изменяется состав защитной пленки, ее физико-химические свойства и защитные качества.
Дата добавления: 2015-09-14 ; просмотров: 541 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- Коррозия и защита металлов
- лаба 8 коррозия.docx
- Медь. Химия меди и ее соединений
- Положение в периодической системе химических элементов
- Электронное строение меди
- Физические свойства
- Нахождение в природе
- Способы получения меди
- Качественные реакции на ионы меди (II)
- Химические свойства меди
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- Оксид меди (I)
- Способы получения оксида меди (I)
- Химические свойства оксида меди (I)
- Гидроксид меди (II)
- Способы получения гидроксида меди (II)
- Химические свойства
- Соли меди
- Соли меди (I)
- Соли меди (II)
- Медь и соединения меди
- 🔍 Видео
Видео:Химическая коррозияСкачать

Коррозия и защита металлов
Автор: Пользователь скрыл имя, 12 Декабря 2011 в 13:31, лабораторная работа
Краткое описание
Цель работы: изучение влияния некоторых фактов на протекание процессов химической и электрохимической коррозии и методов защиты от коррозии.
Файлы: 1 файл
Видео:Электрохимическая коррозияСкачать

лаба 8 коррозия.docx
Санкт-Петербургский государственный электротехнический университет
кафедра физической химии
По лабораторно-практической работе №10
Коррозия и защита металлов
Выполнил Лапшина О.В.
Преподаватель Худоложкин В.Н.
| Оценка лабораторно- практического занятия | |||||
| Выполнение ИДЗ | Подготовка к лабораторной работе | Отчет по лабораторной работе | Коллоквиум | Комплексная оценка | |
«Выполнено» «___» _____________
Подпись преподавателя ____________
Коррозия и защита металлов
Цель работы: изучение влияния некоторых фактов на протекание процессов химической и электрохимической коррозии и методов защиты от коррозии.
Коррозия – процесс самопроизвольного разрушения металлов или металлических оплавов вследствие их химического или электрохимического взаимодействия с агрессивной окружающей средой.
При химической коррозии металлы разрушаются вследствие протекания гетерогенных химических реакций: это или взаимодействие с агрессивными газами при высоких температурах, исключающих конденсацию влаги на поверхности металла, или растворение металла в органических средах, не проводящих ток. Электрохимическая коррозия протекает в проводящих ток средах.
При контакте разнородных материалов в агрессивной среде возникает коррозионный короткозамкнутый гальванический элемент: на металле с более отрицательным электродным потенциалом протекает процесс окисления Ме – ne — Me n+ , а не менее активном металле имеют место процессы:
2H + + 2e — H2 (в кислой среде),
2Н2О + 2е — Н2 + 2ОН – (в близкой к нейтральной среде);
О2 + 2Н2О +4е — 4ОН — (в присутствии кислорода воздуха)
Основными методами защиты от коррозии являются:
1. Нанесение защитных покрытий. Они подразделяются на металлические , неметаллические и образованные в результате химической или электрохимической обработки металла.
2. Электрохимическая защита – катодная и протекторная.
3. Обработка коррозионной среды – за счет деаэрации (удаление из среды растворенных газов ) или добавления ингибиторов (веществ, замедляющих коррозию).
Металлические покрытия подразделяются на катодные, электродный потенциал материала которых положительнее потенциала защищаемого металла, и анодные, с более отрицательным , чем у основного металла, электродным потенциалом.
Ингибиторы коррозии, адсорбируясь на поверхности металла, либо тормозят электродные процессы коррозионных элементов, либо образуют на поверхности металла плотную защитную оксидную пленку.
Порядок выполнения работы
Опыт 1. Коррозия меди при контакте с йодом.
Положите в тигель несколько кристаллов йода. Медную проволочку очистите тонкой наждачной бумагой и прикрепите к ушку на крышке тигля. Накройте тигель крышкой так, чтобы ушко с медной проволочкой находилось внутри тигля. Поставьте тигель на кольцо штатива и слегка нагрейте пламенем спиртовки (опыт проводить в вытяжном шкафу). Через 2-3 минуты прекратите нагревание , дайте остыть и снимите с него крышку. Обратите внимание на изменение поверхности медной проволоки в связи с образованием соли Cu2I2. Напишите уравнение химической коррозии меди в среде йода.
Опыт 2. Коррозия двух контактирующих металлов.
1. В U- образную стеклянную трубку, заполненную 0,1 н- раствором H2SO4 , опустить две пластинки (цинковую и медную) , не допуская их взаимного касания. Наблюдать выделение водорода на цинке и отсутствие этого процесса на меди.
2. Привести металлы в соприкосновение. Отметить изменение в процессе выделения водорода и дать объяснение. Написать уравнения процессов коррозии, идущих на электродах образовавшейся гальванической коррозионной пары металлов.
Опыт 3. Влияние механических напряжений в металле на его коррозию.
Поверхность стальной проволоки очистить наждачной бумагой, обезжирить ацетоном, промыть водой и досуха протереть фильтровальной бумагой. Проволоку согнуть так, чтобы на отдельных её участках была различная степень деформации. Поместить проволоку в плоскую чашку и залить 3 — % — ным раствором NaCl , добавив 3 капли K3[Fe(CN)6] и 2 капли фенолфталеина. Феррицианид калия K3[Fe(CN)6] в присутствии ионов Fe 2+ окрашивает раствор в синий цвет, фенолфталеин в щелочной среде дает малиновую окраску.
Наблюдать на проволоке появление участков, окрашенных в синий и розовый цвет. Объяснить наблюдаемые явления. Написать процессы, идущие при коррозии различно деформированных участков металла.
Опыт 4. Влияние неравномерной аэрации па процесс коррозии.
Зачищенную наждачной бумагой железную пластинку поместить в пробирку с 3 — % — ным раствором NaCl , так, чтобы часть пластины оказалась непогруженной в раствор. Добавить в раствор по 2 капли K3[Fe(CN)6] и фенолфталеина. Наблюдать появление окрашивания в синий цвет раствора вокруг участка пластины, который находится в растворе, и окрашивания в розовый цвет того участка который соприкасается с воздухом. Объяснить и написать процессы происходящие на электродах короткозамкнутых гальванических элементов, образовавшихся вследствие неравномерного снабжения кислородом различных участков железной пластины.
Опыт 5. Действие стимулятора коррозии.
Взять две пробирки, в одну налить раствор CuSO4 , в другую – CuCl2. В каждую из пробирок опустить по кусочку алюминия. Алюминий покрыт защитной пленкой оксида Al2O3 . При разрушении этой пленки возможно вытеснение меди из раствора ее соли более активным металлом (алюминием). Вытеснение меди п первой пробирке идет очень медленно, во второй – быстро. Объяснить различие и написать уравнения процессов, идущих на пластинах.
Способы защиты от коррозии
Опыт 6. Защитное действие оксидной пленки.
Зачистить поверхность пластины из алюминия наждачной бумагой и протереть фильтрованной бумагой. На средину пластины поместить несколько капель соли ртути, соблюдая при это осторожность, так как соли ртути ЯДОВИТЫ ! Ртуть, растворяя металлы, образует жидкие сплавы, в которых металл сохраняет свои свойства. Через некоторое время осторожно осушить пластину фильтровальной бумагой. Проследить за образованием на поверхности пластины рыхлого слоя гидроксида алюминия. Поверхность пластины протереть фильтровальной бумагой и погрузить в стакан с водой. Наблюдать выделение газа. Написать процессы, идущие на алюминиевой пластине.
Опыт 7. Пассивация металлической поверхности.
При обработке железа концентрированной серой или азотной кислотами на его поверхности образуется слой защитной оксидной пленки. Такой процесс называется пассивацией.
Железную пластинку зачистить наждачной бумагой и опустить в 2 н-раствор H2SO4. Отметить интенсивность выделения газа. Налить в другую пробирку 4-5 мл дымящейся азотной кислоты, плотностью 1,52 г/см 3 (опыт проводить в вытяжном шкафу), перенести в нее железную пластину из первой пробирки на 2-3 мин. Затем снова перенести пластинку в первую пробирку. Изменилась ли интенсивность выделения водорода?
Написать уравнения пассивации железа дымящейся HNO3 считая, что образовавшаяся на поверхности оксидная пленка имеет состав Fe2O3.
Опыт 8. Анодное и катодное покрытия.
Два стакана заполнить 3 % — ным раствором NaCl , добавив в каждый по несколько капель K3[Fe(CN)6]. Взять пластины оцинкованного и луженого железа, на их поверхности нанести царапины и раздельно поместить в стаканы. Наблюдать, какая пластина раньше подвергается коррозии. Дать объяснение. Написать уравнения электродных процессов, идущих при коррозии. Дать объяснение. Написать уравнение электродных процессов, идущих при коррозии каждого образца.
Опыт 9. Протекторная защита.
Два стакана заполнить 0,2 н- раствором уксусной кислоты CH3COOH , добавив в каждый по несколько капель раствора KI. В один стакан поместить плотно соединенные между собой пластины свинца и цинка, в другой – только пластину свинца. Наблюдать, в каком стакане раньше появится желтая окраска PbI2. Дать объяснения. Написать электродные процессы, идущие при коррозии каждого образца.
Опыт 10. Влияние ингибитора на коррозию металла.
Две железные проволоки зачислить наждачной бумагой, промыть холодной водой и на 2-3 мин опустить в раствор HCl (1:1). В две три пробирки влить по 10 – 15 капель 0,2 н- раствора H2SO4 и по 2 – 3 капли K3[Fe(CN)6]. В одну пробирку добавить немного уротропина. В обе пробирки поместить проволоку. Отметить время появления окрашивания раствора в синий цвет в каждой пробирке и интенсивность окраски. Какова роль уротропина?
Требования к отчету
Работа должна быть оформлена в соответствии с общепринятыми требованиями к отчетам по лабораторным работам. В выводах должны быть сформулированы причины, вызывающие коррозию металлов, а так же перечислены методы защиты от коррозии. По каждому опыту необходимо составить уравнение ракции.
Видео:Химическая реакция йода и алюминия.Скачать

Медь. Химия меди и ее соединений
Положение в периодической системе химических элементов
Медь расположена в 11 группе (или в побочной подгруппе II группы в короткопериодной ПСХЭ) и в четвертом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение меди
Электронная конфигурация меди в основном состоянии :
+29Cu 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1 1s 

3s 


У атома меди уже в основном энергетическом состоянии происходит провал (проскок) электрона с 4s-подуровня на 3d-подуровень.
Физические свойства
Медь – твердый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. В природе встречается в том числе в чистом виде и широко применяется в различных отраслях науки, техники и производства.
Изображение с портала zen.yandex.com/media/id/5d426107ae56cc00ad977411/uralskaia-boginia-liubvi-5d6bcceda660d700b075a12d
Температура плавления 1083,4 о С, температура кипения 2567 о С, плотность меди 8,92 г/см 3 .
Медь — ценный металл в сфере вторичной переработки. Сдав лом меди в пункт приема, Вы можете получить хорошее денежное вознаграждение. Подробнее про прием лома меди.
Нахождение в природе
Медь встречается в земной коре (0,0047-0,0055 масс.%), в речной и морской воде. В природе медь встречается как в соединениях, так и в самородном виде. В промышленности используют халькопирит CuFeS2, также известный как медный колчедан, халькозин Cu2S и борнит Cu5FeS4. Также распространены и другие минералы меди: ковеллин CuS, куприт Cu2O, азурит Cu3(CO3)2(OH)2, малахит Cu2 (OH) 2 CO 3 . Иногда медь встречается в самородном виде, масса которых может достигать 400 тонн .
Способы получения меди
Медь получают из медных руд и минералов. Основные методы получения меди — электролиз, пирометаллургический и гидрометаллургический.
- Гидрометаллургический метод: р астворение медных минералов в разбавленных растворах серной кислоты, с последующим вытеснением металлическим железом.
Например , вытеснение меди из сульфата железом:
CuSO4 + Fe = Cu + FeSO4
- Пирометаллургический метод : получение меди из сульфидных руд. Это сложный процесс, который включает большое количество реакций. Основные стадии процесса:
1) Обжиг сульфидов:
2CuS + 3O2 = 2CuO + 2SO2
2) восстановление меди из оксида, например, водородом:
CuO + H2 = Cu + H2O
- Электролиз растворов солей меди:
Качественные реакции на ионы меди (II)
Качественная реакция на ионы меди +2 – взаимодействие солей меди (II) с щелочами . При этом образуется голубой осадок гидроксида меди(II).
Например , сульфат меди (II) взаимодействует с гидроксидом натрия:
Соли меди (II) окрашивают пламя в зеленый цвет.
Химические свойства меди
В соединениях медь может проявлять степени окисления +1 и +2.
1. Медь — химически малоактивный металл. При нагревании медь может реагировать с некоторыми неметаллами: кислородом, серой, галогенами.
1.1. При нагревании медь реагирует с достаточно сильными окислителями , например , с кислородом , образуя CuО, Cu2О в зависимости от условий:
2Cu + О2 → 2CuО
1.2. Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
1.3. Медь взаимодействует с галогенами . При этом образуются галогениды меди (II):
Но, обратите внимание:
2Cu + I2 = 2CuI
1.4. С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
1.5. Медь не взаимодействует с водородом.
1.6. Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
2. Медь взаимодействует и со сложными веществами:
2.1. Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зеленым налетом карбоната гидроксомеди (II):
2.2. В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например , медь не реагирует с разбавленной серной кислотой :
2.3. При этом медь реагирует при нагревании с концентрированной серной кислотой . При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
2.4. Медь реагирует даже при обычных условиях с азотной кислотой .
С концентрированной азотной кислотой:
С разбавленной азотной кислотой:
Реакция меди с азотной кислотой
2.5. Растворы щелочей на медь практически не действуют.
2.6. Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей .
Например , медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO 3 ) 2 + Cu = Cu(NO 3 ) 2 + Hg
2.7. Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Оксид меди (I)
Оксид меди (I) Cu2O – твердое кристаллическое вещество коричнево-красного цвета.
Способы получения оксида меди (I)
В лаборатории оксид меди (I) получают восстановлением свежеосажденного гидроксида меди (II), например, альдегидами или глюкозой:
Химические свойства оксида меди (I)
1. Оксид меди (I) обладает основными свойствами.
При действии на оксид меди (I) галогеноводородных кислот получают галогениды меди (I) и воду:
Например , соляная кислота с оксидом меди (I) образует хлорид меди (I):
Cu2O + 2HCl = 2CuCl↓ + H2O
2. При растворении Cu2O в концентрированной серной, азотной кислотах образуются только соли меди (II):
3. Устойчивыми соединениями меди (I) являются нерастворимые соединения (CuCl, Cu2S) или комплексные соединения [Cu(NH3)2] + . Последние получают растворением в концентрированном растворе аммиака оксида меди (I), хлорида меди (I):
Аммиачные растворы солей меди (I) взаимодействуют с ацетиленом :
СH ≡ CH + 2[Cu(NH3)2]Cl → СuC ≡ CCu + 2NH4Cl
4. В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность:
Например , при взаимодействии с угарным газом, более активными металлами или водородом оксид меди (II) проявляет свойства окислителя :
Cu2O + CO = 2Cu + CO2
А под действием окислителей, например, кислорода — свойства восстановителя :
Гидроксид меди (II)
Способы получения гидроксида меди (II)
1. Гидроксид меди (II) можно получить действием раствора щелочи на соли меди (II).
Например , хлорид меди (II) реагирует с водным раствором гидроксида натрия с образованием гидроксида меди (II) и хлорида натрия:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Химические свойства
Гидроксид меди (II) Сu(OН)2 проявляет слабо выраженные амфотерные свойства (с преобладанием основных ).
1. Взаимодействует с кислотами .
Например , взаимодействует с бромоводородной кислотой с образованием бромида меди (II) и воды:
2. Гидроксид меди (II) легко взаимодействует с раствором аммиака , образуя сине-фиолетовое комплексное соединение:
3. При взаимодействии гидроксида меди (II) с концентрированными (более 40%) растворами щелочей образуется комплексное соединение:
Но этой реакции в ЕГЭ по химии пока нет!
4. При нагревании гидроксид меди (II) разлагается :
Соли меди
Соли меди (I)
В окислительно-восстановительных реакциях соединения меди (I) проявляют окислительно-восстановительную двойственность . Как восстановители они реагируют с окислителями.
Например , хлорид меди (I) окисляется концентрированной азотной кислотой :
Также хлорид меди (I) реагирует с хлором :
2CuCl + Cl2 = 2CuCl2
Хлорид меди (I) окисляется кислородом в присутствии соляной кислоты:
4CuCl + O2 + 4HCl = 4CuCl2 + 2H2O
Прочие галогениды меди (I) также легко окисляются другими сильными окислителями:
Иодид меди (I) реагирует с концентрированной серной кислотой :
Сульфид меди (I) реагирует с азотной кислотой. При этом образуются различные продукты окисления серы на холоде и при нагревании:
Для соединений меди (I) возможна реакция диспропорционирования :
2CuCl = Cu + CuCl2
Комплексные соединения типа [Cu(NH3)2] + получают растворением в концентрированном растворе аммиака :
Соли меди (II)
В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства.
Например , соли меди (II) окисляют иодиды и сульфиты :
2CuCl2 + 4KI = 2CuI + I2 + 4KCl
Бромиды и иодиды меди (II) можно окислить перманганатом калия :
Соли меди (II) также окисляют сульфиты :
Более активные металлы вытесняют медь из солей.
Например , сульфат меди (II) реагирует с железом :
CuSO4 + Fe = FeSO4 + Cu
Сульфид меди (II) можно окислить концентрированной азотной кислотой . При нагревании возможно образование сульфата меди (II):
Еще одна форма этой реакции:
CuS + 10HNO 3( конц .) = Cu(NO 3 ) 2 + H 2 SO 4 + 8NO 2 ↑ + 4H 2 O
При горении сульфида меди (II) образуется оксид меди (II) и диоксид серы:
2CuS + 3O2 2CuO + 2SO2↑
Соли меди (II) вступают в обменные реакции, как и все соли.
Например , растворимые соли меди (II) реагируют с сульфидами:
CuBr2 + Na2S = CuS↓ + 2NaBr
При взаимодействии солей меди (II) с щелочами образуется голубой осадок гидроксида меди (II):
CuSO 4 + 2NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
Электролиз раствора нитрата меди (II):
Некоторые соли меди при нагревании разлагаются , например , нитрат меди (II):
Основный карбонат меди разлагается на оксид меди (II), углекислый газ и воду:
При взаимодействии солей меди (II) с избытком аммиака образуются аммиачные комплексы:
При смешивании растворов солей меди (II) и карбонатов происходит гидролиз и по катиону слабого основания, и по аниону слабой кислоты:
Видео:Опыты по химии. Электрохимическая коррозия на примере меди и железаСкачать

Медь и соединения меди
1) Через раствор хлорида меди (II) с помощью графитовых электродов пропускали постоянный электрический ток. Выделившийся на катоде продукт электролиза растворили в концентрированной азотной кислоте. Образовавшийся при этом газ собрали и пропустили через раствор гидроксида натрия. Выделившийся на аноде газообразный продукт электролиза пропустили через горячий раствор гидроксида натрия. Напишите уравнения описанных реакций.
2) Вещество, полученное на катоде при электролизе расплава хлорида меди (II), реагирует с серой. Полученный продукт обработали концентрированной азотной кислотой, и выделившийся газ пропустили через раствор гидроксида бария. Напишите уравнения описанных реакций.
3) Неизвестная соль бесцветна и окрашивает пламя в желтый цвет. При легком нагревании этой соли с концентрированной серной кислотой отгоняется жидкость, в которой растворяется медь; последнее превращение сопровождается выделением бурого газа и образованием соли меди. При термическом распаде обеих солей одним из продуктов разложения является кислород. Напишите уравнения описанных реакций.
4) При взаимодействии раствора соли А со щелочью было получено студенистое нерастворимое в воде вещество голубого цвета, которое растворили в бесцветной жидкости Б с образованием раствора синего цвета. Твердый продукт, оставшийся после осторожного выпаривания раствора, прокалили; при этом выделились два газа, один из которых бурого цвета, а второй входит в состав атмосферного воздуха, и осталось твердое вещество черного цвета, которое растворяется в жидкости Б с образованием вещества А. Напишите уравнения описанных реакций.
5) Медную стружку растворили в разбавленной азотной кислоте, и раствор нейтрализовали едким кали. Выделившееся вещество голубого цвета отделили, прокалили (цвет вещества изменился на черный), смешали с коксом и повторно прокалили. Напишите уравнения описанных реакций.
6) В раствор нитрата ртути (II) добавили медную стружку. После окончания реакции раствор профильтровали, и фильтрат по каплям прибавляли к раствору, содержащему едкий натр и гидроксид аммония. При этом наблюдали кратковременное образование осадка, который растворился с образованием раствора ярко-синего цвета. При добавлении в полученный раствор избытка раствора серной кислоты происходило изменение цвета. Напишите уравнения описанных реакций.
7) Оксид меди (I) обработали концентрированной азотной кислотой, раствор осторожно выпарили и твердый остаток прокалили. Газообразные продукты реакции пропустили через большое количество воды и в образовавшийся раствор добавили магниевую стружку, в результате выделился газ, используемый в медицине. Напишите уравнения описанных реакций.
8) Твердое вещество, образующееся при нагревании малахита, нагрели в атмосфере водорода. Продукт реакции обработали концентрированной серной кислотой, внесли в раствор хлорида натрия, содержащий медные опилки, в результате образовался осадок. Напишите уравнения описанных реакций.
9) Соль, полученную при растворении меди в разбавленной азотной кислоте, подвергли электролизу, используя графитовые электроды. Вещество, выделившееся на аноде, ввели во взаимодействие с натрием, а полученный продукт реакции поместили в сосуд с углекислым газом. Напишите уравнения описанных реакций.
10) Твердый продукт термического разложения малахита растворили при нагревании в концентрированной азотной кислоте. Раствор осторожно выпарили, и твердый остаток прокалили, получив вещество черного цвета, которое нагрели в избытке аммиака (газ). Напишите уравнения описанных реакций.
11) К порошкообразному веществу черного цвета добавили раствор разбавленной серной кислоты и нагрели. В полученный раствор голубого цвета приливали раствор едкого натра до прекращения выделения осадка. Осадок отфильтровали и нагрели. Продукт реакции нагревали в атмосфере водорода, в результате чего получилось вещество красного цвета. Напишите уравнения описанных реакций.
12) Неизвестное вещество красного цвета нагрели в хлоре, и продукт реакции растворили в воде. В полученный раствор добавили щелочь, выпавший осадок голубого цвета отфильтровали и прокалили. При нагревании продукта прокаливании, который имеет черный цвет, с коксом было получено исходное вещество красного цвета. Напишите уравнения описанных реакций.
13) Раствор, полученный при взаимодействии меди с концентрированной азотной кислотой, выпарили и осадок прокалили. Газообразные продукты полностью поглощены водой, а над твердым остатком пропустили водород. Напишите уравнения описанных реакций.
14) Черный порошок, который образовался при сжигании металла красного цвета в избытке воздуха, растворили в 10%-серной кислоте. В полученный раствор добавили щелочь, и выпавший осадок голубого цвета отделили и растворили в избытке раствора аммиака. Напишите уравнения описанных реакций.
15) Вещество черного цвета получили, прокаливая осадок, который образуется при взаимодействии гидроксида натрия и сульфата меди (II). При нагревании этого вещества с углем получают металл красного цвета, который растворяется в концентрированной серной кислоте. Напишите уравнения описанных реакций.
16) Металлическую медь обработали при нагревании йодом. Полученный продукт растворили в концентрированной серной кислоте при нагревании. Образовавшийся раствор обработали раствором гидроксидом калия. Выпавший осадок прокалили. Напишите уравнения описанных реакций.
17) К раствору хлорида меди (II) добавили избыток раствора соды. Выпавший осадок прокалили, а полученный продукт нагрели в атмосфере водорода. Полученный порошок растворили в разбавленной азотной кислоте. Напишите уравнения описанных реакций.
18) Медь растворили в разбавленной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали серной кислотой до появления характерной голубой окраски солей меди. Напишите уравнения описанных реакций.
19) Медь растворили в концентрированной азотной кислоте. К полученному раствору добавили избыток раствора аммиака, наблюдая сначала образование осадка, а затем – его полное растворение с образованием темно-синего раствора. Полученный раствор обработали избытком соляной кислоты. Напишите уравнения описанных реакций.
20) Газ, полученный при взаимодействии железных опилок с раствором соляной кислоты, пропустили над нагретым оксидом меди (II) до полного восстановления металла. полученный металл растворили в концентрированной азотной кислоте. Образовавшийся раствор подвергли электролизу с инертными электродами. Напишите уравнения описанных реакций.
21) Йод поместили в пробирку с концентрированной горячей азотной кислотой. Выделившийся газ пропустили через воду в присутствии кислорода. В полученный раствор добавили гидроксид меди (II). Образовавшийся раствор выпарили и сухой твердый остаток прокалили. Напишите уравнения описанных реакций.
22) Оранжевый оксид меди поместили в концентрированную серную кислоту и нагрели. К полученному голубому раствору прилили избыток раствора гидроксида калия. выпавший синий осадок отфильтровали, просушили и прокалили. Полученное при этом твердое черное вещество в стеклянную трубку, нагрели и пропустили над ним аммиак. Напишите уравнения описанных реакций.
23) Оксид меди (II) обработали раствором серной кислоты. При электролизе образующегося раствора на инертном аноде выделяется газ. Газ смешали с оксидом азота (IV) и поглотили с водой. К разбавленному раствору полученной кислоты добавили магний, в результате чего в растворе образовалось две соли, а выделение газообразного продукта не происходило. Напишите уравнения описанных реакций.
24) Оксид меди (II) нагрели в токе угарного газа. Полученное вещество сожгли в атмосфере хлора. Продукт реакции растворили в в воде. Полученный раствор разделили на две части. К одной части добавили раствор иодида калия, ко второй – раствор нитрата серебра. И в том, и в другом случае наблюдали образование осадка. Напишите уравнения описанных реакций.
25) Нитрат меди (II) прокалили, образовавшееся твердое вещество растворили в разбавленной серной кислоте. Раствор полученной соли подвергли электролизу. Выделившееся на катоде вещество растворили в концентрированной азотной кислоте. Растворение протекает с выделением бурого газа. Напишите уравнения описанных реакций.
26) Щавелевую кислоту нагрели с небольшим количеством концентрированной серной кислоты. Выделившийся газ пропустили через раствор гидроксида кальция. В котором выпал осадок. Часть газа не поглотилась, его пропустили над твердым веществом черного цвета, полученным при прокаливании нитрата меди (II). В результате образовалось твердое вещество темно-красного цвета. Напишите уравнения описанных реакций.
27) Концентрированная серная кислота прореагировала с медью. Выделившийся при газ полностью поглотили избытком раствора гидроксида калия. Продукт окисления меди смешали с расчетным количеством гидроксида натрия до прекращения выпадения осадка. Последний растворили в избытке соляной кислоты. Напишите уравнения описанных реакций.
🔍 Видео
Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Коррозия металла. Химия – ПростоСкачать

Электрохимическая коррозия (алюминий — медь)Скачать

Опыт 1. Электрохимическая коррозия в кислой средеСкачать

Коррозия металловСкачать

Получаем йод из спиртовой настойки (химия)Скачать

ПОЛУЧЕНИЕ ОГНЯ ИЗ ЙОДА И АЛЮМИНИЯСкачать

Йод и всё что вы хотели знать про него. Химия – просто.Скачать

Химическая коррозия. Газовая коррозияСкачать

Получение ЙОДА ТРЕМЯ способами!Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Как отмыть йод / зелёнку? Химия – ПростоСкачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

Регенерация йода и йодида натрия из отработаных в аффинаже золота йодид-йодатных растворовСкачать

Опыт: электрохимическая коррозияСкачать

Коррозия металлов и способы защиты от нееСкачать







