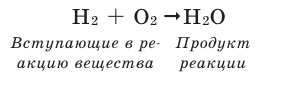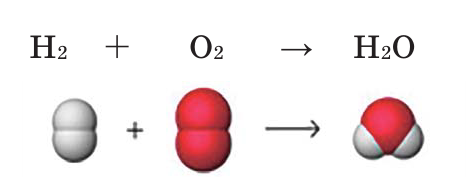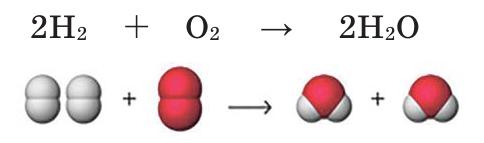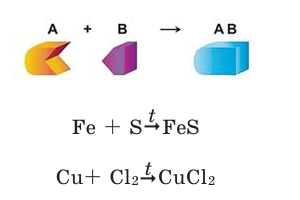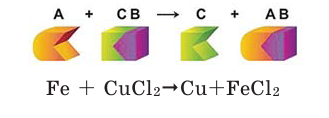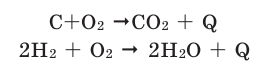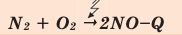Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
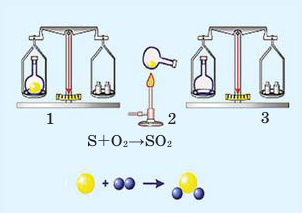
Схематически реакцию можно записать так: вещество + О 2 → оксиды + энергия.(2)

По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.(3)
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца 3О 2 + УФ свет → 2О 3
А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О 3 .
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.(4)
- Физические и химические явления в химии — формулы и определения с примерами
- Значение физических и химических явлений
- Химические уравнения. Знаки сохранения массы веществ
- Типы химических реакций
- Реакции соединения
- Реакции разложения
- Реакции замещения
- Реакции обмена
- Тепловой эффект химических реакций
- Уравнение химических реакций в природе
- Условия возникновения химических реакций
- Значение физических и химических явлений
- 💥 Видео
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Физические и химические явления в химии — формулы и определения с примерами
Содержание:
Физические и химические явления:
Сравните картинки. В результате какого явления гвозди ржавеют, черешня сгнивает, а вода превращается из жидкого состояния в твёрдое или газообразное состояния. Чем отличаются эти явления друг от друга? Как это можно объяснить? Какие признаки имеют химические реакции?
Каждому из нас в повседневной жизни доводилось наблюдать, как нагретая вода, превратившись в пар, «исчезает» (переходит в состояние невидимого газа), и как этот пар при соприкосновении с холодной поверхностью предмета вновь превращается в капельки воды. Точно так же все видели превращение воды в лед в выставленной наружу в холодный морозный день посуде и обратный переход его в жидкое состояние при внесении в помещение. Образуется ли новое вещество при этих превращениях?
Возьмите две миски небольшой ёмкости. В одной из мисок смешайте небольшое количество соли с водой, а в другой — сахара с водой и поставьте на слабый огонь. Что вы наблюдаете? Запишите свои мысли в тетради.
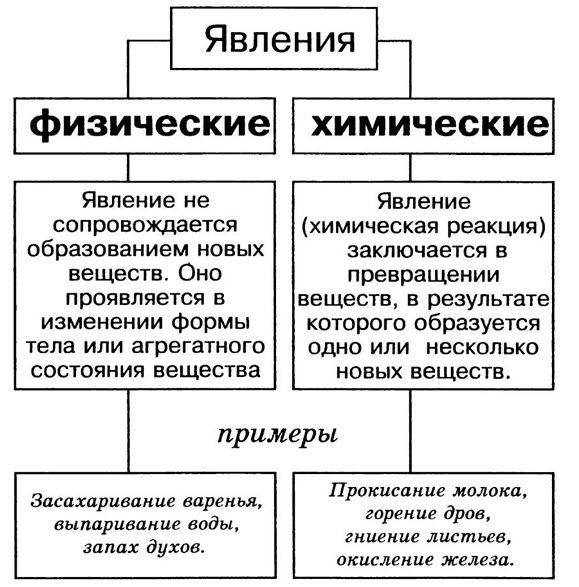
Из курса физики нам известно, что все происходящие в природе изменения называются явлением. Например, выпадение дождя, восход солнца, удар грома, землетрясение, таяние ледников и др. (рис.1).
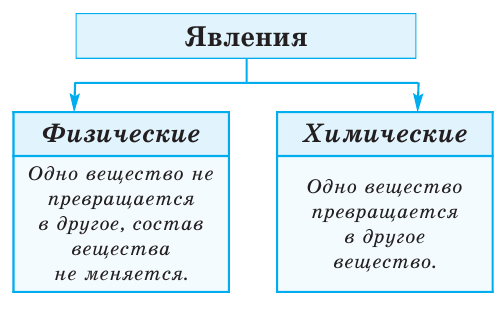
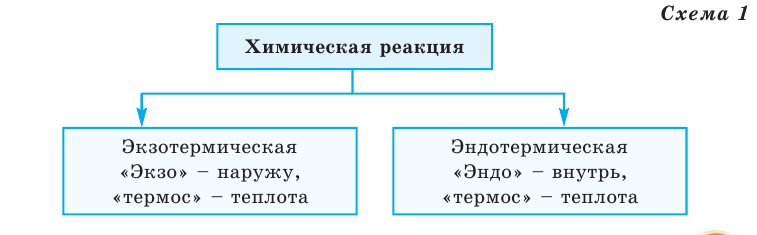
Все происходящие в природе явления делятся на 2 группы (схема 1)
Схема 1
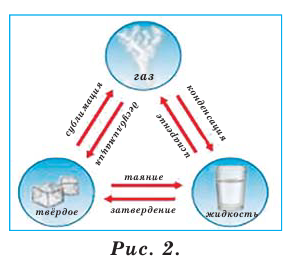
Во время физических явлений изменяются лишь агрегатное состояние, форма, размеры, объём, давление, температура и скорочть движения вещества (рис.2). Например, замерзание воды, таяние льда, кипение воды и др.
1. Нагрейте медную проволку. 2. В отстоявшуюся известковую воду с помощью трубочки вдуньте воздух или же добавьте немного раствора соды. 3. Подожгите кусочек серы размером с горошину. Что вы наблюдаете в каждом случае?
Во время химических явлений из исходного вещества образуются новые вещества. Например, такие химические явления, как горение, брожение, гниение, электролиз, разложение на составные части, ржавление (коррозия) и др. называют химическими реакциями.
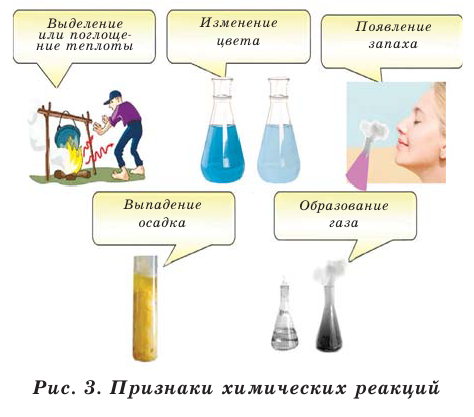
Химические реакции имеют несколько признаков. Эти признаки показывают протекание химических реакций (рис. 3).
Химические явления всегда сопровождаются физическими явлениями. Например, при горении природного газа, наряду с образованием углекислого газа и воды (химическое явление), также выделяются свет и теплота (физическое явление).
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Значение физических и химических явлений
Из курса «Познание мира» вам известно, какое значение имеют физические явления, происходящие вокруг нас. Так, например, испарение воды, конденсация водяных паров и выпадение дождя составляют круговорот воды в природе. В промышленном производстве, придавая металлам, пластмассам и другим материалам определенную форму (штамповка, прокатка), получают разнообразные предметы.
Химические реакции имеют огромное значение. Ими пользуются для получения различных металлов (железа, алюминия, меди, цинка, свинца, олова и др.), а также пластмасс, минеральных удобрений, лекарственных препаратов и т.д. Выделяемая при сгорании топлива энергия используется в быту и в промышленности.
Условия начала и хода химических реакций бывают разными. Для протекания ряда реакций (например, реакций горения) достаточно соприкосновения (трения) частиц веществ и подогревания до определенной температуры. Доведение реакции до конца обеспечивается за счет выделяемой тепловой энергии.
Некоторые же реакции (например, разложение воды на кислород и водород) требуют подачи дополнительной энергии до конца.
В природе физические и химические явления (реакции) протекают непрерывно, постоянно, обеспечивая этим циркуляцию веществ, климатические изменения, условия жизни для живых организмов.
Химические уравнения. Знаки сохранения массы веществ
Смочите в пробирке около 2-х г хлорида натрия небольшим количеством воды. Влив в пробирку до четверти её объёма концентрированной серной кислоты, закройте её горлышко пробкой, через которую проходит газоотводная трубка. При этом кислота должна быть концентрированной, а соль — в виде кристаллов. Пробирку с содержащимися в ней солью и серной кислотой слегка подогрейте. Что вы наблюдаете? Происходят ли изменения в массах веществ в результате реакции? Запишите уравнение реакции.
Происходящие в природе химические превращения в письменном виде выражают посредством химических уравнений. Условная запись химической реакции посредством формул, знаков и коэффициентов называется химическим уравнением.
Химическое уравнение составляется на основе нижеприведённых правил:
- Записываются химические формулы веществ, вступающих в реакцию.
- Если число вступающих в реакцию веществ два и больше, между ними ставится знак « + ».
- Затем ставится знак
- После знака стрелки записываются химические формулы полученных веществ.
- При получении двух и более продуктов между ними ставится знак
Например, составим уравнение реакции горения водорода в кислороде:
Здесь количество атомов в правой и левой частях неодинаковое. Такую запись называют схемой реакции. Для того, чтобы превратить данную схему в уравнение, следует уравнять число атомов в левой и правой частях уравнения.
Уравнивание количества атомов элементов в правой и левой частях уравнения называют коэффицированием уравнения. Определим число атомов элементов, входящих в состав веществ в реакции образования воды.
Если обратим внимание на реакцию, то увидим, что количество атомов водорода в обеих частях одинаковое. А количество атомов кислорода в правой части на единицу меньше количества атомов кислорода в левой части. Вследствие этого, вначале уравним число атомов кислорода. Для этого число атомов в правой части реакции умножается на 2, и на основе этого определяется коэффициент веществ на левой стороне.
В результате количество атомов водорода и кислорода в левой и правой частях уравнивается и получается уравнение химической реакции. 2 молекулы водорода, вступая в реакцию с 1 молекулой кислорода, образуют 2 молекулы воды.
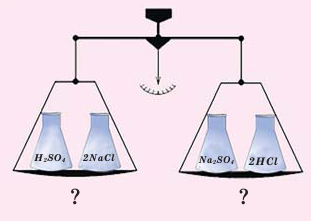
Впервые в 1748-ом году знаменитым русским учёным М.В.Ломоносовым, и независимо от него, в 1789-ом году французским учёным А.Лавуазье был открыт закон о том, что во время химических реакций сумма масс, вступающих в реакцию веществ, равна сумме масс, полученных в результате реакции веществ.
Закон сохранения массы веществ выражается следующим образом: Сумма масс веществ, вступивших в химическую реакцию, равна сумме масс веществ, полученных в результате реакции.
В колбу насыпают небольшое количество серы, после этого её закупоривают пробкой и взвешивают на весах (1). Затем колбу вместе с серой осторожно нагревают (2). На основе появления в колбе дыма, состоящего из частиц оксида серы (IV), можно определить протекание химической реакции.
При повторном взвешивании обнаруживается, что в результате реакции масса вещества осталась неизменной (3).
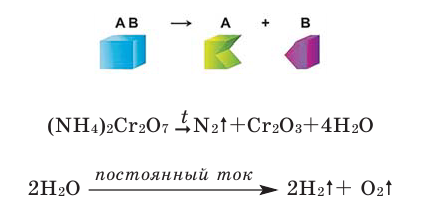
Типы химических реакций
Поместите в керамический тигель немного бихромата аммония 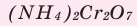
Что вы видите? Изложите свои соображения относительно происходящего процесса и запишите уравнение реакции. Почему эту реакцию называют «химическим вулканом»?
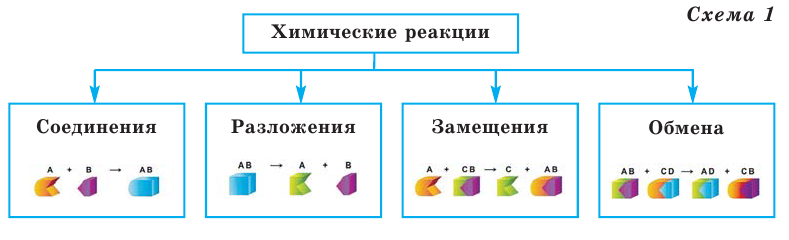
Химические реакции классифицируются по различным признакам. По количеству веществ, вступивших в реакцию и полученных в результате реакции, химические реакции подразделяются на 4 типа (схема 1):
Реакции соединения
Реакции, при которых из двух и более простых или сложных веществ получают одно сложное вещество, называют реакциями соединения.
Для протекания химических реакций иногда требуется нагревание. В таком случае в уравнениях реакций над стрелкой ставится
знак t.
Реакции разложения
Реакции, при которых из одного сложного вещества получают два и более простых или сложных веществ, называют реакциями разложения.
Если во время реакции выделяется газ, в таком случае, рядом с её химической формулой проставляется стрелка, направленная вверх
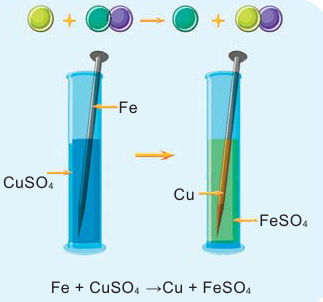
Реакции замещения
Если в реакциях, протекающих между простым и сложным веществом, атомы одного из элементов сложного вещества замещаются атомами простого вещества, то такие реакции называются реакциями замещения.
Опустите в раствор сульфата меди (II) 
Если во время реакции выпадает осадок, в таком случае, рядом с химической формулой полученного вещества проставляется стрелка, направленная вниз
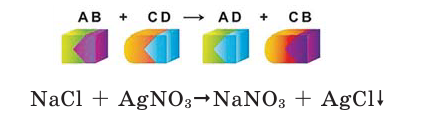
Реакции обмена
Если в реакциях, протекающих между двумя сложными веществами, составные части сложных веществ, меняясь местами, образуют новые сложные вещества, то такие реакции называются реакциями обмена.
Тепловой эффект химических реакций
Наблюдаете ли вы за тем, какие изменения происходят в вашем организме во время занятий спортом, приготовления уроков и приёма пищи? Как в это время изменяется ваша энергия?
В жизни мы постоянно принимаем пищу, а также занимаемся определённой деятельностью (умственной и физической). Вначале мы, приняв пищу, увеличиваем свою энергию, а занимаясь различной деятельностью, тратим ту энергию, которую получили благодаря приёму пищи (т.е. наша энергия уменьшается), и в результате мы чувствуем себя усталыми и утомлёнными. Как и человек, каждое химическое вещество обладает определённым запасом энергии. Химические реакции веществ сопровождаются выделением или поглощением теплоты.
Количество выделяемой или поглощаемой в ходе химической реакции теплоты называется тепловым эффектом.
Тепловой эффект обозначается буквой Q, а единица его измерения — кДж. В зависимости от выделения или поглощения теплоты химические реакции делятся на 2 группы (схема 1)
Химические реакции, протекающие с выделением теплоты, называются экзотермическими реакциями. В уравнениях экзотермических реакций выделяемая теплота (Q) указывается в правой стороне реакции знаком «+» (Q>0).
Все реакции горения — экзотермические. Реакция между азотом и кислородом — эндотермическая. (Это не реакция горения).
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими реакциями. В уравнениях эндотермических реакций поглощённая теплота указывается в правой стороне реакции знаком «— ». То есть Q
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Уравнение химических реакций в природе
Ключевые слова конспекта: Физические явления, химические явления, химические реакции, признаки химических реакций, значение физических и химических явлений.
Физические явления — это явления, при которых обычно изменяется только агрегатное состояние веществ. Примеры физических явлений — плавление стекла, испарение или замерзание воды.
Химические явления — это явления, в результате которых из данных веществ образуются другие вещества. При химических явлениях исходные вещества превращаются в другие вещества, обладающие другими свойствами. Примеры химических явлений — сгорание топлива, гниение органических веществ, ржавление железа, скисание молока.
Химические явления иначе называют химическими реакциями.
Условия возникновения химических реакций
О том, что при химических реакциях одни вещества превращаются в другие, можно судить по внешним признакам: выделению теплоты (иногда света), изменению окраски, появлению запаха, образованию осадка, выделению газа.
Для начала многих химических реакций необходимо привести в тесное соприкосновение реагирующие вещества. Для этого их измельчают и перемешивают; площадь соприкосновения реагирующих веществ при этом увеличивается. Наиболее тонкое дробление веществ происходит при их растворении, поэтому многие реакции проводят в растворах.
Измельчение и перемешивание веществ — только одно из условий возникновения химической реакции. Например. при соприкосновении древесных опилок с воздухом при обычной температуре опилки не загораются. Для того чтобы началась химическая реакция, во многих случаях необходимо нагревание веществ до определённой температуры.
Следует различать понятия «условия возникновения» и «условия течения химических реакций». Так, например, чтобы началось горение, нагревание нужно только вначале, а затем реакция протекает с выделением теплоты и света, и дальнейшее нагревание не требуется. А в случае разложения воды приток электрической энергии необходим не только для начала реакции, но и для дальнейшего её протекания.
Важнейшие условия возникновения химических реакций — это:
- тщательное измельчение и перемешивание веществ;
- предварительное нагревание веществ до определённой температуры.
Значение физических и химических явлений
Большое значение имеют химические реакции. Они используются для получения металлов, пластмасс, минеральных удобрений, медикаментов и т. д., а также служат источником различных видов энергии. Так, при сгорании топлива выделяется теплота, которую используют в быту и в промышленности.
Все процессы жизнедеятельности (дыхание, пищеварение, фотосинтез и др.), протекающие в живых организмах, также связаны с различными химическими превращениями. Например, химические превращения веществ, содержащихся в пище (белков, жиров, углеводов), протекают с выделением энергии, которая используется организмом для обеспечения процессов жизнедеятельности.
Конспект урока «Физические и химические явления ( химические реакции)».
💥 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Химические реакции в природе и жизнедеятельности живых организмов. 8 класс.Скачать

8 класс. Составление уравнений химических реакций.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Химические уравнения. Урок 15. Химия 7 классСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Химия. 8 класс. Химические реакции в жизнедеятельности живых организмов и человека /07.10.2020/Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Химические реакции в природеСкачать

Химия. 8 класс. Химические реакции в природе /02.10.2020/Скачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

ЧТО ТАКОЕ уравнение химической реакции? Все намного проще чем ты думал! #shorts #yotubeshortsСкачать

Тема 11. Закон сохран. массы вещ. Уравн. хим. реакции. Роль хим. реакций в природе и деятельн. чел.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать