Процесс горения характеризуется быстрым протеканием реакций окисления горючих компонентов топлива кислородом воздуха, при котором имеет место значительное тепловыделение и создается высокий уровень температуры. Реакции с выделением теплоты называются экзотермическими. Преимущественное тепловыделение при горении топлив определяется содержанием в топливе углерода. Горение углерода в основном характеризуется протеканием трех химических реакций:
полное окисление углерода кислородом с образованием диоксида углерода
| С + О2 = СО2 + 409,1, МДж/моль; | 4.1 |
частичное окисление с выходом монооксида углерода
| 2С + О2 = 2СО + 2·123,3 МДж/моль; | 4.2 |
доокисление монооксида до диоксида в объеме около поверхности горения
| 2СО + О2 = 2СО2 + 2·285,8 МДж/моль. | 4.3 |
Реакции по уравнениям (4.1) и (4.2) являются гетерогенными, так как в реакции участвуют горючее и окислитель, находящиеся в разном фазовом состоянии: твердое горючее и газообразный окислитель-кислород. Реакция по уравнению (4.3) относится к гомогенной, так как здесь оба вещества, вступающие в реакцию, являются газообразными (возможны гомогенные реакции веществ в жидком состоянии).
В условиях высоких температур в ядре факела могут протекать реакции с поглощением теплоты, которые являются эндотермическими. К эндотермическим реакциям, например, относится реакция образования оксидов азота
| N2 + О2 = 2NO — 180 кДж/моль, | 4.4 |
или восстановление диоксида углерода на раскаленной поверхности углерода при недостатке кислорода
| С + СО2 = 2СО — 162,5 МДж/моль. | 4.5 |
Реакция является химически обратимой, если может идти как в прямом, так и в обратном направлении, однако внешние условия для протекания реакции в том или другом направлении могут существенно различаться. Так, реакция образования оксидов азота имеет место только в зоне высоких температур, а обратная реакция их разложения на газообразные кислород и азот протекает в земной атмосфере под действием солнечной радиации. При горении топлива в топочных камерах скорость прямого процесса окисления горючих кислородом несоизмеримо больше скорости обратного, поэтому химическое равновесие этих реакций смещено в сторону образования конечных продуктов, и в указанных условиях эти реакции можно считать необратимыми.
Однако всегда по мере роста концентрации продуктов в реакции и температуры в зоне горения находится в равновесии с конечными продуктами какое-то количество исходных веществ. Этот процесс связан с термической диссоциацией части образовавшихся продуктов сгорания. В топочных камерах при температуре горения выше 1600 °С подвергаются термической диссоциации в заметном количестве диоксид углерода СО2 и водяные пары Н2О
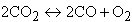 | |
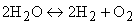 | 4.6 |
Таким образом, в зоне высоких температур горения всегда останется небольшое количество СО, Н2 и O2, догорание которых возможно при более низких температурах.
Интенсивность горения характеризуется скоростью реакции. Под скоростью гомогенной реакции понимается массовое количество вещества, реагирующее в единице объема и в единицу времени. Скорость реакции в этом случае измеряется по изменению концентрации одного из реагирующих веществ. Например, в реакции (4.3) средняя скорость реакции wр, моль/(м 3 ·с), за промежуток времени Δτ, с, имеет выражение
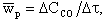 | 4.7 |
где ΔCCO — изменение концентрации СО в объеме, моль/м 3 .
Скорость гетерогенных реакций (4.1) и (4.2) КS, г/(м 2 ·с), выражается количеством углерода Δg, г, прореагировавшим с кислородом на единице поверхности контакта S, м 2 , в единицу времени Δτ, с:
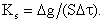 | 4.8 |
Скорости реакций подчиняются закону действующих масс, согласно которому в однородной среде при постоянной температуре в каждый момент времени скорость реакции пропорциональна произведению концентраций реагирующих веществ с учетом числа молей. Так, для уравнения (4.3) скорость реакции составит
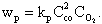 | 4.9 |
Здесь kР — константа скорости реакции, зависящая от температуры и химической природы реагирующих веществ.
В условиях гетерогенного горения концентрация горючего (твердого топлива) неизменна, поэтому скорость такой реакции на основе закона действующих масс будет зависеть только от концентрации окислителя (кислорода) у поверхности топлива
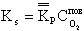 | 4.10 |
Здесь C ПОВ O2— концентрация кислорода у поверхности топлива. При неизменной концентрации реагирующих веществ во времени (постоянный подвод топлива и окислителя в зону горения) скорость реакции зависит от константы скорости реакции kР, 1/с, по закону Аррениуса
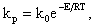 | 4.11 |
где k0 — предэкспоненциальный множитель, 1/с; Е — энергия активации, кДж/моль; R — универсальная газовая постоянная, кДж/(моль·К); Т — абсолютная температура процесса, К. Константа скорости реакции kр и энергия активации Е называются кинетическими константами реакции, которые определяют реакционные свойства топлива.
Химическая реакция может происходить при столкновении молекул, вступающих в реакцию веществ. Если бы все столкновения приводили к реакциям, то горение происходило бы с огромной скоростью и константа скорости равнялась бы k0. В действительности реакция может произойти только в том случае, когда за счет соударения произойдет разрушение старых молекулярных связей и образовавшиеся осколки молекул (заряженные радикалы) смогут перегруппироваться и создать молекулы новых веществ.
Энергия, достаточная для разрушения внутримолекулярных связей исходных веществ, называется энергией активации E. Так, при горении кокса по реакции (4.1) энергия активации зависит от вида кокса: для кокса бурого угля Е = 92…105 МДж/моль, для кокса каменных углей Е = 117…134 МДж/моль, для антрацита Е = 147 МДж/моль. В результате число молекул NE ,обладающих необходимым уровнем энергии Е, определяется статистическим законом Максвелла-Больцмана
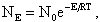 | 4.12 |
где N0 — полное число молекул в единице объема. Энергия активации зависит не только от энергии межатомных связей в молекулах, но и от того, в каком состоянии находятся вступающие в реакцию вещества. При высоких температурах в зоне реакции за счет диссоциации молекул с более слабыми внутренними связями накапливается определенное количество заряженных частиц (радикалов) типа ОН — , Н + , О 2- , которые легко вступают в промежуточные реакции с исходными молекулами (такие реакции имеют низкие значения Е) и способствуют ускорению реакций горения.
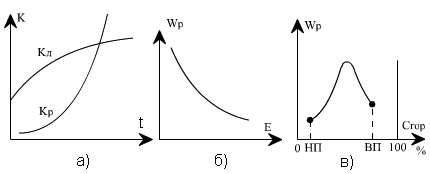
На рис. 4.1 показана зависимость константы скорости kР и скорости реакции wР от определяющих факторов. Рост скорости химической реакции с температурой на известном уровне тормозится аэродинамическим фактором — возможностью доставки в зону горения окислителя (кислорода), определяемым скоростью диффузионного массообмена kД, который слабо зависит от температуры (рис. 4.1, а). Повышение энергии активации требует больше энергетических затрат на каждый акт реакции, что ведет к торможению скорости (рис. 4.1, б).
Рис. 4.1. Кинетические характеристики процесса горения: а — зависимость константы реакции горения kр и диффузионного массообмена kд от температуры; б — изменение скорости реакции wр от энергии активации Е; в — изменение скорости реакции при повышении концентрации горючего вещества Сгор в смеси с воздухом; НП, ВП — нижний и верхний пределы концентрации, соответствующие горению
В топочных устройствах происходит постоянная подача топлива и окислителя в зону горения, и, следовательно, в ядре горения сохраняется практически постоянная концентрация реагирующих веществ во времени. В этих условиях максимальная скорость реакции может быть достигнута при соотношении концентраций исходных веществ, близком к стехиометрическому, когда в результате реакции не остается избытка любого из них (рис. 4.1, в). При избытке горючего (богатая смесь) или при малой его концентрации (бедная смесь) скорость реакции снижается из-за уменьшения тепловыделения на единицу объема. Как видно, существует нижний предел концентрации горючего (НП), ниже которого горение становится невозможным, и верхний предел (ВП), когда дальнейшее увеличение концентрации горючего в смеси также прекращает горение. Во всем диапазоне концентраций между этими пределами горение возможно.
При сгорании горючей смеси в замкнутом объеме и отсутствии отвода теплоты в процессе реакции тепловыделение передается продуктам сгорания и приводит к максимальному повышению их температуры.
Этим условиям отвечает понятие теоретической (адиабатной) температуры горения ТТЕОР =Та. Наивысшее ее значение достигается при подводе окислителя в строгом соответствии с химической формулой (при стехиометрическом соотношении горючего и окислителя). Эту температуру часто называют жаропроизводительностью топлива.
В топочных устройствах всегда имеет место отвод теплоты из зоны реакции к поверхностям нагрева. С повышением температуры в зоне основного горения увеличивается и отвод теплоты, далее по мере выгорания топлива тепловыделение снижается, а вместе с ним происходит спад температуры продуктов сгорания, так как теплоотвод сохраняется достаточно высоким (рис. 4.2).
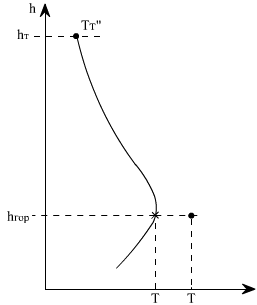 | Рис. 4.2. Изменение температуры газов по высоте топки hт: hгор — высота расположения горелок |
Температура смеси, начиная с которой система способна к самоускорению реакции до устойчивого горения, называется температурой воспламенения. Эта температура не является постоянной для реагирующих веществ и зависит от условий отвода теплоты из зоны реакции. Тепловыделение в ходе реакции горения топлива (при постоянной концентрации реагирующих веществ) определяется скоростью реакции в данных условиях и теплотой горения топлива
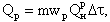 | 4.13 |
где mwР — скорость реакции по сгорающему топливу, кг/(м 3 ·с); Q Р Н -теплота горения топлива, кДж/кг.
Из (4.13) следует, что тепловыделение QР определяется только изменением скорости реакции wР. Скорость реакции, в свою очередь, зависит от константы диффузионного массообмена kД и константы химической реакции kР на поверхности топлива. При этом в области низких температур скорость реакции wР ограничивается константой kР, а в области высоких температур условиями массообмена у поверхности топлива константой kД. В итоге на графике кривая wР = f(T) имеет два перегиба (см. рис. 4.3).
Теплоотвод из зоны реакции в окружающую среду (к тепловоспринимающим поверхностям) выражается формулой
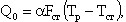 | 4.14 |
где α — коэффициент теплоотдачи, кВт/(м 2 ·К); FСТ — тепловоспринимающая поверхность, м 2 ; ТР, TСТ — температуры в зоне реакции и у поверхности стен, К.
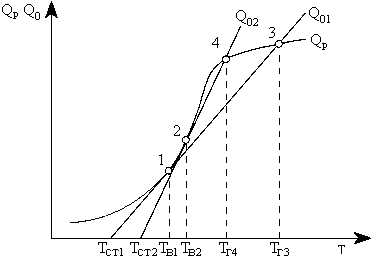 | Рис.4.3. Графическое определение температуры воспламенения ТВ, горения ТГ при разной интенсивности теплоотвода к стенам топки (Q02 > Q01): QР — тепловыделение в результате реакции горения; ТСТ — температура стен (экранов) топки. Из (4.14) следует, что при постоянстве условий отвода теплоты из зоны реакции (α = const) теплоотвод изменяется линейно в зависимости от разности температур TР — ТСТ. |
На рис.4.3 показан характер изменения значений QР и Q0 от температуры. Точка 1 касания кривой QР и линии теплоотвода Q0 соответствует температуре воспламенения ТВ, так как при любом отклонении от нее значение QР> Q0 и происходит саморазогрев горючей смеси и рост тепловыделения за счет реакций окисления. Точка пересечения 3 кривой QР и линии Q0 характеризует наивысшее устойчивое тепловыделение, а соответствующая температура — температура горения ТГ3. Как видно на рис. 4.3, чем интенсивнее теплоотвод из зоны горения (круче наклон линии отвода 2-4, выше ТСТ2, так как α2 > α1), тем выше температура воспламенения топлива ТВ2 и ниже температура горения ТГ4.
Дата добавления: 2015-02-28 ; просмотров: 931 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
- Напишите уравнение реакции горения угля. Почему уголь необходимо предварительно нагреть? На что указывает помутнение известковой воды,
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Л. р. 36. горение угля в кислороде
- Описание презентации по отдельным слайдам:
- Дистанционное обучение как современный формат преподавания
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- 🌟 Видео
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Напишите уравнение реакции горения угля. Почему уголь необходимо предварительно нагреть? На что указывает помутнение известковой воды,
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Ваш ответ
Видео:Уравнивание реакций горения углеводородовСкачать

решение вопроса
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Л. р. 36. горение угля в кислороде
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Описание презентации по отдельным слайдам:
Средняя общеобразовательная школа №2 Выполнил: учитель химии Ашурков Михаил Федорович Презентация по предмету: Химия на тему: Л. Р. №36 «Горение угля в кислороде» ®Ashurkov Mikle
Цели Исследовать горение древесного в кислороде.
Оборудование и реактивы: Спиртовка; Спички Ложечка для сжигания; Установка по получению кислорода; Перекись водорода; Оксид марганца (IV).
C + O2 = CO2 При внесении раскаленного угля в колбу с кислородом, появляется пламя, образуется оксид углерода (углекислый газ CO2): Чтобы определить в колбе углекислый газ, прильем гидроксид кальция (гашеная известь). Раствор мутнеет: Ca(OH)2 + CO2 = CaCO3 + H2O
Окислительно-восстановительные процессы O2 + 4e- = 2O2- 4 С0 — 4e- = С+4 4 4 4 – окислитель, восстанавливается 4 – восстановитель, окисляется
Вывод: В результате проведенной реакции с кислородом и древесным углем, образуется углекислый газ. Качественной реакцией на углекислый газ будет реакция с известковой водой.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 945 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 25 человек из 16 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 591 983 материала в базе
Материал подходит для УМК
«Химия», Габриелян О.С.
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 06.02.2018
- 1800
- 6
- 06.02.2018
- 696
- 1
- 03.02.2018
- 1006
- 1
- 27.01.2018
- 1872
- 6
- 19.01.2018
- 1240
- 7
- 15.01.2018
- 3790
- 75
- 28.12.2017
- 3004
- 86
- 25.12.2017
- 1669
- 2
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 06.02.2018 4753
- PPTX 279.6 кбайт
- 7 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Ашурков Михаил Федорович. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 года и 1 месяц
- Подписчики: 2
- Всего просмотров: 44578
- Всего материалов: 17
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Минпросвещения упростит процедуру подачи документов в детский сад
Время чтения: 1 минута
В Швеции запретят использовать мобильные телефоны на уроках
Время чтения: 1 минута
В Белгородской области отменяют занятия в школах и детсадах на границе с Украиной
Время чтения: 0 минут
В приграничных пунктах Брянской области на день приостановили занятия в школах
Время чтения: 0 минут
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Курские власти перевели на дистант школьников в районах на границе с Украиной
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
🌟 Видео
Горение. 7 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции горенияСкачать

Интересные факты про УгольСкачать

Горение угля в кислородеСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Реакция горения гептана. Как уравнять?Скачать

ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать