Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
- Обратимый гидролиз солей
- Необратимый гидролиз
- Факторы, влияющие на степень гидролиза:
- Гидролиз
- Определение гидролиза
- Условия гидролиза
- Индикаторы среды раствора
- Виды гидролиза
- Соль с сильным основанием и сильной кислотой
- Соль со слабым основанием и сильной кислотой
- Соль с сильным основанием и слабой кислотой
- Ступенчатый гидролиз
- Обратимый и необратимый гидролиз
- Степень гидролиза
- Вопросы для самопроверки:
- Необратимый гидролиз бинарных соединений.
- Общая информация по гидролизу бинарных соединений
- Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
- Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
- Гидролиз бинарных соединений действием растворов кислот и щелочей
- Кислотный гидролиз ионных бинарных соединений
- Щелочной гидролиз ковалентных бинарных соединений
- 📸 Видео
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
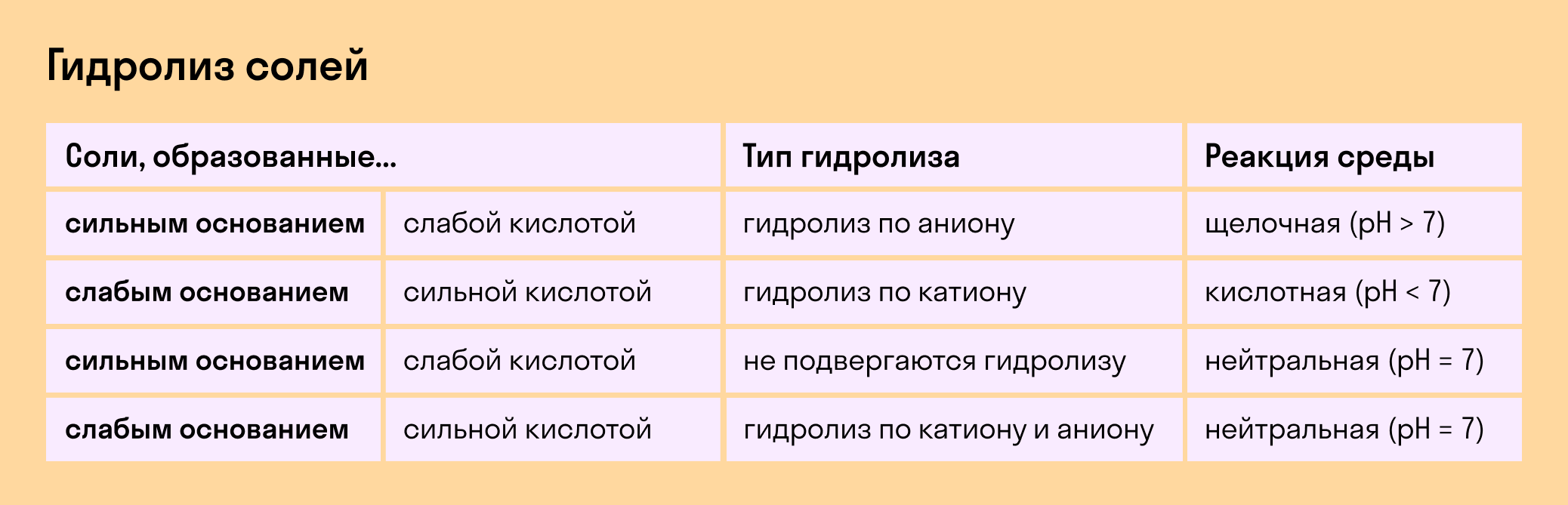
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
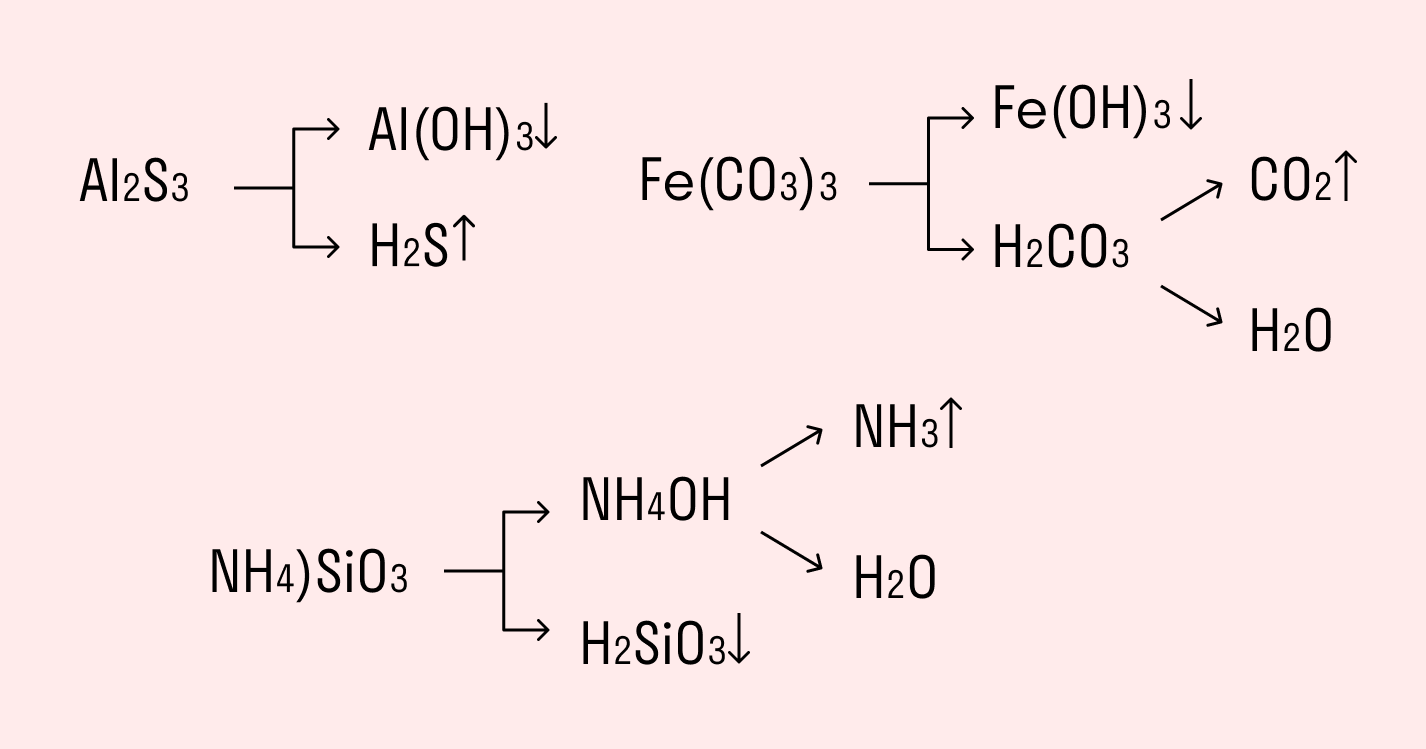
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Видео:Гидролиз солей. 9 класс.Скачать

Гидролиз
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Определение гидролиза
| Гидролиз — это процесс взаимодействия сложного химического вещества с водой, итогом которого становится разложение молекул этого вещества. Сам термин происходит от двух греческих слов: hydor, что значит «вода», и lysis, то есть «распад». |
Гидролизации подвержены как органические, так и неорганические вещества: углеводы, белки, оксиды, карбиды, соли и т. д. Например, гидролиз органических соединений напрямую связан с пищеварением — с его помощью происходит распад и усвоение клетками организма жиров, белков, углеводов. Но сейчас мы займемся неорганической химией и рассмотрим гидролизацию на примере солей.
| Гидролиз солей — это реакция взаимодействия ионов соли с Н + и ОН − ионами воды, которая ведет к распаду исходного соединения. В результате такого ионного обмена образуется слабый электролит — кислотный, щелочной или нейтральный. |
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Условия гидролиза
Далеко не все соединения распадаются, вступая в реакцию с молекулами воды. Сейчас мы на примере солей рассмотрим, какие вещества подвергаются гидролизу, а какие нет, и от чего это зависит.
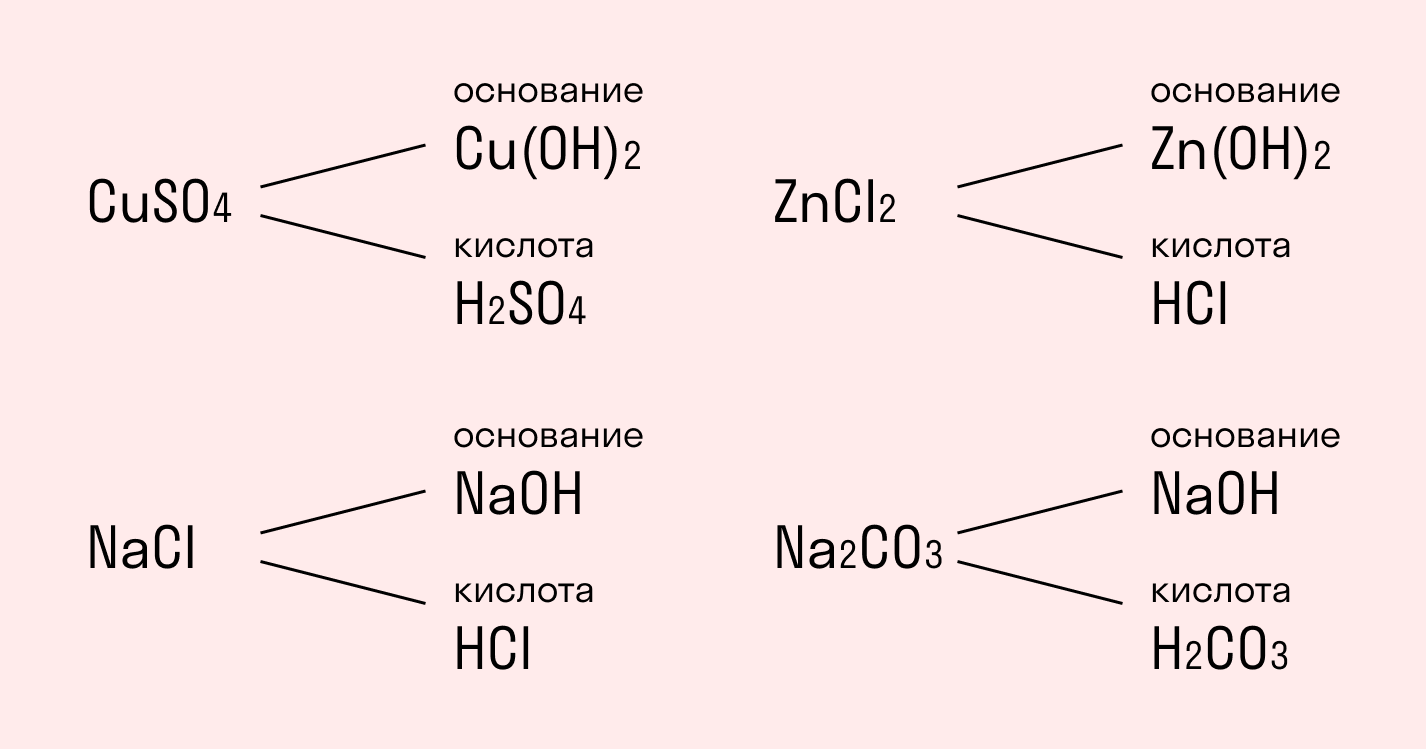
Начнем с того, что любая соль включает основание — амфотерный гидроксид, и кислотный остаток.
сульфат меди CuSO4состоит из основания Cu(ОН)2и кислоты H2SO4;
хлорид натрия NaCl состоит из основания NaOH и кислоты HCl;
хлорид цинка ZnCl2состоит из основания Zn(ОН)2 и кислоты HCI;
карбонат натрия Na2CO3состоит из основания NaOH и кислоты H2CO3.
В жизни первым разрушается самое слабое, и гидролиз в химии действует по тому же принципу. В ходе этой реакции распадаются более слабые соединения (основания или кислотные остатки). Слабый катион или слабый анион вступают во взаимодействие с ионами воды и связывают один из них или оба. В растворе образуется избыток ионов H + или гидроксильная группа OH − .
В зависимости от того, какие соли подвергаются гидролизу — со слабым основанием или слабой кислотой, в итоге может получиться кислая, щелочная или нейтральная среда водного раствора.
А что происходит, если соль состоит из сильного основания и сильного кислотного остатка? Ничего. 🙂 В этом случае ее сильные катионы и анионы не взаимодействуют с ионами воды. Такая соль не распадается, то есть не подвержена гидролизу.
Схема химической реакции гидролиза выглядит так:
XY + HOH ↔ XH + HOY
В данном случае:
XY — формула соли;
XH — кислотный остаток;
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

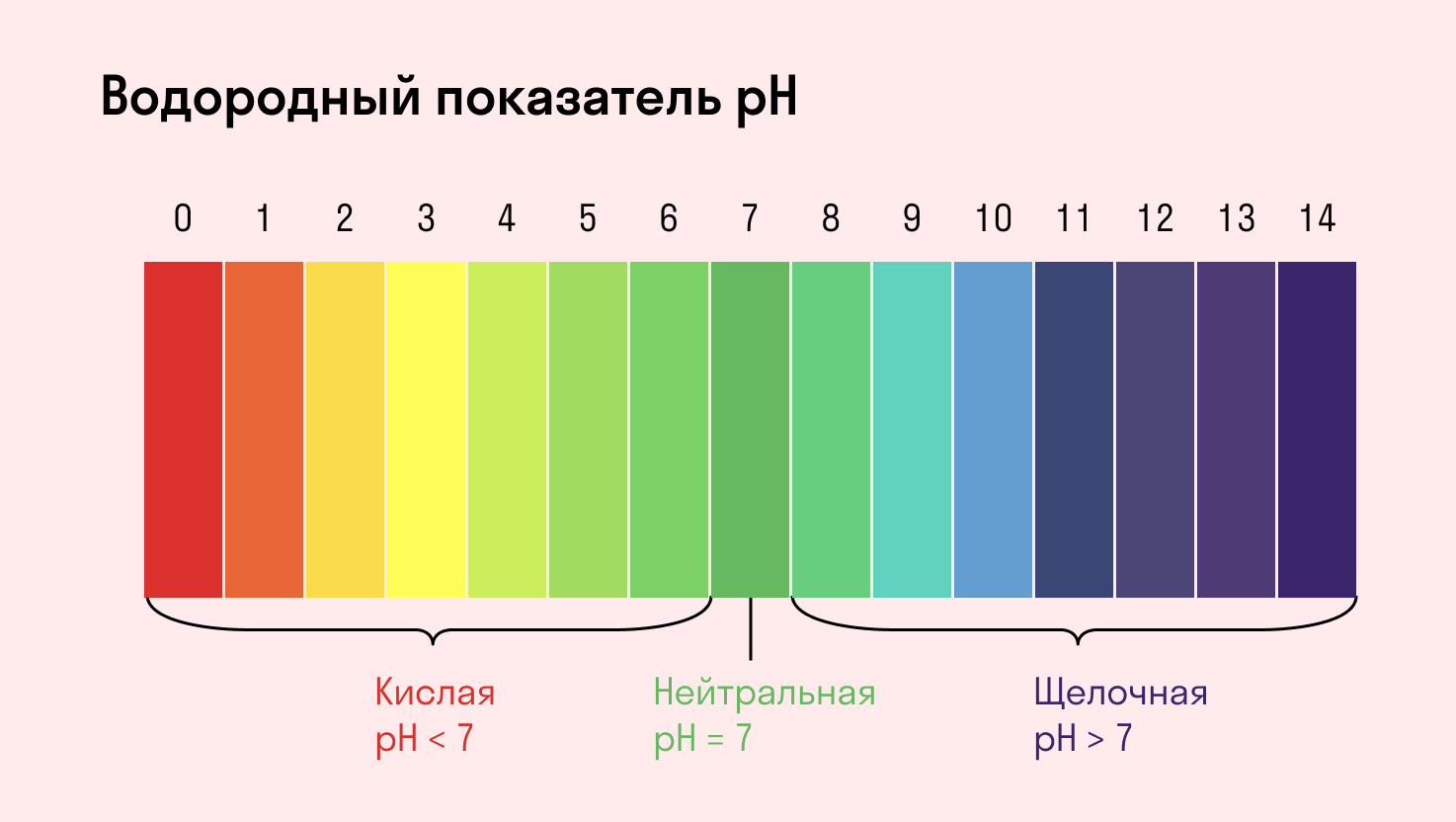
Индикаторы среды раствора
Для определения среды раствора за считанные секунды используются специальные индикаторы. Самый распространенный из них — лакмусовая бумага, но также популярны фенолфталеин и метиловый оранжевый. В нейтральной среде они не меняют свой цвет, а в кислотной или щелочной — приобретают другую окраску.
Изменение цвета индикатора однозначно говорит о том, что произошла гидролизация. Однако если цвет остался тем же — это не всегда означает отсутствие гидролиза. Среда будет почти нейтральной и в том случае, когда гидролизу подвергается соль со слабым основанием и слабой кислотой. Но об этом поговорим дальше, а пока посмотрите таблицу.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Виды гидролиза
Мы выяснили, что в составе соли может быть слабый ион, который и отвечает за гидролизацию. Он находится в основании, в кислотном остатке или в обоих компонентах, и от этого зависит тип гидролиза.
Соль с сильным основанием и сильной кислотой
Гидролиз отсутствует. Как вы уже знаете, при наличии сильного основания и сильного кислотного остатка соль не распадается при взаимодействии с водой. Так, например, невозможен гидролиз хлорида натрия (NaCl), поскольку в составе этого вещества нет слабых ионов. К таким же не подверженным гидролизации солям относят KClO4, Ba(NO3)2 и т. д.
Среда водного раствора — нейтральная, т. е. pH = 7.
Реакция индикаторов: не меняют свой цвет (лакмус остается фиолетовым, а фенолфталеин — бесцветным).
Соль со слабым основанием и сильной кислотой
Гидролиз по катиону. Как мы помним, гидролизация происходит только при наличии слабого иона, в данном случае — иона основания. Его катион вступает в реакцию и связывает гидроксид-ионы воды OH − . В итоге образуется раствор с избытком ионов водорода H + .
Среда водного раствора — кислая, pH меньше 7.
Реакция индикаторов: фенолфталеин остается бесцветным, лакмус и метиловый оранжевый — краснеют.
Нитрат аммония NH4NO3 состоит из слабого основания NH4OH и сильного кислотного остатка HNO3, поэтому он гидролизуется по катиону, то есть его катион NH4 + связывает ионы воды OH − .
Соль с сильным основанием и слабой кислотой
Гидролиз по аниону. Если слабым оказывается ион кислотного остатка, его отрицательно заряженная частица (анион) взаимодействует с катионом водорода H + в молекуле воды. В итоге получается раствор с повышенным содержанием OH − .
Среда водного раствора — щелочная, pH больше 7.
Реакция индикаторов: фенолфталеин становится малиновым, лакмус — синим, а метиловый оранжевый желтеет.
Нитрат калия KNO2 отличается сильным основанием KOH и слабым кислотным остатком HNO2, поэтому он гидролизуется по аниону. Другими словами, анион кислоты NO2 − связывает ионы воды H + .
Молекулярное уравнение: KNO2 + H2O ↔ HNO2 + KOH
Ионное уравнение: K + + NO2 − + HOH ↔ HNO2 + K + + OH −
Гидролиз по катиону и аниону. Если у соли оба компонента — слабые, при взаимодействии с водой в реакцию вступает и анион, и катион. При этом катион основания связывает ионы воды OH − а анион кислоты связывает ионы H +
Среда водного раствора: нейтральная, слабокислая или слабощелочная.
Реакция индикаторов: могут не изменить свой цвет.
Цианид аммония NH4CN включает слабое основание NH4OH и слабую кислоту HCN.
Молекулярное уравнение: NH4CN + H2O ↔ NH4OH + HCN
Ионное уравнение: NH4 + + CN − + HOH ↔ NH4OH + HCN
Среда в данном случае будет слабощелочной.
Обобщим все эти сведения в таблице гидролиза солей.
Ступенчатый гидролиз
Любой из видов гидролиза может проходить ступенчато. Так бывает в тех случаях, когда с водой взаимодействует соль с многозарядными катионами и анионами. Сколько ступеней будет включать процесс — зависит от числового заряда иона, отвечающего за гидролиз.
Как определить количество ступеней:
если соль содержит слабую многоосновную кислоту — число ступеней равняется основности этой кислоты;
если соль содержит слабое многокислотное основание — число ступеней определяют по кислотности основания.
Для примера рассмотрим гидролиз карбоната калия K2CO3. У нас есть двухосновная слабая кислота H2CO3, а значит, гидролизация пройдет по аниону в две ступени.
I ступень: K2CO3+HOH ↔ KOH+KHCO3, итогом которой стало получение гидроксида калия (KOH) и кислой соли (KHCO3).
II ступень: K2HCO3+HOH ↔ KOH+H2CO3, в итоге получился тот же гидроксид калия (KOH) и слабая угольная кислота (H2CO3).
Для приблизительных расчетов обычно принимают в учет только результаты первой ступени.
Видео:11 класс. Гидролиз солей.Скачать

Обратимый и необратимый гидролиз
Химические вещества могут гидролизоваться обратимо или необратимо. В первом случае распадается лишь некоторое количество частиц, а во втором — практически все. Если соль полностью разлагается водой, это необратимый процесс, и его называют полным гидролизом.
Необратимо гидролизуются соли, в составе которых есть слабые нерастворимые основания и слабые и/или летучие кислоты. Такие соединения могут существовать лишь в сухом виде, их не получить путем смешивания водных растворов других солей.
Например, полному гидролизу подвергается сульфид алюминия:
Как видите, в результате гидролизации образуется гидроксид алюминия и сероводород.
Необратимые реакции при взаимодействии с водой имеют место и в органической химии. В качестве примера рассмотрим полный гидролиз органического вещества — карбида кальция, в результате которого образуется ацетилен:
Степень гидролиза
Взаимодействие соли или другого химического соединения с водой может усиливаться или ослабляться в зависимости от нескольких факторов. Если нужно получить количественное выражение гидролиза, говорят о его степени, которая указывается в процентах.
h — степень гидролиза,
nгидр. — количество гидролизованного вещества,
nобщ. — общее количество растворенного в воде вещества.
На степень гидролизации может повлиять:
температура, при которой происходит процесс;
концентрация водного раствора;
состав участвующих в гидролизе веществ.
Можно усилить гидролиз с помощью воды (просто разбавить полученный раствор) или стимулировать процесс повышением температуры. Более сложным способом будет добавление в раствор такого вещества, которое могло бы связать один из продуктов гидролиза. К соли со слабой кислотой и сильным основанием нужно добавить соль со слабым основанием и сильной кислотой.
Для ослабления гидролиза раствор охлаждают и/или делают более концентрированным. Также можно изменить его состав: если гидролизация идет по катиону — добавляют кислоту, а если по аниону — щелочь.
Итак, мы разобрались, что такое гидролиз солей и каким он бывает. Пора проверить свои знания и ответить на вопросы по материалу.
Вопросы для самопроверки:
Назовите необходимое условие для гидролиза.
Какие типы гидролиза вы знаете?
В каком случае в результате гидролиза может образоваться слабощелочная или слабокислая среда?
По какому типу гидролизуется соль с сильным основанием и слабым кислотным остатком?
При гидролизе соли с сильным основанием и слабой кислотой для ослабления процесса нужно добавить в раствор кислоту или щелочь?
Как воздействует на гидролиз разбавление раствора водой?
Как определяется количество ступеней гидролиза?
Какая среда раствора образуется при гидролизации солей NaF, KCl, FeBr2, Na2PO4? Ответов может быть несколько.
Какие из солей гидролизуются по катиону: Csl, FeSO4, RbNO3, CuSO4, Mn(NO3)2? Ответов может быть несколько.
Какая из солей не подвергается гидролизу: K2HPO4, KNO3, KCN, Ni(NO3)2?
Видео:Всё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать

Необратимый гидролиз бинарных соединений.
Бинарные соединения – соединения, образованные двумя химическими элементами.
Бинарные соединения делят на ионные и ковалентные.
Ионными называют такие бинарные соединения, которые образованы атомами металла и неметалла.
Ковалентными называют бинарные соединения, образованные двумя неметаллами.
Видео:Гидролиз солей. Практическая часть. 10 класс.Скачать

Общая информация по гидролизу бинарных соединений
Многие бинарные соединения способны разлагаться под действием воды. Такая реакция бинарных соединений с водой называется необратимым гидролизом.
Необратимый гидролиз практически всегда протекает с сохранением степеней окисления всех элементов. В результате взаимодействия бинарных соединения с водой всегда:
✓ элемент в отрицательной степени окисления переходит в состав водородного соединения;
✓ элемент в положительной степени окисления переходит в состав соответствующего гидроксида.
Напомним, что гидроксид неметалла – это ни что иное, как соответствующая кислородсодержащая кислота. Так, например, гидроксид серы (VI) — это серная кислота H2SO4.
Так, например, попробуем записать уравнение необратимого гидролиза фосфида кальция Ca3P2, опираясь на информацию, представленную выше.
В фосфиде кальция мы имеем кальций в степени окисления «+2» и фосфор в степени окисления «-3». Как уже было сказано, в результате взаимодействия с водой должно образоваться водородное соединение элемента в отрицательной степени окисления (т.е. фосфора) и соответствующий гидроксид элемента в положительной степени окисления.
Также сказано, что в результате реакции гидролиза практически всегда сохраняются степени окисления элементов.
Это значит, что в образующемся водородном соединении фосфор будет иметь ту же степень окисления, что и в исходном фосфиде, т.е. «-3», исходя из чего легко записать формулу самого водородного соединения – PH3 (газ фосфин).
В то же время, кальций, как элемент в положительной степени окисления, должен перейти в состав соответствующего гидроксида с сохранением степени окисления «+2», т.е. в Ca(OH)2.
Таким образом, без расстановки коэффициентов реакция будет описываться следующей схемой:
Расставив коэффициенты получаем уравнение:
Используя аналогичный алгоритм, запишем уравнение гидролиза пентахлорида фосфора PCl5.
В данном соединении мы имеем фосфор в степени окисления «+5» и хлор в степени окисления «-1».
Очевидно, что водородным соединением хлора с хлором в степени окисления «-1» будет HCl.
В свою очередь, поскольку элемент в положительной степени окисления относится к неметаллам, его гидроксидом будет кислородсодержащая кислота с фосфором в той же степени окисления «+5».
При условии, что вы знаете формулы всех неорганических кислот, несложно догадаться, что данным гидроксидом является фосфорная кислота H3PO4.
Само уравнение при этом после расстановки коэффициентов будет иметь вид:
Как видите, если вам дали формулу бинарного соединения и попросили записать уравнения его гидролиза, то ничего сложного в этом нет.
Какие ионные бинарные соединения способны вступать в реакцию необратимого гидролиза?
Для успешной сдачи ЕГЭ нужно запомнить, что из ионных бинарных соединений в реакцию необратимого гидролиза водой вступают:
1) нитриды щелочных металов (ЩМ), щелочноземельных металлов (ЩЗМ) и магния:
2) фосфиды ЩМ, ЩЗМ и магния:
3) силициды ЩМ, ЩЗМ и магния:
4) карбиды ЩМ, ЩЗМ и магния. Знать нужно формулы только двух карбидов — Al4C3 и CaC2 и, соответственно, уметь записывать уравнения их гидролиза:
5) сульфиды алюминия и хрома:
6) гидриды ЩМ, ЩЗМ, Mg, Al:
Гидролиз гидридов металлов – редкий пример окислительно-восстановительного гидролиза. Фактически, в данной реакции объединяются ионы водорода H + и анионы водорода H — , в следствие чего образуются нейтральные молекулы H2 с водородом в степени окисления, равной 0.
Какие ковалентные бинарные соединения вступают в реакцию гидролиза?
Из ковалентных бинарных соединений, способных вступать в реакцию необратимого гидролиза, нужно знать про:
1) галогениды фосфора III и V.
2) галогениды кремния:
Видео:ЩЕЛОЧНОЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать
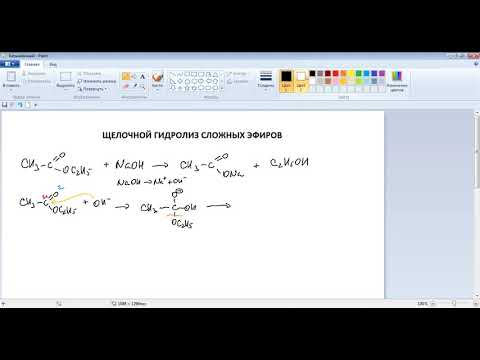
Гидролиз бинарных соединений действием растворов кислот и щелочей
Помимо обычного гидролиза водой существует также вариант гидролиза, при котором бинарное соединение обрабатывают водным раствором щелочи или кислоты.
Как в таком случае записать уравнение гидролиза?
Для того, чтобы записать уравнение гидролиза бинарного соединения водным раствором щелочи или кислоты, нужно:
1) в первую очередь, представить, какие продукты образовались бы при обычном гидролизе водой.
Например, мы хотим записать уравнение щелочного гидролиза соединения PCl5 действием водного раствора KOH.
Тогда, согласно этому пункту, мы должны вспомнить какие продукты образуются при обычном гидролизе. В нашем случае это HCl и H3PO4
2) посмотреть на отношение этих продуктов к средообразователю (кислоте или щелочи) – реагируют они или нет. Если продукты обычного гидролиза реагируют со средообразователем, то запомнить продукты этого взаимодействия.
Возвращаясь к нашему случаю с PCl5, мы должны посмотреть на то, как относятся к щелочи продукты обычного гидролиза, т.е. HCl и H3PO4. Оба данных соединения в водном растворе являются кислотами, в связи с чем существовать в щелочной среде не могут. В частности, с гидроксидом калия они прореагируют, образуя соответственно соли KCl и K3PO4
3) в конечном уравнении в качестве продуктов записать то, что получается при взаимодействии со средообразователем. Воду при этом мы пока не пишем, вывод о том, писать ее или нет, делаем после попытки уравнивания реакции без нее.
Таким образом, следуя этому принципу, запишем:
Уже до начала расстановки коэффициентов очевидно, что есть необходимость в записи в качестве одного из продуктов реакции воды, поскольку в левой части присутствует водород, а в правой его нет.
Таким образом, суммарная схема реакции будет иметь вид:
А само уравнение после расстановки коэффициентов будет выглядеть так:
Следует отметить, что щелочной гидролиз ионных соединений чаще всего не отличается от обычного гидролиза действием воды, поскольку чаще всего ни один продукт обычного гидролиза с щелочью не взаимодействует.
Аналогично, можно сказать, что кислотный гидролиз ковалентных бинарных соединений не будет отличаться от водного.
В связи с этим имеет смысл более детально рассмотреть кислотный гидролиз ионных бинарных соединений и щелочной гидролиз ковалентных бинарных соединений.
Кислотный гидролиз ионных бинарных соединений
Со всеми перечисленными ионными бинарными соединениями, участвовавшими в реакциях обычного гидролиза водой, можно записать соответствующие уравнения их кислотного гидролиза. Возьмем в качестве примера водный раствор соляной кислоты:
Обратите внимание, что вместо водородного соединения в случае нитридов металлов образуется продукт его взаимодействия с соляной кислотой (NH3 + HCl = NH4Cl). Следует отметить, что нитриды металлов – единственный случай, когда при кислотном гидролизе ионного бинарного соединения не выделяется газообразное водородное соединение. Связано это с тем, что по сравнению с другими водородными соединениями неметаллов, только у аммиака основные свойства выражены в значительной степени.
Как можно заметить, кислотный гидролиз гидридов металлов также относится к окислительно-восстановительным реакциям. В результате этой реакции образуется простое вещество водород. Связано это с тем, что водород с кислотами не реагирует.
Щелочной гидролиз ковалентных бинарных соединений
Щелочному гидролизу среди ковалентных соединений подвержены все те же бинарные соединения, что и обычному гидролизу водой, то есть галогениды фосфора и кремния:
Щелочной гидролиз галогенидов фосфора III в ЕГЭ не встретится из-за специфических свойства фосфористой кислоты.
Тем не менее, для тех, кто хочет, ниже предоставляю пример такого рода уравнений с пояснением:
Поскольку фосфористая кислота является двухосновной, то несмотря на наличие трех атомов водорода, при ее реакции с щелочью на атомы металла способны заместиться только два атома водорода.
📸 Видео
Химия ЕГЭ 2019. Задание № 23. Гидролиз солей. Среда водных растворов кислая, нейтральная, щелочнаяСкачать

Гидролиз солей. Среда растворов (кислая, нейтральная, щелочная)Скачать

Гидролиз солей.ПримерыСкачать

Гидролиз солейСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз солей. 10 класс.Скачать

Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать