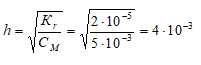Алгоритм написания уравнений гидролиза
Гидролиз по катиону
1. Определяем тип гидролиза. Необходимо написать уравнение диссоциации соли.
Гидролиз сульфата меди(II): CuSO4 = Cu 2+ + SO4 2–
Соль образована катионом слабого основания и анионом сильной кислоты. Гидролиз по катиону.
2. Записываем ионное уравнение гидролиза, определяем среду:
Cu 2+ + HOH CuOH + + H + ;
образуется катион гидроксомеди(II) и ион водорода, среда кислая
3. Составляем молекулярное уравнение. Из положительных и отрицательных частиц находящихся в растворе, записываются нейтральные частицы, существующие только на бумаге. В данном случае из CuOH + SO4 2– составляем (CuOH)2SO4. Для уравнивания числа ионов меди необходимо перед сульфатом меди поставить коэффициент два. Получаем:
Продукт реакции относится к группе основных солей: сульфат гидроксомеди(II).
- Гидролиз сульфата меди (II)
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора сульфата меди (II)
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- 🔍 Видео
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз сульфата меди (II)
CuSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Cu 2+ + 2SO4 2- + 2HOH ⇄ 2CuOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Cu 2+ + HOH ⇄ CuOH + + H +
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2CuOH + + SO4 2- + 2HOH ⇄ 2Cu(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
CuOH + + HOH ⇄ Cu(OH)2 + H +
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Среда и pH раствора сульфата меди (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:Гидролиз солей. 9 класс.Скачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
🔍 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химия | Молекулярные и ионные уравненияСкачать

11 класс. Гидролиз солей.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции ионного обмена. 9 класс.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать

76. Гидролиз солей (часть 1)Скачать