K2S — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
K2S + HOH ⇄ KHS + KOH
Полное ионное уравнение
2K + + S 2- + HOH ⇄ K + + HS — + K + + OH —
Сокращенное (краткое) ионное уравнение
S 2- + HOH ⇄ HS — + OH —
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
KHS + HOH ⇄ H2S + KOH
Полное ионное уравнение
K + + HS — + HOH ⇄ H2S + K + + OH —
Сокращенное (краткое) ионное уравнение
HS — + HOH ⇄ H2S + OH —
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Среда и pH раствора сульфида калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Гидролиз солейСкачать

Написать подробный Гидролиз солей. ХИМИЯ
Нужно молекулярную и ионную форму.
Сульфид K2S – соль, образованная сильным основанием КОН и слабой кислотой H2S, и в водном растворе подвергнется гидролизу по аниону.
K2S + НОН ↔ KOH + КНS – первая ступень гидролиза
S(2-) + HOH ↔ НS(-) + OH(-) (pH > 7 – среда щелочная)
При нормальных условиях процесс гидролиза сульфида калия K2S протекает по первой ступени и является обратимым процессом. В растворе устанавливается равновесие.
При нагревании процесс гидролиза сульфида калия идет по второй ступени. Гидролиз сульфида калия по второй ступени – необратимый процесс, протекающий с выделением сероводорода H2S, в растворе остается только гидроксид калия.
КНS + НОН → KOH + Н2S↑ — вторая ступень гидролиза
НS(-) + НОН → OH(-) + Н2S↑(pH > 7 – среда щелочная)
Суммарно
K2S + 2НОН → Н2S↑ + 2KOH
S(2-) + 2HOH → Н2S↑ + 2OH(-) (pH > 7 – среда щелочная)
Хлорид цинка ZnCl2 – соль, образованная слабым основанием Zn(OH)2 и сильной кислотой. Гидролиз протекает по катиону.
ZnCl2 + НОН ↔ ZnОНCl + НCl – первая ступень гидролиза
Zn(2+) + НОН ↔ ZnОН (+) + Н (+) (pH 7 – среда щелочная)
К2НРО4 + НОН ↔ KOH + КН2РО4 – вторая ступень гидролиза
НРО4(2-) + НОН ↔ Н2РО4(-) + OH(-) (pH > 7 – среда щелочная)
По третьей ступени гидролиз протекает при нагревании
КН2РО4 + НОН ↔ KOH + Н3РО4 – третья ступень гидролиза
Н2РО4(-)+ НОН ↔ Н3РО4 + OH(-) (pH > 7 – среда щелочная)
Суммарно
K3РО4 + 3НОН ↔ 3KOH + Н3РО4
РО4(3-) + 3HOH ↔ Н3РО4 + 3OH(-) (pH > 7 – среда щелочная)
Видео:ВАРИАНТ 6-2 РАЗБОР | CHEMISTRY LEONCHUKСкачать

Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: нитрат меди (II), сульфид калия
Решение:
Нитрат меди (II) Cu(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Cu 2+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Cu 2+ + H2O 
полное ионно-молекулярное уравнение:
Cu 2+ + 2NO3 — + H2O 
Cu(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HS – . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
S 2– + H2O 
полное ионно-молекулярное уравнение:
2К + + S 2– + H2O 
К2S + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
22. Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей.
Решение:
Сульфат алюминия Al2(SO4)3– соль слабого трехкислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли AlOH 2+ .
Сокращенное ионно-молекулярное уравнение гидролиза:
Al 3+ + H2O 
полное ионно-молекулярное уравнение:
2Al 3+ + 3SO4 2- + 2H2O 
Al2(SO4)3 + 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH 2– связывают ионы водорода из воды, образуя анионы кислой соли HS – . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
S 2– + H2O 
полное ионно-молекулярное уравнение:
2К + + S 2– + H2O 
К2S + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7).
Нитрат свинца (II) Pb(NO3)2– соль слабого двухкислотного основания и сильной кислоты. Катионы слабого основания Pb 2+ связывают гидроксид ионы из воды. Гидролиз такой соли идет по катиону:
Сокращенное ионно-молекулярное уравнение гидролиза:
Pb 2+ + H2O 
полное ионно-молекулярное уравнение:
Pb 2+ + 2NO3 — + H2O 
Pb(NO3)2+ H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH + и анионы Cl – . Катионы K + не могут связывать анионы OH – , так как KOH – сильный электролит. Анионы Cl – не могут связывать катионы Н + , так как НCl – сильный электролит. Таким образом, можно сделать вывод, что хлорид калия не гидролизуется. Равновесие между ионами и молекулами воды не нарушается, и раствор остается нейтральным, рН равен 7.
Как изменится цвет лакмуса в растворах солей: хлорида натрия, карбоната натрия, хлорида меди (II)? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей.
Решение:
Хлорид натрия NaCl —соль сильной кислоты и сильного основания. При растворении в воде хлорид натрия диссоциирует на ионы Na + и анионы Cl – . Катионы Na + не могут связывать анионы OH – , так как NaOH – сильный электролит. Анионы Cl – не могут связывать катионы Н + , так как НCl – сильный электролит. Таким образом, можно сделать вывод, что хлорид натрия не гидролизуется. Равновесие между ионами и молекулами воды не нарушается, и раствор остается нейтральным, рН равен 7. Цвет лакмуса не изменяется.
Карбонат натрия Na2CO3 – соль двухосновной слабой кислоты и сильного основания. Анионы слабой кислоты CO3 2– связывают ионы водорода из воды, образуя анионы кислой соли HCO3 — . Соль гидролизуется по аниону.
Сокращенное ионно-молекулярное уравнение:
CO3 2– + H2O 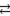
полное ионно-молекулярное уравнение:
2Na + + CO3 2– + H2O 
Na2CO3 + H2O 
Появление избыточного количества ионов OH – обусловливает щелочную реакцию среды (pH > 7). Цвет лакмуса меняется с фиолетового на синий.
Хлорид меди (II) CuCl2– соль слабого двукислотного основания и сильной кислоты. Гидролиз такой соли идет по катиону слабого основания с образованием катионов основной соли CoOH + .
Сокращенное ионно-молекулярное уравнение гидролиза:
Cu 2+ + H2O 
полное ионно-молекулярное уравнение:
Cu 2+ + 2Cl — + H2O 
CuCl2+ 2H2O 
В растворе накапливаются катионы водорода, которые создают кислую реакцию среды (pH
📹 Видео
Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

11 класс. Гидролиз солей.Скачать

Гидролиз солейСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. 2 часть. 11 класс.Скачать

Окисление иодида калия KI + H2O2, KI + CuSO4, KI + Fe(NO3)3, KI + KMnO4Скачать

Гидролиз солей | Таисия Фламель | ЕГЭ Химия. ВебиумСкачать

Химия | ГидролизСкачать

ЕГЭ. Химия. Гидролиз.Скачать

ВАРИАНТ 9-2 РАЗБОР | CHEMISTRY LEONCHUKСкачать

Двойной гидролиз на ЕГЭСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Химия 8 класс: Гидролиз солейСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать


