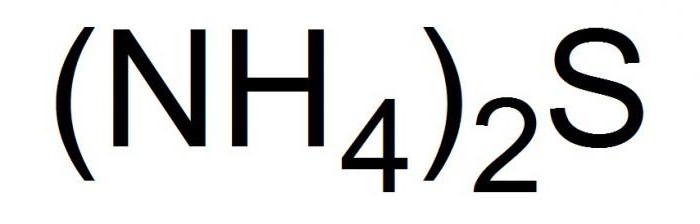Азот — один из важнейших элементов органической химии. В виде сложных соединений элемент N является важной частью белков, из которых состоят все живые организмы на нашей планете. Этот достаточно активный химический элемент образует множество соединений, одним из которых является соединение аммония.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Что это такое
В молекуле аммиака азот охватывает своими ковалентными связями три атома водорода, причем последняя электронная связь остается свободной. Таким образом, аммоний может выступать донором различных химических реакций, образовывая четвертую – незатраченную ковалентную связь с другими веществами и соединениями. Если такое соединение происходит с атомом водорода, образуется молекула NH4. Полученный элемент может реагировать с различными кислотами, которые находятся в растворенном или концентрированном виде. При взаимодействии аммиак их нейтрализует. В итоге реакции получаются соли аммония — термически неустойчивые соединения. Если соль аммония нагревать, она быстро разлагается на составляющие вещества. При повышении температуры образуется аммиак с кислотой. Возможен и обратный процесс. Например, при взаимодействии с сероводородной кислотой можно получить сульфид аммония.
Видео:Химия. Молекулярные и ионные уравненияСкачать

Формула
Это соединение записывается в химических уравнениях в видеследующей формулы.
Видео:Гидролиз солей. 9 класс.Скачать

Распространенные химические реакции
Гидролиз сульфида аммония отличается от других реакций подобных солей тем, что в ней принимают участие и катионы, и анионы одного и того же вещества. Процесс реакции зависит от температуры. Гидролиз сульфида аммония может быть записан следующим образом:
- ионное уравнение гидролиза по катиону:
NH4 + +H2O = NH3*H2O + H+; - уравнение гидролиза по аниону проходит в два этапа:
Итоговое ионное уравнение реакции выглядит следующим образом:
- NH4 + +S2- + 2H2O = NH3*H2O + HS- + H+ + OH-.
Стандартная запись этой химической реакции выглядит так:
Без нагревания реакция может быть обратима и происходит по первой ступени. Но если вещество подогреть, реакция станет необратимой – конечные вещества аммиак и сероводород просто покидают поле взаимодействия и улетучиваются.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Получение сульфида аммония
Сульфид аммония чаще всего получают при взаимодействии сероводорода с избытком аммиака:
Одной из наиболее характерных особенностей этого соединения является полное разложение соединения в воде. Цепь химической реакции выгладит следующим образом:
Сульфид аммиака в воде распадается на аммиак и сероводород.
Дальнейшее разложение сопровождается выделением водорода и появлением растворенного в воде аммиака и слабого аниона HS — . Поэтому в таблицах, поясняющих раствормость химических элементов, сульфид аммония помечен пропуском.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Практическое применение
В промышленности практическое применение разработано для паров сульфида аммония. Жидкая форма этого соединения используется при транспортировке. Хранят его в закрытых, химически инертных емкостях.
Это вещество хорошо знакомо фотографам и текстильщикам. В фотографии это соединение используется для обработки пленки. При взаимодействии с сильными основаниями происходит химическая реакция, сопровождающаяся выделением вредных веществ. В текстильной промышленности сульфид аммония используется как компонент отбеливающих смесей. Металлурги и реставраторы успешно пользуются им для превращения патины в бронзу. Сульфид аммония непременно используется при производстве мочевины, как важного удобрения, а также при производстве соды.
Возможно, применение этого вещества в хозяйственной деятельности было бы более распространенным. Но из-за чрезвычайной летучести этого соединения оно довольно быстро вступает в химическую реакцию с водяным паром, содержащимся в воздухе. Конечным продуктом этого взаимодействия является сероводород, который славится своим резким и очень неприятным запахом. Именно эта особенность сульфида аммония стала причиной его использования в производстве продукции для розыгрышей, включая «вонючие бомбы» и прочее.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
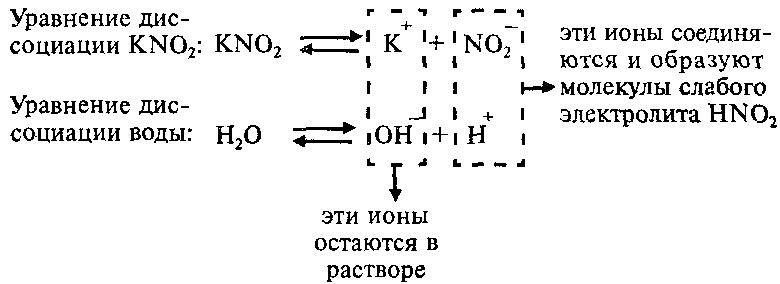
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
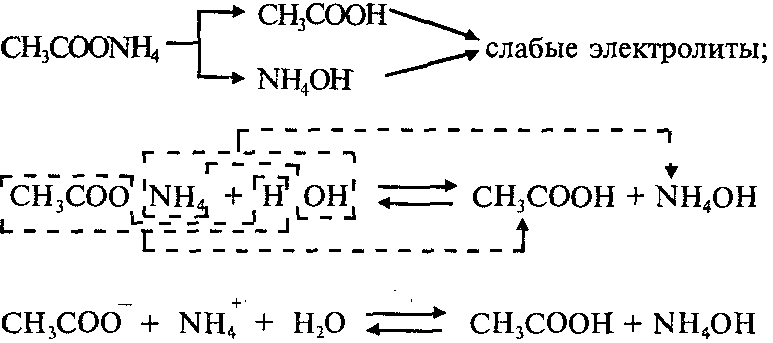
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
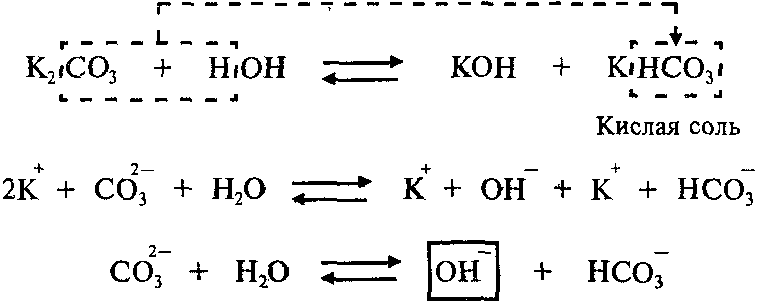
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Acetyl
Привет! Я Виктор.
Я пишу этот сайт с 2013 года для вас
Если вам нравится то, что я делаю, вы можете:
Это сообщение исчезнет завтра на неделю
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. 💡 ВидеоТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать  Гидролиз солей. 1 часть. 11 класс.Скачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать  ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать  Реакции ионного обмена. 9 класс.Скачать  76. Гидролиз солей (часть 1)Скачать  Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать  Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать  NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать  Совместный гидролиз | Химия ЕГЭ – Екатерина СтрогановаСкачать  Гидролиз солей. Опыт 2. Определение реакции среды в растворах солейСкачать  Гидролиз солей. Опыт 1. Окраска индикаторов в различных средахСкачать  |