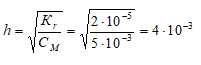Гидролиз сульфата аммония: (NH4)2SO4 + H2O = NH4HSO4 + NH4OH
Полное ионное уравнение: 2NH4(+) + SO4(2-) + 2H2O = 2NH4OH + SO4(2-) + 2OH(-)
Краткое ионное уравнение: NH4(+) + H2O = NH4OH + OH(-) гидролиз по катиону, среда кислая
———————————————
Гидролиз сульфида алюминия: Al2S3 + 6H2O = 2Al(OH)3 + 3H2S (осадок и газ)
Полное ионное уравнение: 2Al(3+) + 3S(2-) + 6H2O = 2Al(OH)3 + 3H2S
Гидролиз протекает сразу и по катиону, и по аниону, поэтому реакция идёт до конца, с выпадением осадка гидроксида алюминия и образованием газообразного сероводорода
——————————-
Гидролиз сульфита калия: K2SO3 + H2O = KHSO3 + KOH
полное ионное уравнение: 2K(+) + SO3(2-) + 2H2O = 2K(+) + H2SO3
Краткое ионное уравнение: SO3(2-) + 2H2O = H2SO3 + 2OH(-) гидролиз по аниону, среда щелочная
Запишите уравнения гидролиза следующих солей, укажите тип гидролиза и среду раствора. а) фосфат меди
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- Уравнение гидролиза сульфида алюминия в молекулярном и ионном виде
- 🌟 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:Химия | Молекулярные и ионные уравненияСкачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
Видео:Гидролиз солей. 9 класс.Скачать

Уравнение гидролиза сульфида алюминия в молекулярном и ионном виде
(соль образованна слабым многокислотным основанием и слабой многоосновной кислотой)
Если продукты гидролиза выводятся из сферы реакции (в виде осадка или газа), то процесс может протекать до конца:
Al2S3 + 6 H2O = 2 Al(OH)3 + 3 H2S
ионно-молекулярное уравнение: 2 Al 3+ + 3S 2- + 6H2O = 2Al(OH)3 + 3 H2S
В этом случае гидролиз протекает необратимо.
Полностью гидролизуются соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)).
Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основной карбонат меди (CuOH)2CO3.
Бинарные соединения: нитриды, фосфиды, карбиды, ацетилениды, бориды:
🌟 Видео
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Получение и гидролиз сульфида алюминия / Synthesis and hydrolysis of aluminium sulfideСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз сульфата алюминия | ЕГЭ по химииСкачать

11 класс. Гидролиз солей.Скачать

Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

Опыты по химии. Гидролиз солей алюминияСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Электролиз. 10 класс.Скачать

ЕГЭ ХИМИЯ 2020 Задание 23 Как определить тип гидролиза соли Демонстрационный вариант ВидеоурокСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать