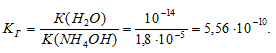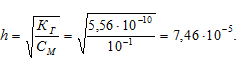Вопрос по химии:
Составьте молекулярное полное и сокращенное ионное уравнение реакции гидролиза(NH4)2S
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Сульфид аммония — соль, образованная двумя слабыми электролитами — гидроксидом аммония NH4OHи сероводородом H2S, поэтому гидролиз одновременно протекает и по катиону, и по аниону:
Уравнение диссоциации соли:
(NH4)2S = 2NH(4+) + S(2-)
Уравнения гидролиза:
Гидролиз по катиону (ионное уравнение)
NH(4+) + H2O = NH3*H2O + (H+)
Гидролиз по аниону (ионное уравнение)
S(2-) + H2O = HS(-) + OH(-) — I ступень
HS(-) + H2O = H2S + OH(-) — II ступень.
Без нагревания гидролиз идет, в основном, по I ступени.
Суммарное ионное уравнение гидролиза:
NH4(+) +S(2-) + 2H2O = NH3*H2O + HS(-) + H(+) + OH(-)
Молекулярное уравнение:
(NH4)2S + 2H2O = NH3*H2O + NH4HS + H2O
или (NH4)2S + H2O = NH3*H2O + NH4HS (образуется гидросульфид аммония)
При нагревании гидролиз сульфида аммония идет до конца (т. е. необратим) , так как в результате испарения воды образуются 2 вещества, уходящих из сферы реакции, — газообразные аммиак и сероводород.
Суммарные уравнения (ионное и молекулярное) выглядят так:
2NH4(+) +S(2-) + 4H2O = 2NH3*H2O + H2S +2H2O
(NH4)2S + 2H2O = 2NH3*H2O + H2S = 2NH3 + H2S + 2H2O
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Определение реакции среды раствора соли
Задача 594.
Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S.
Решение:
K(NH4OH) = 1,8 . 10 -5 ; K(HCN) = 7,9 . 10 -10 ; K(HF) = 6,6 . 10-4; K(H2S) = 6 . 10 -8 .
Так как соли образованы слабыми основаниями и слабыми кислотами, то при взаимодействии с водой они гидролизуются как по катиону, так и по аниону, В этом случае реакция раствора зависит от относительной силы кислоты и основания, образующих данную соль.
а) NH4CN — соль слабого основания и слабой кислоты, поэтому гидролизуется как по катиону, так и по аниону. Но так как K(HCN) . 10 -10 ) . 10 -5 )], то гидролизу преимущественно будут подвергаться анионы соли и реакция раствора будет преимущественно слабощелочной, рН > 7:
CN — + H2O ⇔ HCN + OH — .
б) NH4F. Так как K(HF) > K(NH4OH) [(6,6 . 10 -4 ) . 10 -5 )], то гидролизу преимущественно будут подвергаться катионы соли и реакция раствора будет преимущественно слабокислой рН
в) (NH4)2S. Так как K(H2S) . 10 -8 ) . 10 -5 )], то гидролизу преимущественно будут подвергаться анионы соли и реакция раствора будет преимущественно слабощелочной, рН > 7:
Задача 595.
При рН 6,3 — в желтый, при промежуточных значениях рН — в оранжевый цвет. Какова будет окраска индикатора в 0,1 М растворе ?
Решение:
K(NH4OH) = 1,8 . 10 -5 .
Уравнение гидролиза NH4Br:
Находим концентрацию ионов водорода:
[H + ] = h . CM = (7,46 . 10 -5 ) . (1 . 10 -1 ) = 7,46 . 10 -6 .
pH = -lg[H + ] = -lg7,46 . 10 -6 = 6 — lg7,46 = 6 — 0,87 = 5,13.
Так как pH > 3,1, но
Ответ: оранжевый.
Задача 596.
Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 — сильно-щелочную реакцию. Объяснить эти факты и мотивировать их соответствующими ионно-молекулярными уравнениями.
Решение:
а) Так как NaH2PO4 — соль сильного основания и слабой кислоты, то гидролиз протекает по аниону:
В растворе проходит и диссоциация образовавшейся фосфорной кислоты:
При гидролизе данной соли образуется ортофосфорная кислота, которая при диссоциации даёт в раствор дополнительное количество ионов водорода, которых намного больше, чем гидроксид-ионов, что и придаёт раствору слабокислую реакцию. Это можно объяснить тем, что в рассмотренном примере константа диссоциации H3PO4 превышает константу гидролиза аниона H2PO4 — , поэтому раствор соли имеет слабокислую реакцию.
б) Так как Na3PO4 — соль сильного основания и слабой кислоты, то гидролиз протекает по аниону:
В растворе проходит и диссоциация образовавшейся фосфорной кислоты:
В рассмотренном примере одновременно протекают два процесса: гидролиз соли, идущий с образованием гидроксид-ионов; диссоциация кислоты, идущая с образованием ионов водорода. Так как константа гидролиза аниона HPO4 2- намного превышает константу диссоциации кислоты H3PO4, то в растворе будет избыток гидроксид-ионов, что и предаёт раствору сильно-щелочную реакцию.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Написать молекулярно-ионные формы уравнений гидролиза (отдельно для катиона и аниона) и указать реакцию водных растворов солей: (NH4)2S, (NH4)2SO3, (NH4)3PO4, (NH4)2HPO4.
| 🎓 Заказ №: 22220 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Написать молекулярно-ионные формы уравнений гидролиза (отдельно для катиона и аниона) и указать реакцию водных растворов солей: (NH4)2S, (NH4)2SO3, (NH4)3PO4, (NH4)2HPO4.
Решение: Гидролизом называется обменная реакция вещества с водой. При этом происходит смещение равновесия диссоциации воды H2O H OH вследствие связывания одного из ионов (или обоих) с образованием малодиссоциирующего или труднорастворимого вещества. Гидролизу подвергаются соли, образованные либо слабой кислотой, либо слабым основанием, либо и тем и другим. Для солей, образованных слабым основанием и слабой кислотой реакция среды раствора близка к нейтральной. Сульфид аммония образован слабым основанием и слабой кислотой. В растворе сульфида аммония гидролиз обусловлен катионами аммония NH4 , связывающими гидроксид-анионы, и сульфид-анионами S 2- , связывающими катионы водорода. Уравнения реакции гидролиза в молекулярно-ионной форме
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
🌟 Видео
Гидролиз солей. 9 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Гидролиз солей.ПримерыСкачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Химия | ГидролизСкачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Химия 8 класс: Гидролиз солейСкачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Химия. 9 класс. Гидролиз солей /02.10.2020/Скачать

Совместный гидролиз во второй части | Химия ЕГЭ | УмскулСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Гидролиз солей. 2 часть. 11 класс.Скачать

77. Гидролиз солей (часть 2)Скачать

11 класс. Гидролиз солей.Скачать

Реакции ионного обмена. 9 класс.Скачать

ВСЯ ХИМИЯ 9 КЛАСС Электролитическая диссоциация / Гидролиз солей WannaBeTeacher Усенов УланСкачать