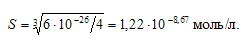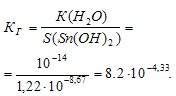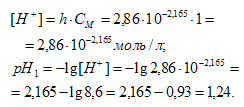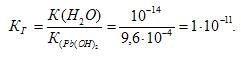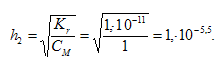Задача 1104.
Каково соотношение рН изомолярных растворов Sn(NO3)2 (рH1) и Рb(NO3)2: (рН2): а) рH1 > рН2; б) рН1 = рН2; в) рH1 . 10 -26 ;
КД[Pb(ОН)2] = 9,6 . 10 -4
а) Sn(NO3)2 – соль слабого основания [(Sn(OH)2] и сильной кислоты (HNO3), поэтому гидролизуется по катиону. С учетом того, что гидролиз в основном протекает по первой ступени, уравнение гидролиза можно представить уравнением:
Sn 2+ + H2O → Sn(OH) + + H +
Следовательно, раствор соли Sn(NO3)2 имеет кислую реакцию среды (рН + .
Рассчитаем растворимость Sn(ОН)2:
ПР[Sn(ОН)2] = [Sn 2+ ] . [OH – ] = S . (2S) 2 = 4S 3 ;
Константа гидролиза будет определяться растворимостью образовавшегося Sn(ОН)2 и определяется по формуле:
Степень гидролиза определяется по формуле:
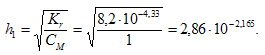
Теперь рассчитаем концентрацию образовавшихся ионов и рН:
б) Рb(NO3)2 – соль слабого основания [(Sn(OH)2] и сильной кислоты (HNO3), поэтому гидролизуется по катиону. С учетом того, что гидролиз в основном протекает по первой ступени, уравнение гидролиза можно представить уравнением:
Sn 2+ + H2O → Sn(OH) + + H +
Следовательно, раствор соли Рb(NO3)2 имеет кислую реакцию среды (рН
Константа гидролиза определяется константой диссоциации образовавшегося основания Сr(ОН)3 и определяется по формуле:
Степень гидролиза определяется по формуле:
Теперь рассчитаем концентрацию образовавшихся ионов H + и рН:
- Гидролиз нитрата олова (II)
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора нитрата олова (II)
- Гидролиз
- Теоретическое введение
- Примеры обратимого гидролиза
- Случаи необратимого гидролиза
- Константа и степень гидролиза
- Примеры решения задач
- Задачи для самостоятельного решения
- 🌟 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Гидролиз нитрата олова (II)
Sn(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
Sn 2+ + 2NO3 — + HOH ⇄ SnOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Sn 2+ + HOH ⇄ SnOH + + H +
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
SnOH + + NO3 — + HOH ⇄ Sn(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
SnOH + + HOH ⇄ Sn(OH)2 + H +
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Среда и pH раствора нитрата олова (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:11 класс. Гидролиз солей.Скачать

Гидролиз
Материалы портала onx.distant.ru
Теоретическое введение
Примеры обратимого гидролиза
Случаи необратимого гидролиза
Константа и степень гидролиза
Примеры решения задач
Задачи для самостоятельного решения
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Теоретическое введение
Гидролиз – обменная реакция взаимодействия растворенного вещества (например, соли) с водой. Гидролиз происходит в тех случаях, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Примеры обратимого гидролиза
Соли, образованные сильным основанием и слабой кислотой, например , CH3COONa, Na2CO3, Na2S, KCN гидролизуются по аниону:
СН3СООNa + НОН ↔ СН3СООН + NaОН (рН > 7)
Гидролиз солей многоосновных кислот протекает ступенчато. 1 ступень:
CO3 2– + HOH ↔ HCO3 – + OH – ,
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
Соли, образованные слабым основанием и сильной кислотой, например , NH4Cl, FeCl3, Al2(SO4)3, гидролизуются по катиону:
или в молекулярной форме:
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. 1 ступень:
Fe 3+ + HOH ↔ FeOH 2+ + H + ;
FeCl3 + HOH ↔ FeOHCl2 + HCl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H + ;
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl.
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H + ;
Fe(OH)2Cl + HOH ↔ Fe(OH)3+ HCl.
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
Соли, образованные слабым основанием и слабой кислотой, например , CH3COONH4, (NH4)2CO3, HCOONH4, гидролизуются и по катиону, и по аниону:
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. Поскольку в рассматриваемом примере константы диссоциации СH3COOH и NH3·H2О при 25 о С примерно равны (Кд(СH3COOH) = 1,75·10 –5 , Кд(NH3·H2О) = 1,76·10 –5 ), то раствор соли будет нейтральным.
При гидролизе HCOONH4 реакция раствора будет слабокислой, поскольку константа диссоциации муравьиной кислоты (Кд(HCOOН) = 1,77·10 –4 ) больше константы диссоциации уксусной кислоты.
Соли, образованные сильным основанием и сильной кислотой (например, NaNO3, KCl, Na2SO4), при растворении в воде гидролизу не подвергаются.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Случаи необратимого гидролиза
Гидролиз некоторых солей, образованных слабыми основаниями и слабыми кислотами, протекает необратимо. Необратимо гидролизуется, например , сульфид алюминия:
Следует отметить, что при смешении растворов солей гидролизующихся по аниону и катиону:
Mg 2+ + HOH ↔ MgOH + + H + ,
CO3 2– + HOH ↔ HCO3 – + OH –
Продукты гидролиза первой соли усиливают гидролиз второй соли и наоборот. В результате при смешении водных растворов сульфата магния и карбоната натрия образуется основной карбонат магния:
Основные карбонаты выпадают в осадок также при смешивании растворов карбонатов щелочных металлов и солей Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.
При сливании растворов соды и солей Fe 2+ , Ca 2+ , Sr 2+ , Ba 2+ реакции протекают следующим образом:
(Ме – Fe, Ca, Sr, Ba)
При взаимодействии солей Аl 3+ , Сr 3+ и Fe 3+ в растворе с сульфидами, карбонатами и сульфитами в результате гидролиза в осадок выпадают не сульфиды, карбонаты и сульфиты этих катионов, а их гидроксиды:
Следует отметить, что катион Fe 3+ производит окисляющее действие на анион S 2- . В результате протекает реакция:
2Fe 3+ + S 2- = 2Fe 2+ + S о .
Например , хлорид железа (III) реагирует с сульфидом калия:
2FeCl3 + 3K2S = 2FeS + S + 6KCl
Некоторые соли в результате гидролиза в воде образуют малорастворимые оксосоединения:
SbCl3 + H2O → SbOCl↓ + 2HCl.
Необратимо гидролизуются в водных растворах галогенангидриды:
Видео:Химия 8 класс: Гидролиз солейСкачать

Константа и степень гидролиза
Константа Кг и α г степень гидролиза для растворов электролитов связаны между собой уравнением, по форме совпадающим с уравнением Оствальда:

Константа гидролиза Кг может быть рассчитана на основе значений ионного произведения воды Кw и константы диссоциации Кд образующихся в результате гидролиза слабой кислоты или слабого основания:

Видео:Гидролиз солей. Опыт 2. Определение реакции среды в растворах солейСкачать

Примеры решения задач
Задача 1. Вычислите Кг, α г и рН 0,01 М раствора NH4Cl при температуре 298 К, если при указанной температуре Кд(NH3·H2O) = 1,76× 10 -5 .
Решение.

[Н + ] = 2,4·10 –4× 0,01 = 2,4× 10 –6 М.
рН = — lg 2,4× 10 –6 = 5,6.
Задача 2. Определите константу гидролиза, степень гидролиза и рН 0,02 М раствора НСООNa при 298 К, если при указанной температуре Кд(НСООН) = 1,77× 10 –4 .
Решение. Формиат натрия гидролизуется в соответствии с уравнением:
НСОО — + Н2О ↔ НСООН + ОН — .
Поскольку [НСООН] = [ОН – ] и [НСОО – ]·Сисх(НСООNa), то константу гидролиза можно записать следующим образом:

[Н + ] = 10 –14 ÷1,06× 10 –6 = 9,4·10 –9 М
рН = — lg 9,4× 10 –9 = 8
Задача 3. Определите рН 0,006М раствора NaNO2, если α г = 7·10 –3 %.
Решение.
[ОН – ] = 0,006× 7× 10 –5 = 4,2× 10 –7 М.
[Н + ] = 10 –14 :4,2× 10 –7 = 2,4× 10 –8 М.
рН = — lg 2,4× 10 –8 = 7,6.
Задача 5. Определите рН 0,1 М раствора Na3PO4 при 298 К, если константы диссоциации ортофосфорной кислоты при указанной температуре соответственно равны: Кд.1 = 7,11× 10 — 3 , Kд.2 = 6,34× 10 — 8 , Kд.3 = 4,40× 10 — 13 .
Решение. Na3PO4 диссоциирует в растворе и подвергается ступенчатому гидролизу:
Следует обратить внимание на выбор “нужной” величины Кд.
Kдисс.2 = 6,34·10 — 8
Так как Кг,1 > > Кг,2, то можно считать, что соль подвергается гидролизу только по первой ступени.

поскольку [HPO4 2- ] = [OH — ].
рОН = –lg 4,76× 10 — 2 = 1,32 и рН = 14 – 1,32 = 12,68.
Видео:Гидролиз солей.ПримерыСкачать

Задачи для самостоятельного решения
1. Гидролиз соли Na2SO3 усилится при добавлении в раствор веществ:
| а) Н2O | б) Na2CO3 | в) NaOH |
| г) H2SO4 | д) Na2S | е) Na2SO4 |
2. Напишите уравнение реакции NiCl2 + Na2CO3 + H2O → .
🌟 Видео
Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солейСкачать

Необратимый гидролиз. Примеры уравнений с объяснением.Скачать

Константа гидролиза и pH водного раствора солиСкачать

Гидролиз солей. Задание №23 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Химия | ГидролизСкачать

77. Гидролиз солей (часть 2)Скачать

Гидролиз солей. Опыт 1. Окраска индикаторов в различных средахСкачать

76. Гидролиз солей (часть 1)Скачать