Видео:Lead acetate । salt analysisСкачать

Ваш ответ
Видео:Гидролиз солей. 9 класс.Скачать

решение вопроса
Видео:Salt Analysis Of Lead Acetate Pb(CH3COO)2|| Chemistry practical 12th B.sc|| Ranjana kaushik chemisСкачать

Похожие вопросы
- Все категории
- экономические 43,299
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,256
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Получение Ацетата Железа. (CH3COO)2Fe.Скачать

Написать уравнения ступенчатого гидролиза ацетата свинца Pb(CH3COO)2
Написать уравнения ступенчатого гидролиза ацетата свинца Pb(CH3COO)2
- Ольга Чибикова
- Подготовка к ЕГЭ/ОГЭ 2019-11-03 18:14:48 3 1
Pb(CH3COO)2 — соль слабенького основания и слабой кислоты, гидролизуется по аниону и по катиону предпочтительно по 1 ступени:
Pb(CH3COO)2 Pb2+ + 2CH3COO
1 ст.
Pb2+ + НОН PbОН+ + Н+
CH3COO + НОН CH3COOН + ОН
Н+ + ОН Н2О
___________________________________
Pb2+ + CH3COO + НОН PbОН+ + CH3COOН
Pb(CH3COO)2 + Н2О PbОНCH3COO + CH3COOН
По 2 ст. — только в особенных усл., напр., при нагревании раствора:
PbОНCH3COO PbОН+ + 2CH3COO
PbОН+ + НОН Pb(ОН)2 + Н+
CH3COO + НОН CH3COOН + ОН
Н+ + ОН Н2О
___________________________________
PbОН+ + CH3COO + Н2О Pb(ОН)2 + CH3COOН
PbОНCH3COO + Н2О Pb(ОН)2 + CH3COOН
Видео:Salt Analysis |Group 1 | Lead acetate |Class XI ,XII Chemistry |Chemistry classes by Monika Jain MamСкачать

Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
По катиону, по аниону или нет гидролиза?
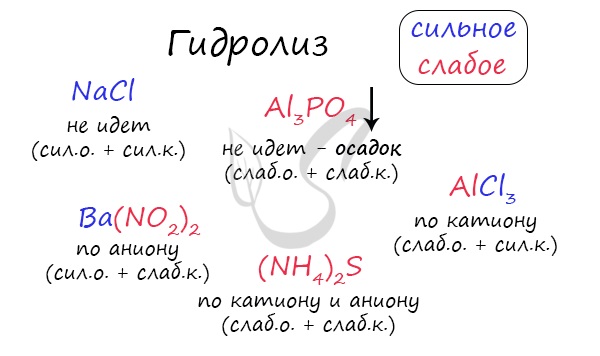
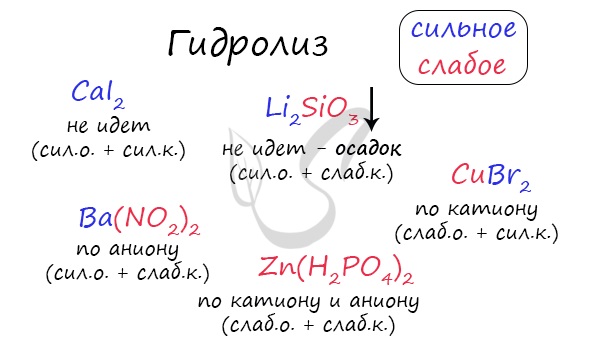
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
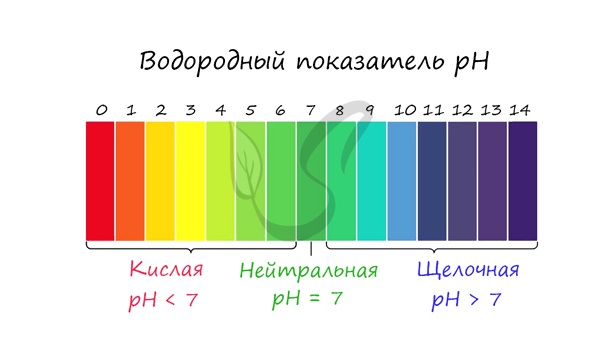
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
🎥 Видео
Salt analysis: Lead acetateСкачать

11 класс. Гидролиз солей.Скачать

Salt anylisis test for lead (Pb)2+Скачать

Salt analysis test for Acetate ion (CH3COO)-Скачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Acetate ion Test By Seema Makhijani chemistry Practicals class 11 and 12 CBSEСкачать

Test for Lead ions (group1 ) cation analysis by Seema MakhijaniСкачать

Степень гидролиза и как её рассчитатьСкачать

Test for acetate ion (CH3COO-) || class 11th and 12th salt analysis #saltanalysis #anionsСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Совместный гидролиз за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

Analysis of Group 1 Cation | Lead Cation | Confirmatory Test of Lead | Salt Analysis | Class 11 & 12Скачать

Химия | ГидролизСкачать

Salt Analysis Class-Test for Acetate ions Indicatory and Confirmatory|Practical Exam-Class 12 -2021Скачать

ЩЕЛОЧНОЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать