KNO2 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
Молекулярное уравнение
KNO2 + HOH ⇄ HNO2 + KOH
Полное ионное уравнение
K + + NO2 — + HOH ⇄ HNO2 + K + + OH —
Сокращенное (краткое) ионное уравнение
NO2 — + HOH ⇄ HNO2 + OH —
- Среда и pH раствора нитрита калия
- Напишите уравнение гидролиза соли нитрита калия в молекулярной, ионной и сокращенной ионной форме?
- Напишите молекулярное, полное и сокращенное ионные уравнения реакции уксусной кислоты с карбонатом натрия?
- . Составьте уравнения реакций гидролиза следующих солей в сокращенной ионной, ионной и молекулярной формах : a) NaNO2 ; б) NаНСО3 ; в) К2СО3 ; г) K2HPO4 ; д) К3зРO4?
- А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б)?
- Напишите уравнение гидролиза солей в молекулярной и ионной формах, укажите pH раствора?
- Напишите молекулярные и ионные уравнения реакций гидролиза соли K2SO3?
- Mg(NO3)2 и Na2CO3 Ионные и молекулярные уравнения для гидролиза солей, реакция среды в растворе соли, выражение для константы гидролиза, куда сместиться равновесие гидролиза при подкислении раствора с?
- Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах?
- Напишите молекулярное и ионное уравнение реакции гидролиза ацетата калия?
- Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи)?
- Состав те уравнение гидролиза солей в молекулярном и ионном виде?
- Гидролиз солей
- 📽️ Видео
Видео:Гидролиз солей. 9 класс.Скачать

Среда и pH раствора нитрита калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Химия | Молекулярные и ионные уравненияСкачать

Напишите уравнение гидролиза соли нитрита калия в молекулярной, ионной и сокращенной ионной форме?
Химия | 10 — 11 классы
Напишите уравнение гидролиза соли нитрита калия в молекулярной, ионной и сокращенной ионной форме.
Укажите, реакцию среды в растворе соли.
KNO₃ + H — OH ≠ Соль нитрат калия KNO₃.
Образована при взаимодействии щелочи KOH и азотной кислоты HNO₃.
При растворении в воде таких солей, образованных сильным основание и сильной кислотой, гидролиз не происходит.
Среда водные растворы таких солей нейтральная.
KNO₃ + H — OH⇔ KOH + HNO₃
K⁺ + NO₃⁻ + H⁺ — OH⁻⇔ K⁺ + OH⁻ + H⁺ + NO³⁻.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите молекулярное, полное и сокращенное ионные уравнения реакции уксусной кислоты с карбонатом натрия?
Напишите молекулярное, полное и сокращенное ионные уравнения реакции уксусной кислоты с карбонатом натрия.
Напишите уравнение реакции гидролиза полученной соли.
Какова реакция среды на индикатор ее водного раствора?
Видео:Реакции ионного обмена. 9 класс.Скачать

. Составьте уравнения реакций гидролиза следующих солей в сокращенной ионной, ионной и молекулярной формах : a) NaNO2 ; б) NаНСО3 ; в) К2СО3 ; г) K2HPO4 ; д) К3зРO4?
. Составьте уравнения реакций гидролиза следующих солей в сокращенной ионной, ионной и молекулярной формах : a) NaNO2 ; б) NаНСО3 ; в) К2СО3 ; г) K2HPO4 ; д) К3зРO4.
Укажите реакцию среды в растворах этих солей.
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б)?
А). Напишите уравнение в молекулярной, полной и сокращённой ионной формах : NiCl2 + KOH → б).
Напишите молекулярные и ионные уравнения реакций гидролиза, протекающего в растворе соли Li(HCOO).
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Напишите уравнение гидролиза солей в молекулярной и ионной формах, укажите pH раствора?
Напишите уравнение гидролиза солей в молекулярной и ионной формах, укажите pH раствора.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Напишите молекулярные и ионные уравнения реакций гидролиза соли K2SO3?
Напишите молекулярные и ионные уравнения реакций гидролиза соли K2SO3.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Mg(NO3)2 и Na2CO3 Ионные и молекулярные уравнения для гидролиза солей, реакция среды в растворе соли, выражение для константы гидролиза, куда сместиться равновесие гидролиза при подкислении раствора с?
Mg(NO3)2 и Na2CO3 Ионные и молекулярные уравнения для гидролиза солей, реакция среды в растворе соли, выражение для константы гидролиза, куда сместиться равновесие гидролиза при подкислении раствора соли.
Видео:Гидролиз | Химия 11 класс #18 | ИнфоурокСкачать

Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах?
Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах.
Видео:Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Напишите молекулярное и ионное уравнение реакции гидролиза ацетата калия?
Напишите молекулярное и ионное уравнение реакции гидролиза ацетата калия.
Во всех ли случаях при обычных условиях гидролиз доодит до конца?
Укажите реакцию среды и значение рН (больше или меньше)водного раствора этой соли.
Видео:Гидролиз солейСкачать

Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи)?
Напишите в молекулярной и ионной формах уравнения реакций гидролиза солей, укажите значения рН растворов этих солей (больше или меньше семи).
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Состав те уравнение гидролиза солей в молекулярном и ионном виде?
Состав те уравнение гидролиза солей в молекулярном и ионном виде.
Назовите продукты гидролиза.
Укажите реакцию среды в растворе рассматриваемой соли : Фосфат калия.
Перед вами страница с вопросом Напишите уравнение гидролиза соли нитрита калия в молекулярной, ионной и сокращенной ионной форме?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 10 — 11 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
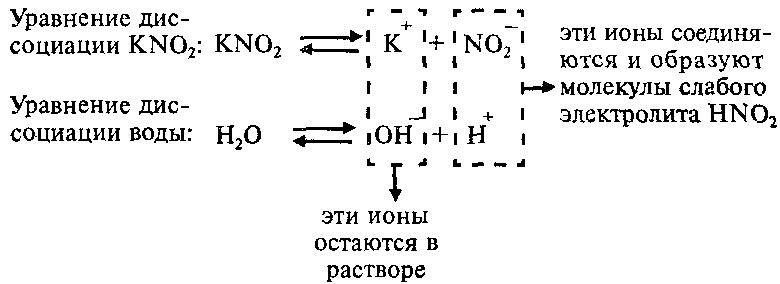
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
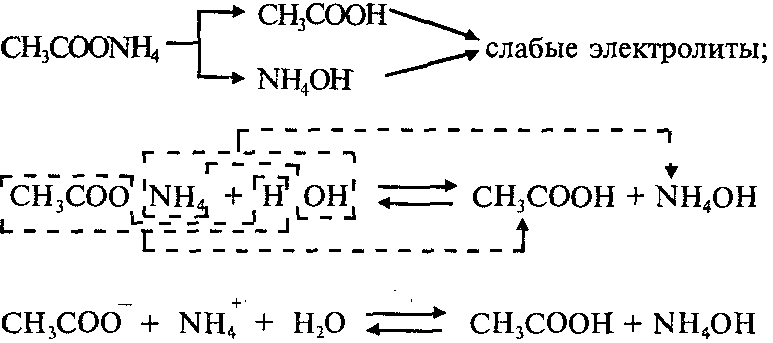
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
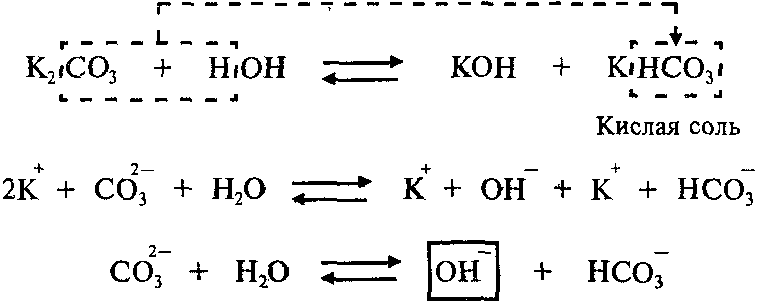
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
📽️ Видео
Гидролиз солейСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

76. Гидролиз солей (часть 1)Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Реакции ионного обмена. 9 класс.Скачать