Na2SiO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора метасиликата натрия
- Строение, свойства углерода и кремния
- Составьте молекулярные и ионные уравнения гидролиза солей Cr2(SO4)3 и Na2SiO3. Какое значение рН (рН ≤ 7, рН ≥ 7) имеют растворы
- Ваш ответ
- решение вопроса
- Похожие вопросы
- 📸 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
Na2SiO3 + HOH ⇄ NaHSiO3 + NaOH
Полное ионное уравнение
2Na + + SiO3 2- + HOH ⇄ Na + + HSiO3 — + Na + + OH —
Сокращенное (краткое) ионное уравнение
SiO3 2- + HOH ⇄ HSiO3 — + OH —
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
NaHSiO3 + HOH ⇄ H2SiO3 + NaOH
Полное ионное уравнение
Na + + HSiO3 — + HOH ⇄ H2SiO3 + Na + + OH —
Сокращенное (краткое) ионное уравнение
HSiO3 — + HOH ⇄ H2SiO3 + OH —
Видео:Химия | Молекулярные и ионные уравненияСкачать

Среда и pH раствора метасиликата натрия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Строение, свойства углерода и кремния
Задача 965.
Написать уравнение гидролиза Na 2 SiO 3 . Как изменится степень гидролиза Na 2 SiO 3 при добавлении к раствору хлорида аммония?
Решение :
Na 2 SiO 3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
SiO3 2- двухзарядный ион, значит, гидролизуется по двум ступеням. Гидролиз обычно протекает только по первой ступени:
SiO 3 2- + H2O ↔ HSiO3 – + OH – (ионно-молекулярная форма);
Na2SiO3 + Н2О ↔ NaHSiO3 + NaOH (молекулярная форма).
Образующийся избыток ионов OH – придаёт раствору щелочную среду, рН > 7.
б) При добавлении к раствору Na2SiO3 хлорида аммония, как соли, гидролизующейся по катиону, будет наблюдаться избыток ионов водорода Н + :
Образуемый при гидролизе обеих солей избыток ионов Н + и ОН¯ провзаимодействует между собой с образованием молекул Н2О (Н+ + ОН¯ ? Н2О). Дополнительное образование Н2О, согласно принципу Ле Шателье, сместит равновесие системы вправо, в сторону усиления гидролиза обеих солей.
Задача 966.
Каким типом гибридизации АО углерода можно описать строение молекулы СО2: а) sр; б) sp 2 ; в) sp 3 ; г) гибридизации не происходит?
Потому что: 1) ковалентность углерода в этом соединении равна четырем; 2) молекула неполярна; З) кратность связи углерод — кислород больше единицы.
Решение:
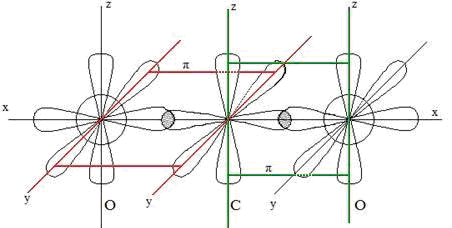
Установлено, что молекула СО2 имеет линейное строение О = С = О или :O:: С::O: Молекула неполярна. Атом углерода соединён с двумя атомами кислорода двойными связями. Такое возможно, если атом углерода находится в состоянии sp-гибридизации. Два образующихся sp-гибридных облака имеют ассиметричную форму, которая обеспечивает большее перекрывание с электронными облаками атомов кислорода. Поскольку два гибридных облака в результате взаимного отталкивания располагаются относительно ядра атома углерода таким образом, что угол между ними составляет 180 0 (рис. 1.):
Рис. 1. Схема строения молекулы СО2
(По материалам Российского химико-технологического университета
им. Д.И. Менделеева http://olimp.distant.ru/2013/otvety-13.htm).
В результате такого расположения гибридных электронных облаков молекула СО2 имеет линейное строение, т. е. ядра атомов кислорода и углерода располагаются на одной прямой. Получается, что в молекуле СО2 атом углерода соединён с двумя атомами кислорода с помощью двойных связей. Между центральным атомом углерода и двумя атомами кислорода образуются σ — связи за счёт sp- гибридных облаков атома углерода и р-облаков атомов кислорода, а π -связи образуются за счёт перекрывания р-облаков атома углерода и р-облаков атомов кислорода.
Задача 967.
Какие из перечисленных газов при пропускании их через раствор щелочи вступают с ней в реакцию: а) СО; б) СО2; в) НСN; г) СF4?
Решение:
а) Едкие щёлочи и монооксид углерода взаимодействуют друг с другом с образованием соли муравьиной кислоты:
CO + NaOH = HCООNa.
формиат
натрия
б) Действием диоксида углерода на растворы щелочей получают соли угольной кислоты:
Здесь проявляются кислотные свойства СО2, как кислотного оксида.
в) Как кислота НСN реагирует с NaOH (реакция нейтрализация):
HCN + NaOH = NaCN + H2O.
г) Фторид углерода не реагирует с гидроксидом натрия, реакция не протекает.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Составьте молекулярные и ионные уравнения гидролиза солей Cr2(SO4)3 и Na2SiO3. Какое значение рН (рН ≤ 7, рН ≥ 7) имеют растворы
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Ваш ответ
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

решение вопроса
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Похожие вопросы
- Все категории
- экономические 43,399
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,960
- разное 16,854
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📸 Видео
Реакции ионного обмена. 9 класс.Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Реакции ионного обмена. 9 класс.Скачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

Необратимый гидролиз. Примеры уравнений с объяснением.Скачать

Реакции ионного обменаСкачать

11 класс. Гидролиз солей.Скачать

Электролиз. 10 класс.Скачать

76. Гидролиз солей (часть 1)Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать