Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
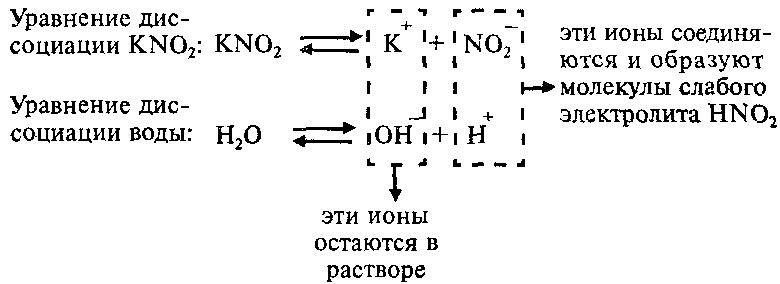
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
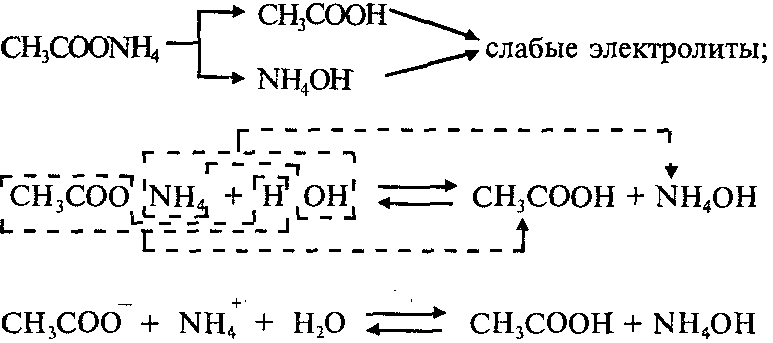
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
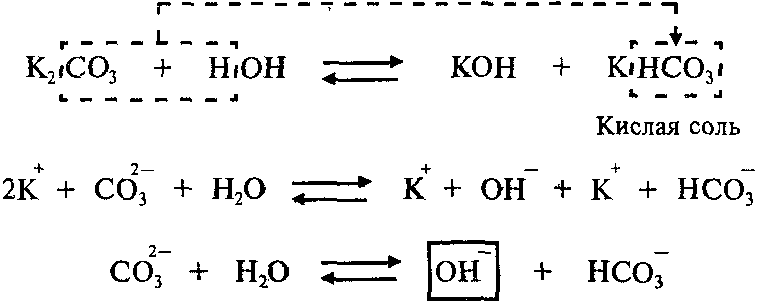
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Видео:Гидролиз солей. 9 класс.Скачать

Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Видео:Химия | Молекулярные и ионные уравненияСкачать

Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Гидролиз солей – процесс обратимый
Урок-лекция в 11 классах с углубленным изучением химии
Цели.
- На основе мотивации и актуализации опорных знаний и навыков учащихся дать количественную характеристику реакции гидролиза, тем самым развивая представления о количественной стороне химических процессов.
- Активизируя такие приемы мышления, как сравнение и обобщение, способствовать развитию логического мышления учащихся, умению рассуждать, делать выводы, анализировать особенности протекания физических и химических процессов, обнаруживая сходство и различие.
- Активизируя внимание и наблюдательность учащихся, способствовать развитию мировоззренческих представлений о причинно-следственной взаимосвязи изучаемых и наблюдаемых явлений.
Ход урока
Слово «гидролиз» буквально означает «разложение водой». Гидролизом называется всякое взаимодействие вещества с водой обменного характера, при котором составные части вещества соединяются с составными частями воды. Например, сложные эфиры разлагаются водой с образованием смеси кислоты и спирта:
Хлорид фосфора(III) подвергается гидролизу, образуя фосфористую и соляную кислоты:
На практике особенно часто приходится иметь дело с гидролизом солей. Естественно предположить, что растворы средних солей, которые являются продуктами полного замещения протонов в молекулах кислот катионами металла, должны иметь нейтральную реакцию среды. Однако это предположение оказывается справедливым только в отношении солей, образованных сильными кислотами и сильными основаниями.
Соли, образованные слабой кислотой и сильным основанием или, наоборот, сильной кислотой и слабым основанием, не дают при растворении в воде нейтральной реакции среды. Например, раствор хлорида железа(III) дает кислую реакцию среды, указывающую на присутствие ионов водорода (ионов гидроксония); раствор карбоната натрия имеет щелочную среду, обусловленную присутствием в нем гидроксид-ионов.
Если соль образована слабой кислотой и слабым основанием, то реакция раствора зависит от относительной силы образующихся в результате гидролиза кислоты и основания. Например, из двух слабых электролитов, образующих цианид аммония, менее слабым электролитом является гидроксид аммония, что подтверждается значениями констант диссоциации: Кд(NH4OH)=1,79•10 –5 ; Кд(HCN) = 7,90•10 –10 . Значит, раствор цианида аммония будет слабощелочным. Раствор ацетата аммония будет нейтральным, т. к. константы диссоциации уксусной кислоты и гидроксида аммония почти одинаковы: Кд(CH3COOH)=1,86•10 –5 ; Кд(NH4OH) = 1,79•10 –5 .
Эти явления можно объяснить взаимодействием ионов растворенной соли с диполями воды, в результате которого образуется избыток водородных ионов (ионы гидроксония) или гидроксид-ионов.
Обратимая реакция обмена между ионами растворенной соли и ионами воды, приводящая к образованию малодиссоциированных частиц (молекулы или ионы), носит название гидролиза соли.
Количественно гидролиз солей может быть охарактеризован степенью гидролиза и константой гидролиза.
Константа гидролиза и степень гидролиза
1. Соль, образованная слабой кислотой и сильным основанием. Уравнение гидролиза соли ацетата натрия в молекулярной форме:
В ионной форме уравнение имеет вид:
Применяя к этому обратимому процессу закон действующих масс, запишем выражения для скоростей прямой и обратной реакций:
где k1 и k2 – константы скорости прямой и обратной реакций соответственно.
Как и любой другой обратимый процесс, реакция гидролиза заканчивается установлением химического равновесия, т. е. такого состояния системы, когда скорости прямой и обратной реакций равны: v1 = v2.
Константа химического равновесия К равна отношению константы скорости прямой реакции к константе скорости обратной реакции.
Концентрацию воды в растворе допускается считать величиной постоянной, поэтому объединим [НОН] и К.
где Кг – константа гидролиза.
где К(H2O) – ионное произведение воды.
Подставляя выражение для 
Тогда окончательно имеем:
Степенью гидролиза b называется отношение количества гидролизованной соли к общему количеству растворенной соли.
Определим степень гидролиза соли, образованной слабой кислотой и сильным основанием. Пусть в реакции гидролиза соли ацетата натрия начальная концентрация ее, а значит, и ацетат-ионов (т. к. соль – сильный электролит) равна с. Тогда равновесные концентрации примут значения:
Подставим эти выражения в уравнение константы гидролиза (1):
Воспользовавшись уравнением (2), получим:
Для многих солей b – величина небольшая (обычно b b» 1. Тогда уравнение (3) примет вид:
2. Соль, образованная сильной кислотой и слабым основанием. Уравнение гидролиза соли хлорида аммония в молекулярной форме:
В ионной форме уравнение имеет вид:
Применяя закон действующих масс, запишем:
В состоянии химического равновесия v1=v2, поэтому
Объединяя [НОН] и К, получим:
Известно, что
Подставим это выражение в уравнение (5) и получим:
имеем окончательное выражение:
Выведем уравнение для степени гидролиза соли, образованной слабым основанием и сильной кислотой.
Пусть в реакции гидролиза соли хлорида аммония ее начальная концентрация, а значит, и концентрация катионов аммония (т. к. соль – сильный электролит) равна с. Тогда равновесные концентрации приобретут значения:
Подставим эти выражения в уравнение для константы гидролиза (5):
Воспользовавшись уравнением (6), получим:
Допустив, что 1– b» 1, преобразуем уравнение (7):
3. Соль, образованная слабой кислотой и слабым основанием. Уравнение гидролиза соли цианида аммония в молекулярной и ионной формах:
Применим закон действующих масс к данному обратимому процессу:
В состоянии химического равновесия cкорость прямой реакции равна скорости обратной реакции:
Константа химического равновесия – это отношение константы скорости прямой реакции к константе скорости обратной реакции:
Как и в предыдущих случаях, объединим K и [НОН]:
Умножим числитель и знаменатель в уравнении (9) на величину ионного произведения воды:
преобразуем выражение для константы гидролиза (10).
В результате получим:
Выразим степень гидролиза соли, образованной слабой кислотой и слабым основанием.
Пусть исходная концентрация соли цианида аммония в реакции гидролиза равна с. Исходные концентрации катиона аммония и цианид-аниона также можно считать равными с (помня, что соль – сильный электролит). Тогда равновесные концентрации примут значения:
Подставляя выражения равновесных концентраций в уравнение константы гидролиза (9) получим:
Приравниваем правые части уравнений (11) и (12):
Из уравнений (4), (8), (13) следует, что степень гидролиза тем больше:
- чем больше величина К(H2O), т. е. чем выше температура, т. к. ионное произведение воды возрастает с повышением температуры;
- чем меньше константы диссоциации Кд электролитов, образующих соль, т. е. чем слабее электролиты, остатки которых входят в состав соли;
- чем меньше концентрация соли в растворе, т. е. чем больше степень разбавления раствора (вывод следует из уравнений (4) и (8)).
Например, при добавлении к раствору хлорида сурьмы(III) дистиллированной воды наблюдается образование осадка SbOCl, что свидетельствует о протекании реакции гидролиза соли SbCl3 по второй ступени. Именно вторая ступень гидролиза хлорида сурьмы(III) приводит к образованию основной соли Sb(ОН)2Сl, разложение которой и дает осадок хлорида оксосурьмы.
Таким образом, разбавляя раствор, смещаем равновесие реакции гидролиза вправо.
Если гидролиз – явление нежелательное, то работать следует с концентрированными растворами при пониженных температурах. Полезно также добавить к раствору соли избыток одного из образующихся при гидролизе продуктов (кислоты или щелочи, в зависимости от реакции среды раствора), тем самым способствуя смещению химического равновесия реакции влево в соответствии с принципом Ле Шателье.
Так, если к раствору с осадком SbОСl прилить соляную кислоту, то осадок растворится. Если затем вновь в раствор добавить воду, то наблюдается повторное образование осадка.
Описанные явления согласуются с ранее сделанными выводами о влиянии разбавления раствора на степень гидролиза, а также подтверждают обратимый характер процесса и возможность смещения химического равновесия реакции гидролиза.
📸 Видео
Гидролиз солей. Классификация солей. Решение примеров.Скачать

NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Химия. Молекулярные и ионные уравненияСкачать

хлорид аммония с гидроксидомСкачать

Химия | ГидролизСкачать

Гидролиз солейСкачать

Получение хлорида аммонияСкачать

Гидролиз солей.ПримерыСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ch0604 Примеры решения задачСкачать

11 класс. Химия. Гидролиз солейСкачать

гидролиз солейСкачать

Гидролиз солейСкачать

Урок № 3. ГидролизСкачать

Гидролизуем ХЛОРИД АЛЮМИНИЯСкачать

Химия. 9 класс. Гидролиз солей /02.10.2020/Скачать