FeSO4 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора сульфата железа (II)
- FeSO4 гидролиз решите пожалуйста?
- Что значит гидролиз по катиону, гидролиз по аниону?
- Как из FeSO₄ получить Fe?
- Знатоки гидролиза?
- Напишите молекулярное, ионное и сокращённое ионное уравнение реакции гидролиза хлорида аммония и гидролиза сульфида аллюминия?
- Помогите решить Гидролиз Na2CO3?
- Fe + CuSO₄⇒FeSO₄ + Cu Решите, пожалуйста?
- КАКОЙ БУДЕТ СРЕДА РАСТВОРА, ОБРАЗОВАВШЕГОСЯ В РЕЗУЛЬТАТЕ ГИДРОЛИЗА СОЛЕЙ Na₂SiO₃ И FeSO₄?
- Химия?
- Выберите формулу соли, которая НЕ подвергается гидролизу в водном растворе а) KCl б) Mg(NO₃)₂ в) FeSO₄ г) (NH₄)₂SO₄?
- Решите нахождение гидролиза?
- Гидролиз
- 📹 Видео
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Fe 2+ + 2SO4 2- + 2HOH ⇄ 2FeOH + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Fe 2+ + HOH ⇄ FeOH + + H +
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2FeOH + + SO4 2- + 2HOH ⇄ 2Fe(OH)2 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
FeOH + + HOH ⇄ Fe(OH)2 + H +
Видео:Гидролиз солей. 9 класс.Скачать

Среда и pH раствора сульфата железа (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

FeSO4 гидролиз решите пожалуйста?
Химия | 10 — 11 классы
FeSO4 гидролиз решите пожалуйста.
2FeSO4 + 2H2O = (FeOH)2SO4 + H2SO4
2Fe²⁺ + 2SO4²⁻ + 2H2O = 2FeOH⁺ + SO4²⁻ + 2H⁺ + SO4²⁻
2Fe²⁺ + 2H2O = 2FeOH⁺ + 2H⁺
Fe²⁺ + H2O = FeOH⁺ + H⁺
Соль образована слабым основанием и сильной кислотой, гидролиз идет по катиону, среда в растворе кислая.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Что значит гидролиз по катиону, гидролиз по аниону?
Что значит гидролиз по катиону, гидролиз по аниону?
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Как из FeSO₄ получить Fe?
Как из FeSO₄ получить Fe.
Видео:ГИДРОЛИЗ и определение СРЕДЫ РАСТВОРОВ! НОВОЕ 21 задание в ЕГЭ по ХИМИИ 2022Скачать

Знатоки гидролиза?
Помогите, пожалуйста, составить гидролиз хлорметана!
Видео:11 класс. Гидролиз солей.Скачать

Напишите молекулярное, ионное и сокращённое ионное уравнение реакции гидролиза хлорида аммония и гидролиза сульфида аллюминия?
Напишите молекулярное, ионное и сокращённое ионное уравнение реакции гидролиза хлорида аммония и гидролиза сульфида аллюминия.
Пожалуйста решите сегодня очень надо плиз = ).
Видео:Химия 8 класс: Гидролиз солейСкачать

Помогите решить Гидролиз Na2CO3?
Помогите решить Гидролиз Na2CO3.
Видео:Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Fe + CuSO₄⇒FeSO₄ + Cu Решите, пожалуйста?
Fe + CuSO₄⇒FeSO₄ + Cu Решите, пожалуйста!
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

КАКОЙ БУДЕТ СРЕДА РАСТВОРА, ОБРАЗОВАВШЕГОСЯ В РЕЗУЛЬТАТЕ ГИДРОЛИЗА СОЛЕЙ Na₂SiO₃ И FeSO₄?
КАКОЙ БУДЕТ СРЕДА РАСТВОРА, ОБРАЗОВАВШЕГОСЯ В РЕЗУЛЬТАТЕ ГИДРОЛИЗА СОЛЕЙ Na₂SiO₃ И FeSO₄?
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Химия?
Решите пожалуйста карточку.
Видео:Гидролиз солей. Практическая часть. 10 класс.Скачать

Выберите формулу соли, которая НЕ подвергается гидролизу в водном растворе а) KCl б) Mg(NO₃)₂ в) FeSO₄ г) (NH₄)₂SO₄?
Выберите формулу соли, которая НЕ подвергается гидролизу в водном растворе а) KCl б) Mg(NO₃)₂ в) FeSO₄ г) (NH₄)₂SO₄.
Видео:Химия | ГидролизСкачать

Решите нахождение гидролиза?
Решите нахождение гидролиза?
Вы зашли на страницу вопроса FeSO4 гидролиз решите пожалуйста?, который относится к категории Химия. По уровню сложности вопрос соответствует учебной программе для учащихся 10 — 11 классов. В этой же категории вы найдете ответ и на другие, похожие вопросы по теме, найти который можно с помощью автоматической системы «умный поиск». Интересную информацию можно найти в комментариях-ответах пользователей, с которыми есть обратная связь для обсуждения темы. Если предложенные варианты ответов не удовлетворяют, создайте свой вариант запроса в верхней строке.
3H2S + 2Al — >Al2S3 + 3H2 Na₂O + H2 — >не пойдет.
1) MgO оксид магния — основной оксид (MgSO₄) SiO₂ оксид кремния (ΙV) — кислотный оксид (Na₂SiO₃) NO оксид азота (II) — несолеобразующий FeO оксид железа (II) — амфотерный оксид (FeCl₂, Na₂[Fe(OH)₄]) Tl₂O₃ оксид таллия (III) — амфотерный оксид (Tl(NO₃..
Номер 1, 5, 6 изомеры номер 2, 3, 4 гомологи.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Гидролиз
Гидролиз (греч. hydor — вода и lysis — разрушение) — процесс расщепления молекул сложных химических веществ за счет реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз (вода) разрушает «слабое» — это правило вам очень пригодится.
Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl — производное основания NaOH и кислоты HCl
- KNO3 — производное основания KOH и кислоты HNO3
- CuSO4 — производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 — производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 — производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются слабыми, а какие — сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести нужный опыт — она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем интеллектуальном составляющем 😉
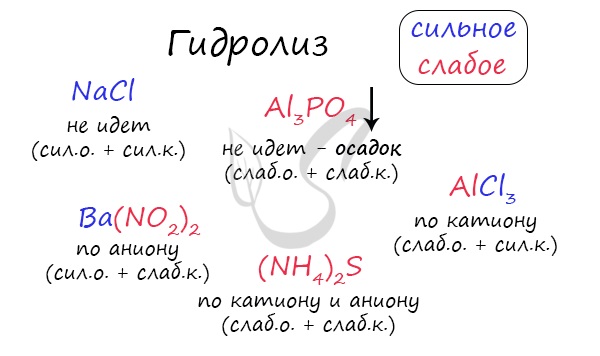
По катиону, по аниону или нет гидролиза?
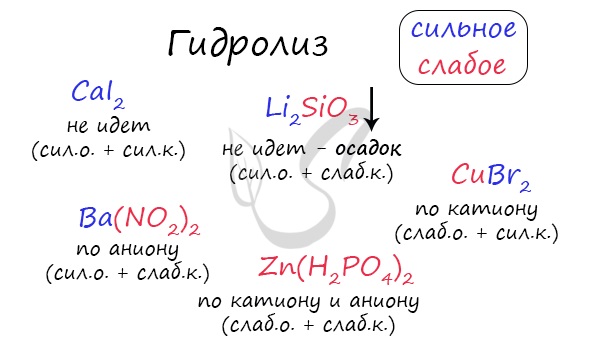
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты — гидролиза не происходит. Примеры: NaCl, KBr, CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4, FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз разрушает слабое, в данном случае — катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4 + и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2 не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4, NaNO2, Ca(OCl)2, Ba(CH3COO)2, Li2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2, Al2S3, Cr2(SO3)3, CH3COONH4.
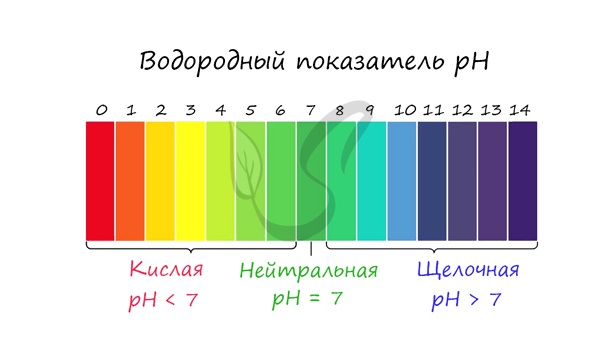
Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль, вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда раствора — нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда — кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры: NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.
Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили. Ниже будет располагаться решение.
С целью запутать в заданиях часто бывают даны синонимы. Так «среду раствора» могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH 7.
Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 — кислой (pH
📹 Видео
Всё про ГИДРОЛИЗ для ЕГЭ ПО ХИМИИ. с ЭКСПЕРИМЕНТАМИ!Скачать

Химическая реакция FeSO4 с KMnO4 и H2SO4Скачать

Химия. Химические реакции. Гидролиз. Центр онлайн-обучения «Фоксфорд»Скачать

Гидролиз солей.ПримерыСкачать

Составление ур-й окислительно-восст. реакций методом ионно-электронного баланса. 1ч. 10 класс.Скачать