Страницы работы
Содержание работы
1. Какая из перечисленных солей подвергается гидролизу: CuCl2, Na2SO4, Са(NОз)2? Рассчитать рН раствора, если концентрация этой соли равна 0.5 моль/л, а константа диссоциации основания равна Кь2 = 2.19 * 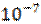
Сульфат натрия Na2SO4 и нитрат кальция Са(NОз)2 – соли сильных оснований и сильных кислот, поэтому гидролизу не подвергаются.
Гидролизоваться будет хлорид меди (2) CuCl2 – соль слабого основания (Cu(OH)2) и сильной кислоты (HCl). Гидролиз протекает по катиону, преимущественно по I ступени. Среда кислая.
Диссоциация хлорида меди (2):
Гидролиз хлорида меди по первой ступени:
Cu 2+ + H2O ↔ CuOH + + H +
Для солей, гидролизующихся по катиону, константа гидролиза Кг равна:
Кг = Kw/Kb, где Kw = 10 -14 – ионное произведение воды, Кb – константа диссоциации основания.
Т.к. гидролиз хлорида меди (2) протекает преимущественно по первой ступени, то для расчёта используем константу гидролиза по первой ступени, которая равна: Кг(1) = Kw/Kb(2)
Итак, рН для данного раствора равен:
2. Определите рН 0.1 М раствора плавиковой кислоты (HF), константа диссоциации которой равна Ка = 6.67*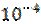
Плавиковая кислота – слабый электролит. Для слабых кислот концентрация водородных ионов в растворе рассчитывается по формуле:
рН = — lg[H + ] = — lg 8,17*10 -3 = 2,09
3. В какую сторону сместится равновесие реакции 2СО + O2 2СO2 а) при увеличении температуры (∆Н ; .
Диссоциация карбоната кальция:
Согласно уравнению диссоциации соли,
[Ca 2+ ] = √ПР = √(4,4*10 -9 ) = 6,63*10 -5 (моль/л)
Переведём концентрацию ионов кальция в г/л:
С = М*МВ = 6,63*10 -5 моль/л * 40 г/моль = 2,652*10 -3 г/л
(С – концентрация, выраженная в граммах растворённого вещества на литр раствора, М – молярная концентрация раствора, МВ – молярная масса катиона кальция)
Видео:Гидролиз солей. 9 класс.Скачать

Гидролиз хлорида меди (II)
CuCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
CuCl2 + HOH ⇄ CuOHCl + HCl
Полное ионное уравнение
Cu 2+ + 2Cl — + HOH ⇄ CuOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Cu 2+ + HOH ⇄ CuOH + + H +
Видео:Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
CuOHCl + HOH ⇄ Cu(OH)2 + HCl
Полное ионное уравнение
CuOH + + Cl — + HOH ⇄ Cu(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
CuOH + + HOH ⇄ Cu(OH)2 + H +
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Среда и pH раствора хлорида меди (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Ступенчатый гидролиз по катиону. Слабое основание + сильная кислотаСкачать

Гидролиз соли СuCl2, образованной слабым основанием и сильной кислотой

Анионы хлора не принимают участия в реакциях, поскольку не образуют с водой слабого электролита. Т. к. заряд катиона меди равен «2+» то стадий гидролиза будет также две. Водный раствор будет иметь кислую реакцию, так как взаимодействие ионов слабого основания Сu2+ с водой приведет к смещению равновесия диссоциации воды и к образованию свободных протонов водорода:
1 стадия гидролиза:
Краткое ионно-молекулярное уравнение: Сu2+ + HOH ↔ CuOH+ + H+
Полное ионно-молекулярное уравнение: Сu2++2Cl-+H2O↔CuOH++H++2Cl-
Молекулярное уравнение: CuCl2 + H2O↔ CuOHCl + HCl
2 стадия гидролиза
Краткое ионно-молекулярное уравнение: СuOH+ + HOH ↔ Cu(OH)2 + H+
Полное ионно-молекулярное уравнение: СuOH++Cl-+HOH↔Cu(OH)2+H++Cl-
Молекулярное уравнение: CuOHCl + H2O ↔ Cu(OH)2 + HCl
Запишем выражение для константа равновесия процесса гидролиза по второй стадии исходя из краткого ионного уравнения:
Поскольку концентрация воды величина практически постоянная, то умножив константу равновесия на величину [H2O], получаем Кгидролиза по 2 ступени
Кгидролиза по 2 ступени =
Из ионного произведения воды Кw = [H+] [OH-] выразим концентрацию [H+]:

Для того, чтобы понять, что представляет величина 
1 ступень: Сu(OH)2 ↔ CuOH+ + OH — Кb(1 ступени) =
2 ступень CuOH+ ↔ Cu 2+ + OH — Кb(2 ступени) =
Очевидно, что 
Следовательно, 
Кислую реакцию среды соли CuCl2 подтвердим расчетами, то есть определим pH раствора, зная, что С(CuCl2)= 0,001 моль/л.
Прежде всего найдем константу гидролиза Кг2, для этого воспользуемся значением константы диссоциации меди гидроксида (Кb1 = 3,4·10-7), ионное произведение воды Кw = 10-14: Кг2 = Кw / Кb1 = 10-14 /(3,4·10-7) = 2,9·10-8



Для вычисления pH следует принять во внимание, что в результате гидролиза каждого катиона Cu2+ образуется один ион H+. Если исходная концентрация гидролизующихся катионов была С моль/л, а гидролизу подверглась доля β этих катионов, то при этом образовалось βС моль/л ионов H+.
Таким образом, [H+] = β·СBaS = 5,38·10-3 ·0,001= 5,38·10-6 моль/л
Следовательно, рH = – lg [H+] = – lg 5,38·10-6 = 5,26
Выполненные расчеты подтвердили, что соль CuCl2 имеет кислую реакцию среды.
📹 Видео
Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Гидролиз солей. 2 часть. 11 класс.Скачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

76. Гидролиз солей (часть 1)Скачать

11 класс. Гидролиз солей.Скачать

Константа гидролиза и pH водного раствора солиСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Степень гидролиза и как её рассчитатьСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Гидролиз солей. Задание №23 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать










