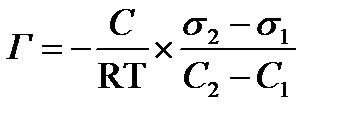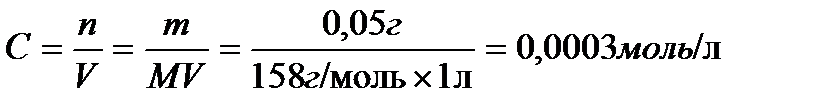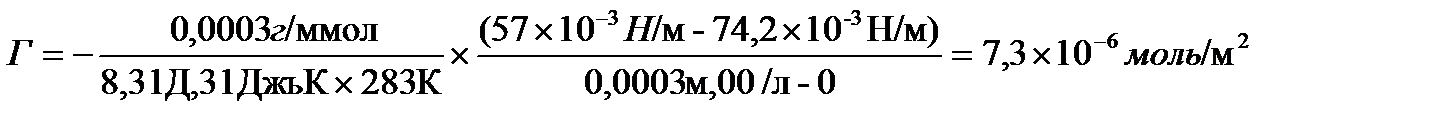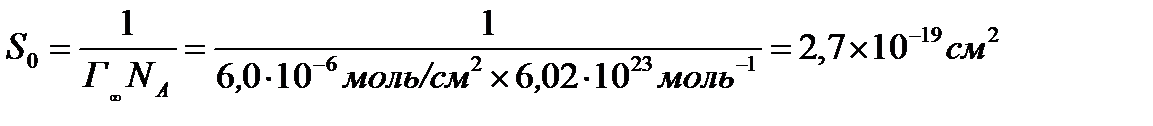Задача 1.Определить величину адсорбции при 10 0 С для раствора, содержащего 0,05 г в литре нонановой (пеларгоновой) кислоты C8H17COOH. Поверхностное натяжение воды при данной температуре 74,2×10 -3 н/м, а исследуемого раствора 57× 10 -3 Н/м
Решение: Уравнение Гиббса для адсорбции на границе жидкость-газ имеет вид:
Определяем концентрацию кислоты в растворе
Ответ:Г=7,3×10 -6 моль/м 2
Задача 2.Пользуясь правилом Дюкло-Траубе, определите во сколько раз поверхностная активность пальмитиновой кислоты (С15Н31СООН) меньше поверхностной активности арахиновой кислоты (С19Н39СООН).
Решение: Согласно правилу Дюкло-Траубе — при увеличении углеводородного радикала на одну метиленовую группу -СН2— поверхностная активность увеличивается в 3,2 раза, то в нашем случае
¾¾¾¾¾¾¾ = 3,2 4 = 104,85 раза.
Ответ:увеличивается в104,85 раза
Задача 3.Найдите площадь, приходящуюся на одну молекулу в насыщенном адсорбционном слое анилина на поверхности его водного раствора, если предельная адсорбция равна 6,0 × 10 -6 моль/см 2
Решение:
Ответ:S0= 2,7×10 -19 см 2
Задание 4. Опишите поведение приведенных ниже структур в системе вода-липид. В каком качестве они применяются медицине (в хирургии, в частности).
I – бензалкония хлорид (N-бензил-N, N-диметил-N- октадецил аммония хлорид);
II –цистеинилэтил-N, N -диметил-N-цетил аммония хлорид
Ответ: Соединения в своей структуре содержат катион (гидрофильный фрагмент молекулы, склонный растворяться в воде) (полярная головка) и длинный углеводородный «хвост», имеющий гидрофобные свойства (стремящийся максимально отдалиться от воды). В связи с особенностями своего строения соединения обладают дифильными свойствами. Они легко встраиваются в биологические мембраны вирусов и бактерий и способствуют их гибели за счет разрушения биологических мембран. Применяются в медицине, в том числе в хирургии, в качестве антисептических и фунгицидных средств.
Дата добавления: 2015-10-19 ; просмотров: 1011 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
УРАВНЕНИЕ АДСОРБЦИИ ГИББСА
Видео:5.1. Адсорбция. Классификация адсорбцииСкачать

Выше (п. 2.4) мы пришли к выводу, что процесс адсорбции обусловлен снижением поверхностного натяжения. Очевидно, чем в большей степени ПАВ снижает поверхностное натяжение, тем большей должна быть его адсорбция. Напротив, ПИВ должна быть присуща отрицательная адсорбция.
Исходя из второго закона термодинамики американский ученый Дж. Гиббс в 70–х гг. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора:

где Гi, – избыточная адсорбция i-го компонента (см. 2.10), ci – его молярная концентрация в растворе, Т – температура, при которой происходит адсорбция, R – газовая постоянная, 
В такой форме уравнение Гиббса применяется для разбавленных растворов. Вы, очевидно, помните, что для концентрированных растворов концентрацию нужно заменить активностью:

Уравнение Гиббса было выведено теоретически. В дальнейшем оно было подтверждено экспериментально Мак–Беном методом среза тонких слоев с последующим их химическим анализом. Аналогичные исследования были проведены Сазаки с использованием метода радиоактивных индикаторов.
Проанализируем уравнение Гиббса.
Если 

Рис. 3.2. Определение избыточной адсорбции
Рис. 3.3. Изотерма адсорбции
Значение избыточной адсорбции для любой концентрации
| сi |  | Zi | Гi | сi |  | Zi | Гi |
| c1 |  1 1 | Z1 | Г1 | c4 |  4 4 | Z4 | Г4 |
| c2 |  2 2 | Z2 | Г2 | … | … | … | … |
| c3 |  3 3 | Z3 | Г3 | … | … | … | … |
ПОВЕРХНОСТНАЯ АКТИВНОСТЬ.
ПРАВИЛО ДЮКЛО-ТРАУБЕ
Из уравнения Гиббса следует, что характеристикой поведения вещества при адсорбции является величина производной 


[g] = Дж–м 3 /м 2 -моль = Дж–м/моль или Н-м 2 /моль.
Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества, и тем больше его гиббсовская адсорбция.
Поверхностную активность можно определить графически как отрицательное значение тангенса угла наклона касательной, проведенной к кривой 
Таким образом, для ПАВ: g > 0; 
2. В гомологическом ряду прослеживаются четкие закономерности в изменении поверхностной активности (g): она возрастает по мере увеличения длины углеводородного радикала.
На основании большого экспериментального материала в конце XIX в. Дюкло и Траубе сформулировали правило:
Поверхностная активность предельных жирных кислот в водных растворах возрастает в 3–3,5 раза при удлинении углеводородной цепи на одно звено (группу –CH2).
На рис. 3.4 приведены изотермы поверхностного натяжения для ряда кислот.
Рис.3.4. Изотерма поверхностного натяжения некоторых кислот
1 – СН3СООН – уксусная кислота (nс=1); 2 – СН3СН2СООН – пропионовая кислота (nс =2); 3 – СН3(СН2)2СООН – масляная кислота (nс =3); 4 – СН3(СН2)3СООН – изовалериановая кислота (nс = 4); 5 – СН3(СН2)4СООН – капроновая кислота (nс =5); nс – число атомтов С в углеводородном радикале.
Рис. 3.6 Ориентация молекул ПАВ на поверхности водного раствора
Видео:Решение задач на вычисление энергии Гиббса. 1 часть. 10 класс.Скачать

а – при малых концентрациях; б – при умеренных концентрациях; в – в насыщенном адсорбционном слое.
При малых концентрациях углеводородные цепи, вытолкнутые в воздух, «плавают» на поверхности воды, тогда как полярная группа погружена в воду (рис. 3.6а), такое положение возможно из-за гибкости углеродной цепи. С ростом концентрации число молекул в поверхностном слое увеличивается, цепи поднимаются. Какие-то из них принимают вертикальное положение (рис. 3.6б). В насыщенном адсорбционном слое поверхность воды оказывается сплошь покрытой «частоколом» из вертикально ориентированных молекул ПАВ (рис. 3.6в), значение поверхностного натяжения в этом случае приближается к значению, характерному для чистого жидкого ПАВ на границе с воздухом.
Из-за вертикальной ориентации молекул ПАВ в поверхностном слое максимальная адсорбция ( 
Экспериментально найденная величина 
Предельная избыточная адсорбция ПАВ равна:

где 

где Na — число Авогадро.
Подставляя полученное значение S1,2 в уравнение (3.5), получаем


Так было найдено, что поперечный размер So молекул всех жирных кислот равен 20 * 10 -16 см 2 , а предельных спиртов – 25 * 10 -16 см 2 . Из величины предельной адсорбции была найдена также длина молекулы 
Масса 1 см 2 поверхностного слоя равна
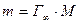
где М – молярная масса ПАВ.
В то же время плотность

так как объем 1 см 3 поверхностного слоя равен 

Экспериментальные данные показали, что длина молекулы ПАВ 

Таким образом, размеры молекул впервые в истории химии были определены коллоидно-химическим методом. В дальнейшем эти результаты были подтверждены другими методами.
УРАВНЕНИЕ ШИШКОВСКОГО
В 1908 г. киевский ученый Б. А. Шишковский эмпирическим путем получил уравнение, связывающее поверхностное натяжение водных растворов ПАВ с их концентрацией:

где 

Для того чтобы выяснить физический смысл постоянной В, обратимся к.уравнению Гиббса:

Разделим переменные и примем, что
Интегрируем это уравнение, принимая во внимание, что . 

где А – постоянная интегрирования.
Уравнение (3.12) получено в результате преобразования уравнения Гиббса для предельной адсорбции. Теперь для этих же условий запишем уравнение Шишковского, принимая во внимание, что максимальная адсорбция может быть достигнута при достаточно больших концентрациях ПАВ.
Тогда с >> 1, Кс >> 1 и 1 + Кс 

Сравнивая уравнения (3.13) и (3.12), видим, что

Теперь становится понятным, почему величина В в уравнении Шишковского остается постоянной в пределах одного гомологического ряда.
Однако смысл удельной капиллярной постоянной К пока остается неясным
ТЕОРИЯ МОНОМОЛЕКУЛЯРНОЙ
Видео:Адсорбция на поверхностях растворовСкачать

АДСОРБЦИИ ЛЕНГМЮРА
Отметим основные положения этой теории.
1. Адсорбция мономолекулярна.
2. При адсорбции устанавливается динамическое равновесие, которое можно рассматривать как квазихимическое. В условиях равновесия скорости процессов адсорбции и десорбции равны.
Константа адсорбционного равновесия

где кадс – константа скорости адсорбции; кдес – константа скорости десорбции.
Исходя из данной теории было выведено уравнение, которое мы приводим без вывода:

где 
Зависимость величины адсорбции от концентрации представлена на рис.3.7.
На кривой четко видны три участка:
I участок – прямая линия, выходящая из начала координат. Действительно, из уравнения Ленгмюра (3.15) при малых концентрациях Кс > 1 и 1 + Кс 
II участок – соответствует криволинейной части графика и описывается полным eравнением Ленгмюра (3.15).
Рис.3.7. Зависимость адсорбции от концентрации ПАВ.
Чтобы найти постоянные в уравнении Ленгмюра, его следует привести к линейной форме. Для этого правую и левую части уравнения надо «перевернуть»:

Умножим обе части уравнения (3.16) на с:

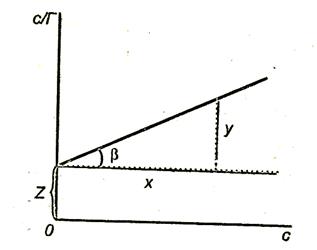
На рис. 3.8. показан график 
Тангенс угла наклона 
Отрезок, отсекаемый прямой на оси ординат,
Рис.3.8. Зависимость величины с/Г от концентрации ПАВ.
Доказано, что К в уравнении Шишковского (удельная капиллярная постоянная) и К в уравнении Ленгмюра (константа адсорбционного равновесия) – это одна и та же величина.
Построив график 

Так как адсорбция рассматривается как псевдохимическая реакция, на основе химической термодинамики можно записать

где Аmах – работа адсорбции.
Видео:Свободная энергия Гиббса. 10 класс.Скачать

Шишковский эмпирическим путем установил, что константа К увеличивается в 3–3,5 раза при удлинении цепи на одно звено –СН2.
Напишем выражение для разности работ адсорбции двух соседних членов гомологического ряда.
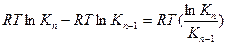

где n – число атомов углерода в углеводородном радикале.
Это означает, что для перевода каждой –СН2–группы из поверхностного слоя в объемную фазу надо затратить 3,2 кДж/моль энергии. Это работа раздвижения диполей воды на величину объема –СН2–группы – величина аддитивная и одинаковая для различных рядов алифатических предельных соединений. Постоянная разность работ адсорбции для двух соседних членов превращается в постоянное отношение (3–3,5), фигурирующее в правиле Дюкло–Траубе. Сущность этого правила, таким образом, заключается в том, что работа адсорбции на каждую –СН2–группу является постоянной, близкой к 3,5 кДж/молъ.
В заключение отметим, что помимо уравнения Гиббса, Шишковского и Ленгмюра существует уравнение Фрумкина, позволяющее рассчитать изменение поверхностного натяжения в результате адсорбции:

ЗАКЛЮЧЕНИЕ
Адсорбция поверхностно-активных веществ (ПАВ) на поверхности «жидкий раствор–газ» – самопроизвольный процесс, обусловленный уменьшением поверхностного натяжения. Для поверхностно-инактивных веществ (ПИВ), повышающих поверхностное натяжение, характерна отрицательная адсорбция.
Основным уравнением адсорбции является уравнение Гиббса, связывающее величину избыточной адсорбции с концентрацией ПАВ и его поверхностной активностью. Кривая, выражающая зависимость поверхностного натяжения от концентрации ПАВ при постоянной температуре, называется изотермой поверхностного натяжения. Тангенс угла наклона к оси абсцисс касательной к изотерме поверхностного натяжения при с 
Поверхностная активность ПАВ, согласно теории Ленгмюра, обусловлена дифильным строением их молекул: полярные группы втягиваются в глубь фазы, а неполярные углеводородные части выталкиваются в неполярную среду (воздух, газ), снижая тем самым поверхностное натяжение. С увеличением углеродной цепи на одну –СН2–группу поверхностная активность увеличивается в 3-3,5 раза (правило Дюкло–Траубе). Исходя из теории Ленгмюра, были впервые рассчитаны площадь, занимаемая одной молекулой, и длина молекулы ПАВ.
Зависимость величины адсорбции ПАВ от концентрации выражается уравнением Ленгмюра, выведенным исходя из представлений о скоростях процессов адсорбции и десорбции. Соответствующий график Г = f(с) называется изотермой Ленгмюра.
Изменение поверхностного натяжения в зависимости от адсорбции рассчитываются по уравнению Фрумкина.
ВОПРОСЫ И ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ
1. Какие вещества называются поверхностно-активными, поверхностно-инактивными?
2. В чем состоят особенности строения молекул ПАВ и ПИВ и их адсорбции?
3. Как зависит поверхностное натяжение от концентрации ПАВ в растворе?
4. Что называется поверхностной активностью? Как ее можно определить графически и аналитически?
5. В чем заключается правило Дюкло–Траубе?
6. Как графически и аналитически можно определить предельную адсорбцию?
7. Как рассчитать площадь, занимаемую молекулой, и толщину поверхностного слоя?
Видео:Решение задач с помощью уравнений. Видеоурок 29. Математика 6 классСкачать

8. Для водных растворов изоамилового спирта константы уравнения Шишковского: В = 21,12 * 1СГ 3 Дж/м 2 ; К = 42,0 м 3 /кмоль. Поверхностное натяжение чистой воды при заданной температуре равно 72,9 * 10 -3 Дж/м 2 :
а) определите поверхностное натяжение растворов концентраций: 0,012; 0,016; … 0,032 кмоль/м 3 ,
б) постройте изотерму поверхностного натяжения,
в) определите графически поверхностную активность спирта,
г) по уравнению Гиббса вычислите адсорбцию спирта для заданных в п. а) концентраций,
д) постройте изотерму адсорбции и определите графи чески предельную адсорбцию,
е) определите площадь, занимаемую одной молекулой спирта в поверхностном слое.
9. Сравните поверхностную активность этанола и н-бутанола в водных растворах одинаковой концентрации.
10 Изотерма адсорбции ПАВ описывается уравнением Ленгмюра Г=Гmах*(Кс/(1 + Кс)). Найдите графическим методом константы Гmах и К.
11. Предельная адсорбция пропионовой кислоты равна 4,18 * 10 -6 моль/м 2 . Рассчитайте значение константы В в уравнении Шишковского, при стандартной температуре.
Закончив изучение главы 3, вы должны
1. понятия «поверхностно–активные» и «поверхностно-инактивные» вещества, «поверхностная активность»;
2. от чего зависит поверхностная активность ПАВ;
3. сущность теории мономолекулярной адсорбции Ленгмюра;
4. уравнения Гиббса, Шишковского, Ленгмюра, Фрумкина, какие зависимости каждое из них выражает;
1. строить изотерму поверхностного натяжения и определять графически поверхностную активность;
2. рассчитывать поверхностную активность по уравнению Гиббса;
3. рассчитывать поверхностное натяжение по уравнению Шишковского;
Видео:Адсорбция на твёрдой поверхностиСкачать

4. строить изотерму гиббсовской адсорбции и определять предельную адсорбцию ПАВ;
5. исходя из предельной адсорбции рассчитывать поперечный размер So и длину молекул 
📹 Видео
Решение задач на термохимические уравнения. 8 класс.Скачать

Поверхностные явления. Адсорбция.Скачать

Закон Гесса. Практическая часть. 10 класс.Скачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Использование уравнения Аррениуса для решения задач (1/2). Химия для поступающих.Скачать

Уравнение. Практическая часть - решение задачи. 1 часть. 5 класс.Скачать

Решение задач с помощью уравнений.Скачать

Лекция 87 Количественное описание адсорбцииСкачать

АдсорбцияСкачать

Свободная энергия Гиббса и самопроизвольные реакции (видео 8) | Энергия| БиологияСкачать

СорбцияСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Решение задач с помощью уравненийСкачать

Уравнение. Практическая часть - решение задачи. 2 часть. 5 класс.Скачать