В попытках устранить недостатки теории активных столкновений ученые предложили новую теорию химической кинетики. Это сделали практически одновременно в 1935 году, более чем через полвека после открытий Аррениуса, Г.Эйринг (США) с одной стороны, а также М.Поляни и М.Г.Эванс (Великобритания) — с другой. Они предположили, что химическая реакция между началом и завершением претерпевает некое «переходное состояние», как его назвали Эванс и Поляни, при котором образуется неустойчивый «активированный комплекс» (термин Эйринга). Энергия активации как раз и требуется для достижения этого состояния, при котором вероятность успешного завершения реакции весьма велика. Поэтому энергия активации и может быть меньшей, чем энергия разрыва исходных химических связей.
 |  | |
Суть теории переходного состояния (активированного комплекса):
1) частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
Время существования активированного комплекса равно периоду колебания одной молекулы ( 10 -13 с), поэтому он не может быть обнаружен экспериментально и, соответственно, его нельзя выделить и изучить. Следовательно, доказать истинность теории переходного состояния можно только с помощью расчетов. И для этой цели ученые задействовали самую передовую на тот момент методику, которая тогда переживала бурный расцвет — квантовую химию. Выделилось даже целое направление в квантовой химии по расчетам энергии переходного состояния.
Теория переходного состояния
Теория активных столкновений не в состоянии объяснить аномально медленное течение ряда реакций. Это объясняется тем, что она ограничивается чисто механическим рассмотрением столкновений молекул и не учитывает возможность последних участвовать во вращательном и колебательном движениях.
Кроме того, из термодинамических соображений следует, что стерический фактор должен быть связан с изменением энтропии в ходе химического превращения, так как меняется конфигурация размещения молекул в пространстве, что тоже не объясняет теория активных столкновений.
Развитию теории переходного состояния, называемой еще теорией активного комплекса, положили работы Эйринга и Поляни (1935 г.), в которых использованы основные представления теории активных столкновений и необходимость преодоления энергетического барьера в ходе химического превращения.
Основные положения теории: всякая химическая реакция протекает через образование некоторого активного комплекса. который затем распадается с образованием конечных продуктов химической реакции.
Так, например, реакцию А + ВС = АВ + С можно представить следующим образом:
 |
Следовательно, в ходе этой реакции реагирующие частицы образуют вначале некоторый малоустойчивый комплекс атомов А, В и С, который распадается на частицы конечных продуктов реакции.
Современная физика позволяет оценить энергию реагирующей системы (W) как функцию расстояний между атомами (rAB и rBC). Так как энергия зависит от двух переменных, то ее изменение изображается в трехмерном пространстве W — rAB — rBС. Проекция этой диаграммы на плоскость с координатами rAB и rBC имеет вид, представленный рисунком 10.3.
| Рис. 10.3. Энергетическая диаграмма. |
Исходное состояние системы (т.а): атом А и молекула ВС, то есть rAB = 
Конечное состояние системы (т. 

Точка b соответствует состоянию системы с разообщенными атомами А, В, С, а точка П состоянию, когда все три атома сближены и образуют как бы единую молекулу — активный комплекс.
Линии, нанесенные на диаграмму и обозначенные цифрами — изоэнергетические линии, поэтому исходное и конечное состояния находятся в энергетических “долинах”, а точка b — на энергетическом “плато”.
В процессе химической реакции система из трех атомов должна перейти из состояния т. а в состояние т. 
На этом пути имеется энергетический “перевал” — точка П, определяющая энергию образования активного комплекса или переходного состояния, для которого rAB = rBС. В переходном состоянии система обладает максимальной потенциальной энергией на наиболее выгодном пути реакции. Эта максимальная энергия и есть энергия активации химической реакции.
Видео:Кинетика || Лекция 20 || Теория переходного состояния, уравнение Эйринга, истинная энергия активацииСкачать

Таким образом, чтобы реакция произошла, энергия реагирующей системы должна позволить образоваться переходному состоянию. Вероятность осуществления химической реакции связывается с вероятностью образования переходного состояния, что открывает путь использования статистических методов для расчета скорости химической реакции.
В разработанной Эйрингом и Поляни теории переходного состояния принимается, что исходные продукты химической реакции находятся в равновесии с активными комплексами. Поэтому переходное состояние можно рассматривать как обыкновенную молекулу, имеющую кроме обычных трех степеней свободы поступательного движения четвертую степень свободы, связанную с движением вдоль пути (координаты) реакции.
Для рассмотренной выше реакции вида:
скорость реакции прямо пропорциональна произведению средней линейной концентрации 


где 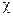
Из (10.32) следует:
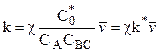
где 
Из молекулярно-кинетической теории следует:

где k — постоянная Больцмана;
h = 6,626 

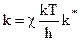
то есть константа скорости реакции образования активного комплекса пропорциональна константе равновесия реакции его образования.
На основе термодинамического метода:

где 
Учитывая, что 

где 

Уравнение (10.35) с учетом (10.37) примет вид:

Из уравнения (10.38) следует, что скорость химической реакции определяется изменением энергии Гиббса или Гельмгольца при переходе молекул исходных продуктов реакции в активный комплекс. Энергия активации в теории переходного состояния заменяется изменением энтальпии 

Зависимость скорости реакции не только от энергии активации, но и от энтропии активации, позволяет объяснить существование медленных реакций , имеющих малую энергию активации. быстрых реакций с большой энергией активации, различие скоростей реакции с одинаковыми энергиями активации.
Теория активного комплекса применима к реакциям, протекающим в растворах, тогда как теория столкновений хорошо описывает только реакции, протекающие в газовой фазе. Дело в том, что молекулы реагентов в жидкости находятся на более близком расстоянии, когда силы взаимодействия между ними нельзя считать малыми или даже отсутствующими, что часто допустимо в газах. В некоторых случаях растворитель не играет значительной роли, а в других, наоборот, сильно влияет на скорость реакции. Скорости реакций в растворах могут сильно отличаться от рассчитанных по теории активных столкновений как в ту, так и в другую сторону. Стерический фактор при этом может быть больше единицы как в реакциях между заряженными частицами, так и много меньше.
XI. Гетерогенные процессы.
Гетерогенными называются процессы, протекающие на поверхности раздела соприкасающихся фаз. К ним относятся химические процессы между веществами, находящимися в различных фазах, горение топлива, окисление металлов кислородом воздуха и многие физические процессы: растворение газов и твердых тел в жидкостях, кристаллизация чистых жидкостей и растворов и др.
Одна из особенностей гетерогенных процессов — зависимость их течения от размеров и состояния поверхности раздела фаз, а также от скорости их относительного движения.
Другая особенность состоит в многостадийности гетерогенных процессов. Кроме основного процесса — химической реакции, протекающей на самой поверхности раздела фаз, обязательны стадии подвода к этой поверхности исходных продуктов и отвод от нее конечных продуктов (стадии транспорта или массопереноса). Так как эти стадии последовательны, то скорость гетерогенного процесса определяется скоростью наиболее медленной стадии. Если определяющей стадией является сама химическая реакция, то говорят о кинетической области контроля процесса. Когда наиболее медленными стадиями являются стадии массопереноса путем диффузии, гетерогенный процесс считается протекающим в диффузионной области контроля.
Так как температура сильнее влияет на скорость химических процессов, чем на диффузию, то при изменении температуры гетерогенный процесс может перейти из кинетической области в диффузионную.
Видео:Лекция 15.12.20 | Теория переходного состояния, вывод уравнения Эйринга | Химическая кинетикаСкачать

Диффузия, как один из способов массопереноса, имеет большое значение в гетерогенных процессах. Известны два закона диффузии.
Первый закон Фика утверждает, что масса вещества dm, переносимого диффузией в направлении некоторой оси x через перпендикулярную этому направлению площадку S за время 


где D — коэффициент диффузии, м/с 2 .
Знак “минус” в (11.1) показывает, что диффузия направлена в сторону уменьшения концентрации.
На основании (11.1) можно установить скорость диффузии:

Зависимость концентрации от времени для фиксированного сечения устанавливается вторым законом Фика:

Диффузия имеет стационарный характер, когда концентрация изменяется только с расстоянием, а от времени не зависит:


где С0 соответствует координате x = 0.
Из (11.4) следует, что при стационарной диффузии концентрация линейно изменяется вдоль направления диффузии, а градиент концентраций записывается с помощью конечных величин:

где 
Подставляя (11.5) в уравнение (11.2), можно определить скорость стационарной диффузии:
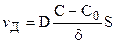
Иногда эту формулу записывают так:

где 
Пусть гетерогенная реакция, включающая химическую реакцию первого порядка и протекающая стационарно, имеет лишь две последовательные стадии: собственно химическую реакцию и процесс диффузии, которым обеспечивается транспорт реагентов в зону химической реакции. Причем отвод конечных продуктов реакции осуществляется очень быстро и его можно не учитывать.
Вследствие стационарности данного процесса на поверхности раздела фаз не происходит накопления исходных или конечных продуктов, поэтому скорости обеих стадий одинаковы. Из условия стационарности 

Тогда скорость реакции вычислится:


где 

Если k >> 




Более общим является влияние на скорость суммарного процесса обеих рассматриваемых стадий, роль которых зависит от особенностей реакции и внешних условий. Так, при понижении температуры и перемешивании влияние диффузии понижается.
Глава XII. Цепные реакции.
Цепными называются реакции. которые протекают с участием свободных атомов, радикалов или иных активных частиц, исчезающих и вновь возникающих в отдельных элементарных актах, и состоящие из большого числа повторяющихся стадий.
Изучение этих реакций имеет большое значение для исследования процессов горения, крекинга нефти, производства пластмасс, ядерных процессов. Теория цепных реакций разрабатывалась В. Нернстом, М. Боденштейном, С. Гиншелвудом, Н.Н. Семеновым и его школой.
Видео:ЛЕКЦИЯ №16 || Химическая кинетика || Теория переходного состояния, вывод уравнения ЭйрингаСкачать

Для цепных реакций наблюдается ряд закономерностей, не позволяющий объяснить механизм их протекания простой перегруппировкой атомов. К ним относятся зависимость скорости цепной реакции от размера, формы и материала сосуда, в котором находится реакционная смесь; зависимость скорости реакции от ничтожных добавок посторонних веществ; резкое увеличение скорости процесса для определенного интервала давлений и др.
Существование свободных радикалов обнаруживают, используя спектроскопические методы, метод электронного парамагнитного резонанса, химический метод и т.д.
Типичным примером цепной реакции служит реакция взаимодействия хлора с водородом на свету. Если хотя бы очень кратковременно подвергнуть смесь (Н2 + Сl2) интенсивному освещению, то происходит быстрая реакция образования HCl. Эта реакция начинается через некоторое время после начала освещения и продолжается после его прекращения.
Нернст предложил следующий механизм этой реакции. Сначала происходит взаимодействие фотонов с молекулами хлора, приводящее к образованию свободных радикалов — атомов хлора:

Реакции, в результате которых возникают первичные активные частицы, называются зарождением цепи.
Затем следует цепь элементарных реакций превращения исходных продуктов в конечные, протекающих с участием свободных радикалов (развитие цепи):


Эта группа реакций повторяется многократно.
В результате столкновения активных частиц происходит обрыв цепи:

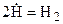
Рассмотренная выше реакция синтеза HCl является примером простой цепи. В этом случае число первоначально возникших активных частиц не изменяется: взамен какой-либо одной активной частицы, вступившей в отдельную стадию, образуется новая активная частица, являющаяся продуктом этой стадии.
Если N0 — число активных частиц, возникающих в реакционном объеме в одну секунду, то скорость процесса с простой цепью определится из выражения:

где 

Из (12.1) очевидно, что чем больше вероятность гибели активной частицы, тем меньше скорость цепной химической реакции.
Когда расход одной или нескольких активных частиц приводит к образованию большого числа таких же частиц, цепная реакция называется разветвленной. Примером разветвленной цепной реакции является реакция горения водорода:
Для зарождения цепи при высокой температуре достаточно прямого взаимодействия водорода с кислородом. Особенностью развития цепи является то, что поглощение одного атома 



Если 

где 
 |
Очевидно, что если 

| Рис. 12.1. Зависимость скорости цепной реакции от давления. |
Весьма своеобразной является зависимость скорости разветвления цепных реакций от давления. Первоначально не идущая реакция с повышением давления может принять взрывной характер, но при еще больших давлениях опять прекратиться. Это объясняется тем, что при малых давлениях столкновения между частицами газа редки, а активные частицы, достигая стенок сосуда, поглощаются ими. С другой стороны, при слишком высоких давлениях часто происходят тройные столкновения, также приводящие к прекращению реакции. И лишь только в некотором интервале средних давлений обрывы цепей как на стенках сосуда, так и в объеме смеси малы и разветвленная цепь может вовлечь большое число молекул реагентов и даже протекать со взрывом (рис. 12.1).
Давления, при которых происходит резкое увеличение скорости цепных реакций, называются верхним и нижним пределами самовоспламенения или взрываемости.
Так как при малых давлениях решающее значение имеют обрывы на стенках, нижний предел воспламенения (Р1) заметно зависит от материала и размеров реакционного сосуда, но мало изменяется с температурой. Можно считать, что скорость цепной реакции пропорциональна квадрату диаметра со7суда.
Верхний предел воспламенения (Р2) мало зависит от формы сосуда, но сильно зависит от температуры и наличия примесей.
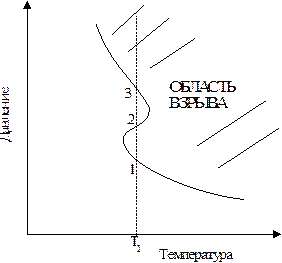 |
Качественная зависимость пределов взрываемости от температуры представлена на рис.12.2.
Точка 1 отвечает нижнему, а точка 2 — верхнему пределу взрываемости при температуре Т1.
| Рис.12.2. Влияние температуры на пределы взрываемости |
На рис. 12.2 показан, кроме того, и третий предел взрываемости (точка 3), который наблюдается для некоторых реакций. Третий предел чаще всего обусловлен развитием так называемого теплового взрыва. Он возможен для экзотермических реакций и связан с разогревом смеси вследствии недостаточного теплоотвода. Как известно, с повышением температуры скорость реакций возрастает, а поэтому увеличивается и количество выделяющейся энергии, что приводит к еще большему повышению температуры, а затем и к дальнейшему увеличению скорости реакции.
Видео:Кинетика || Лекция 19 || Разделяющая поверхность, теория переходного состояния (начало)Скачать

🎥 Видео
Лекция 13: теория переходного состояния (04.12.2019)Скачать

Переходные процессы | Классический метод расчета переходных процессов. Теория и задачаСкачать

Лекция 14: теория переходного состояния (11.12.2019)Скачать

Лекция 12: теория РРК, теория переходного состояния (27.11.2019)Скачать

Григорий Перельман 08.06.2017Скачать

Предельные вероятности состоянийСкачать

Температура и тепловое равновесие. Определение температуры | Физика 10 класс #30 | ИнфоурокСкачать

Метод переменных состояния │ПЕРЕХОДНЫЕ ПРОЦЕССЫ. ПримерСкачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

ФИЗИЧЕСКАЯ ХИМИЯ (ТЕРМОДИНАМИКА). ОСНОВНЫЕ ПОНЯТИЯ: СИСТЕМЫ, ПАРАМЕТРЫ, ФУНКЦИИСкачать

Лекция 140 Определение энергии актвации электродного процессаСкачать



