 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 6 |
a. Окисление метилбензола перманганатом калия:
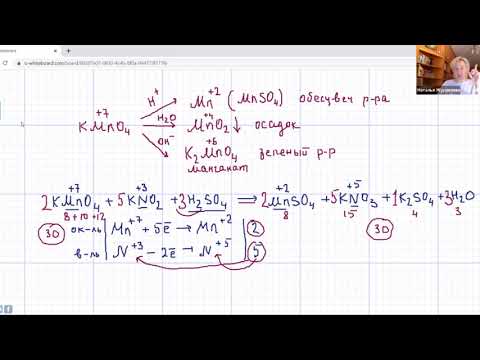
5C6H5CH3 + 6KMnO4 + 9H2SO4 → 5С6H5COOH + 6MnSO4 + 3K2SO4 + 14H2O

6 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5C7H8 + 10H2O + 6MnO4- + 48H+ → 5 C7H6O2 + 30H+ + 6Mn2+ +24H2O
б. Окисление этилбензола перманганатом калия:
5C6H5CH2-СН3 +12KMnO4 +18H2SO4 → 5С6H5COOH +5СО2 +12MnSO4+6K2SO4+28H2O

12 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5С8Н10 + 20H2O + 12MnO4- + 96H+ → 5С6H5COOH + 5СО2 + 60H+ + 12Mn2+ + 48H2O
в. Окисление стирола перманганатом калия:
С6Н5-СН═СН2 + 2KMnO4 + 3H2SO4 → С6H5COOH + СО2 + 2MnSO4 + K2SO4 + 4H2O

2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
С8Н8 + 4Н2О + 2MnO4- + 16H+ → С6H5COOH + СО2 + 10Н+ + 2Mn2+ + 8H2O
а. Окисление метилбензола перманганатом калия:
C6H5CH3 + 6KMnO4 + 7KOH → С6H5COOK + 5H2O + 6K2MnO4

6 MnO4- + e → MnO42- — восстановление
 |
C7H8 + 7OH — + 6MnO4- → C6H5COO — + 5H2O + 6 MnO42-
C6H5CH2 — СН3 + 12KMnO4 + 15KOH → С6H5COOK + К2СО3 + 12K2MnO4 + 10H2O

12 MnO4- + e → MnO42- — восстановление
 |
С8Н10 + 15OH — + 12MnO4- → C6H5COO — + СО32- + 10H2O + 24MnO42-
в. Окисление стирола перманганатом калия:
С6Н5-СН═СН2 + 10KMnO4 +13КОН →С6H5COOK + К2СО3 + 10K2MnO4 + 8H2O

10 MnO4- + e → MnO42- — восстановление
С8Н8 + 13OH — + 10MnO4- → C6H5COO — + СО32- + 8H2O + 10MnO42-
а. Окисление метилбензола перманганатом калия:
C6H5CH3 + 2KMnO4 → С6H5COOK + 2MnO2 + KOH + H2O

2 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
C7H8 + 7OH — + 2MnO4- + 4H2O → C6H5COO — + 5H2O + 2MnO2 + 8OH-
б. Окисление этилбензола перманганатом калия:
C6H5CH2 — СН3 + 4KMnO4 → С6H5COOK + К2СО3 + 4MnO2 + KOH + 2H2O

4 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
С8Н10 + 15OH — + 4MnO4- + 8H2O → C6H5COO — + СО32- + 10H2O + 4MnO2 + 16OH —
в. Окисление стирола перманганатом калия:


3 С8Н8 + 2OH — — 2е → С8Н8(ОН)2 — окисление
2 MnO4- + 2H2O + 3e → MnO2 + 4OH — — восстановление
3С8Н8 + 6OH — + 2MnO4- + 4H2O → 3 С8Н8(ОН)2 + 2MnO2 + 8OH-
Окисление спиртов производят сильными окислителями KMnO4 или K2Cr2O7 в присутствии серной кислоты. Непосредственным продуктом окисления первичных спиртов являются альдегиды, а вторичных – кетоны.
а. Окисление этанола:

H
5 C2H6O — 2e → C2H4O + 2H+ — окисление
2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
5C2H6O + 2MnO4- + 16H+ → 5C2H4O + 10H+ + 2Mn2+ + 8H2O
б. Окисление пропанола – 2:


5 C3H8O — 2e → C3H6 + 2H+ — окисление
2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
5C3H8O + 2MnO4- + 16H+ → 5C3H6 + 10H+ + 2Mn2+ + 8H2O
C избытком окислителя (KMnO4 или K2Cr2O7) в любой среде первичные спирты окисляются до карбоновых кислот или их солей, а вторичные — до кетонов. Третичные спирты не окисляются, а метанол окисляется до углекислого газа.
5СН3-СН2-ОН + 4KMnO4 + 6H2SO4 → 5СН3СООН + 4MnSO4 + 2K2SO4 + 11H2O
Двухатомные спирты окисляются до двухосновных карбоновых кислот.
5НО-СН2-СН2-СН2-ОН + 8KMnO4 + 12H2SO4 →
Альдегиды – сильные восстановители, поэтому легко окисляются при нагревании различными окислителями KMnO4 , K2Cr2O7 или [Ag(NH3)2]OH. Формальдегид с избытком окислителя окисляется до углекислого газа.
а. Окисление аммиачным раствором оксида серебра — качественная реакция на альдегиды
СН3С+1ОН + 2[Ag+1(NH3)2]OH → СН3С+3ООNH4 + 2Ag0 ↓ + H2O + 3NH3↑

2 Ag+1 + 1e → Ag0 — восстановление
б. Окисление перманганатом калия в кислой среде:
5СН3-СН2-СОН+2KMnO4 + 3H2SO4→5СН3-СН2-СООН +2MnSO4 + K2SO4 + 3H2O

2 MnO4- + 8H+ + 5e → Mn2+ + 4H2O — восстановление
 |
5С3Н6О + 5Н2О + 2MnO4- + 16H+ → 5С3Н6О2 + 10Н+ + 2Mn2+ + 8H2O
в. Окисление перманганатом калия в щелочной среде:
СН3-СН2-СОН + 2KMnO4 + 3КОН → СН3СООК + 2K2MnO4 + 2H2O

2 MnO4- + e → MnO42- — восстановление
C2H4O + 3OH — + 2MnO4- → CH3COO + 2H2O + 2MnO42-
Карбоновые кислоты. Среди кислот сильными восстановительными свойствами обладают муравьиная и щавелевая, которые окисляются до углекислого газа.
НСООН + HgCl2 =CO2 
HCOOH+ Cl2 = CO2 
HOOC-COOH+ Cl2 =2CO2 
Все моносахариды — восстанавливающие сахара. Для них характерна реакция «серебряного зеркала».
а. Окисление глюкозы аммиачным раствором оксида серебра:
СН2ОН-(СНОН)4-С+1ОН + 2[Ag+1 (NH3)2]OH →

2 Ag+1 + 1e → Ag0 — восстановление
б. Окисление глюкозы фелинговой жидкостью:
СН2ОН-(СНОН)4-С+1ОН + Cu+2(OH)2 → СН2ОН-(СНОН)4-С+3ОOН + Cu2+1O + 2H2O

2 Cu+2 + 1e → Cu+1 — восстановление
в. Окисление глюкозы перманганатом калия в кислой среде:
5C6H12O6 + 24KMnO4 + 36H2SO4 → 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O

24 MnO4 — + 8H+ + 5e → Mn2+ + 4H2O — восстановление
C6H12O6 + 6О 2 → 6СО2 + 6Н2О
д. Брожение глюкозы:
Брожение – сложный процесс расщепления моносахаридов под влиянием различных микроорганизмов.
· спиртовое брожение: C6H12O6 → 2С2Н5ОН + 2СО2↑
· молочнокислое брожение: ферменты


· маслянокислое брожение: C6H12O6 → С3Н7СООН + 2СО2 ↑ + 2Н2↑


е. Восстановление глюкозы:
Все моносахариды при восстановлении образуют многоатомные спирты.
СН2ОН-(СНОН)4-С+1ОН + Н20 → СН2ОН-(СНОН)4-С-1 Н2OН+1

1 Н20 — 2е → 2 Н+1 — окисление

Видео:ОВР с перманганатом калия.Скачать
Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Окисление этилбензола и пропилбензолаСкачать  Мягкое окисление алкенов. Пошаговый алгоритм составления уравнений.Под мягким окислением алкенов подразумевают действие на них нейтрального холодного водного раствора перманганата калия. В результате такого окисления образуются, так называемые вицинальные диолы – двухатомные спирты с двумя ОН-группами при соседних атомах углерода в молекуле. Поскольку среда нейтральная, в качестве продуктов восстановления перманганата калия образуются диоксид марганца — MnO2 и щелочь. Вывод о том, что вода также является реагентом (будет входить в левую часть уравнения реакции), можно легко сделать хотя бы по тому, что в молекуле органического вещества появляются дополнительные атомы водорода, которых в перманганате нет. Таким образом, схема реакции будет выглядеть так: Расставим коэффициенты в этой схеме методом электронного баланса. Для этого сначала нужно определить степени окисления у тех атомов углерода, при которых изменилось окружение (в нашем случае у тех атомов углерода, к которым прикрепятся ОН группы). Отметим, что при окислении органических веществ степень окисления водорода не меняется и равна +1. Для расстановки степеней окисления атомов углерода в органических веществах можно использовать так называемый метод блоков. В данном методе мы должны мысленно «изолировать» друг от друга фрагменты молекулы органического вещества по углерод-углеродным связям и рассматривать такие фрагменты условно как нейтральные молекулы. В частности, формулу пропена можно разбить на условно нейтральные блоки таким образом: Далее, приняв заряд каждого блока за 0 и помня, что водород в органических веществах всегда имеет степень окисления, равную +1, несложно посчитать степени окисления всех атомов углерода. Таким образом, составив уравнения и решив их, получаем: Проведем аналогичную манипуляцию с формулой органического продукта окисления. Разбиваем мысленно его молекулу на нейтральные блоки по углерод-углеродным связям. Пусть степени окисления первого, второго и третьего атома С также будут равны x, y и z соответственно. Атомы водорода в органике всегда имеют степень окисления +1, а кислорода практически всегда -2 (за исключением редких случаев — органических пероксидов, которые в ЕГЭ не рассматриваются). Поэтому, подписав степени окисления для каждого элемента, получим:
y + 1 −2 +1 = 0 => y = 0 z + 2·1 − 2 +1 = 0 => z = −1 Таким образом, мы видим, что степень окисления первого атома углерода не изменилась, что и логично, ведь не изменилось его окружение. Степень окисления второго атома С была равна -1, стала равна 0. Степень окисления третьего атома С была равна -2, стала равна -1. Также в этой окислительно-восстановительной реакции изменяется степень окисления марганца. Изначально она была равна +7 (в перманганате калия), после реакции стала равна +4 (в диоксиде марганца). Запишем еще раз схему реакции и составим для нее электронный баланс, используя в балансе только те атомы С, степень окисления которых изменилась: 3·| С −1 С −2 − 2е − → С 0 С −1 2·| Mn +7 + 3e − → Mn +4 (вывод о том, что от двух атомов С слева нужно отнять 2 электрона делаем на основании того, что суммарный заряд двух «атомов» С слева равен -3, а справа -1) Перенесем коэффициенты из электронного баланса в схему: Далее, мы видим, что в левой части схемы уже точно известно количество атомов калия, поскольку перед единственным калийсодержащим веществом левой части известен коэффициент. Таким образом, очевидно, что перед KOH в правой части схемы нужно поставить коэффициент 2. Получаем: Далее, мы видим, что в левой части уравнения уже известно точное количество атомов кислорода, поскольку перед всеми кислородсодержащими веществами правой части коэффициенты известны. Всего в правой части уравнения 12 атомов кислорода. В левой части (не считая воды) – 8 атомов кислорода. Таким образом, чтобы в левой части тоже было 12 атомов кислорода, перед водой нужно поставить коэффициент 4. Таким образом, конечное уравнение окисления пропилена нейтральным холодным раствором перманганата будет иметь вид: Следует отметить, что абсолютно такие же коэффициенты в уравнении реакции будут при мягком окислении любого другого органического вещества с одной двойной связью (при условии, что в молекуле будут отсутствовать другие фрагменты, способные к окислению). Для демонстрации того, что коэффициенты будут идентичными, давайте рассмотрим мягкое окисление 2-фенилпропена Схема окисления 2-фенилпропена будет выглядеть следующим образом: Учитывая опыт примера с мягким окислением пропена, мы будем определять степени окисления не всех атомов углерода, а только тех, у которых изменилось окружение. Поэтому в молекуле 2-фенилпропена мы выделим только два условно нейтральных блока. Обозначив степени окисления атомов углерода как x и y, а также не забывая, что степень окисления водорода в органических веществах равна +1, подпишем степени окисления для каждого элемента в выделенных блоках: Таким образом, составив и решив уравнения получаем: Аналогично поступим с продуктом окисления: x −2 + 1 = 0 => x = 1 y +2·1 −2 + 1 = 0 => y = −1 Запишем повторно схему окисления 2-фенилпропена нейтральным раствором перманганата и составим электронный баланс: 3|С 0 С −2 − 2е − → С +1 С −1 2|Mn +7 + 3e − → Mn +4 Перенесем коэффициенты из электронного баланса в схему реакции: Далее мы видим, что калия в левой части схемы 2, значит коэффициент 2 нужно поставить перед KOH. Получаем: В правой части мы видим 12 атомов кислорода, в связи с чем для получения такого же количества атомов кислорода в левой части перед водой необходимо поставить коэффициент 4. Таким образом, конечное уравнение мягкого окисления 2-фенилпропена холодным нейтральным раствором перманганата калия будет иметь вид: Как можно видеть, коэффициенты в этом уравнении полностью совпали с коэффициентами уравнения реакции мягкого окисления пропилена. 🎥 ВидеоОкисление органических соединений перманганатом калияСкачать  Окисление ВСЕХ органических веществ за 4 часа | Химия ЕГЭ 2023 | УмскулСкачать  6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать  Самые сложные ОВР с перманганатом калия | Химия ЕГЭ 2023 | УмскулСкачать  Реакция этилена с раствором перманганата калияСкачать  6.1. Ароматические углеводороды (бензол и его гомологи): Строение, номенклатура, изомерияСкачать  Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать  Взаимодействие этилена с раствором перманганата калияСкачать  Самый легкий способ уравнять ОВР в органике!Скачать  Окисление органических веществ | Химия ЕГЭ для 10 класса | УмскулСкачать  Отношения бензола к бромной воде и раствору перманганата калияСкачать  Получение бензола и его гомологов. 1 часть. 11 класс.Скачать  ХИМИЯ Досрочный ЕГЭ 2015 ЗАДАНИЕ 33 ЭТИЛБЕНЗОЛ АРЕНЫ АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ Гомолог бензолаСкачать  Взаимодействие ацетилена с раствором перманганата калияСкачать  Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  Задание 12. ЕГЭ 2022 по химии (ЕГЭ по химии 2018. Демо. Задание 13. Окисление перманганатом калия)Скачать  Химия | Схемы ОВР для перманганат и дихромат ионовСкачать  Окисление пропилбензола перманганатом калия в щелочной средеСкачать  |


































