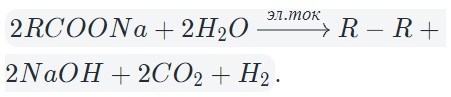Задача 590.
Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
Решение:
ZnCl2 ⇔ Zn 2+ + 2Cl —
Стандартный электродный потенциал системы Zn 2+ + 2 
2H2O + 2 
а ионы цинка Zn 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе Zn 0 + 2 

Уравнения электродных процессов:
А(+): Zn 0 — 2e ⇔ Zn 2+
К(-): 2H2O + 2 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Zn 0 ⇔ H2↑ + 2OH- + Zn 2+
катод анод
Таким образом, при электролизе ZnCl2 с цинковым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк) и будут накапливаться ионы цинка и хлорид-ионы.
б) При электролизе ZnCl2 с угольным анодом будут происходить следующие процессы:
на катоде: 2H2O + 2 
на аноде: 2Cl — — 2 
хотя стандартные электродные потенциалы системы 2H2O — 4 

Таким образом, при электролизе раствора хлорида цинка с угольным электродом на катоде будет будет наблюдаться выделение газообразного водорода и в катодном пространстве будет выпадать осадок гидроксида цинка, а на аноде будет наблюдаться выделение газообразного хлора.
Задача 691.
Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
Решение:
CaSO4 ⇔ Ca 2+ + SO4 2-
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе Cu 2+ — 2 

Уравнения электродных процессов:
А(+): Cu 0 — 2e ⇔ Cu 2+
К(-): Cu 2+ + 2e ⇔ Cu 0
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu 0 + Cu 2+ = Cu 2+ + Cu 0
анод катод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид меди, на аноде будет происходить растворение материала анода (медь) и будут накапливаться ионы меди и сульфат-ионы.
б) При электролизе CuSO4 с угольным анодом будут происходить следующие процессы ( стандартный электродный потенциал системы 2H2O — 4 

на катоде: 2|4|Cu 2+ + 2 
на аноде: 1|2|2H2O — 4 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + 2Cu 2+ ⇔ О2 ↑ + 4Н + + 2Cu (ионно-молекулярная форма);
анод катод
2CuSO4 + 2H2O → 2H2SO4 + O2↑ + 2Cu ( молекулярная форма).
Таким образом, при электролизе раствора сульфата меди с угольным анодом на аноде будет наблюдаться выделение газообразного кислорода, и в анодном же пространстве будет накапливаться сульфат-ионы, которые с ионами водорода создают кислую среду, будет накапливаться серная кислота (2H + + SO4 2- = H2SO4); на катоде будет откладываться металлическая медь.
- Рассмотрите катодные и анодные процессы при электролизе водных растворов ZnCl2 и CoBr2. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом.
- Электролиз расплавов и растворов
- Виды электролиза
- Электролиз расплава
- Электролиз раствора
- Применение электролиза
- Вопросы для самопроверки
- 🌟 Видео
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Рассмотрите катодные и анодные процессы при электролизе водных растворов ZnCl2 и CoBr2. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом.
| 🎓 Заказ №: 22225 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Рассмотрите катодные и анодные процессы при электролизе водных растворов ZnCl2 и CoBr2. Процессы на электродах обоснуйте значениями потенциалов (табл. П.6,7,8). Составьте схемы электролиза с инертными электродами водных растворов предложенных соединений (отдельно два раствора) с инертными электродами либо растворимым анодом. Рассчитайте массу или объем (при нормальных условиях для газов) продуктов, выделяющихся на электродах при пропускании через раствор в течение 1 часа тока силой 1 А.
Решение. Электролиз водного раствора хлорида цинка с инертными электродами. В водном растворе хлорид цинка диссоциирует на катионы цинка и хлориданионы: ZnCl2 = Zn2+ + 2Cl — 14 () Kатод Zn2 + , H2O (+) Aнод Cl —, H2O Е В Zn Zn 0,76 / 2 ; 2 2 0 Е2Н О H = 1B. 2 0 Cl 2Cl Е = 1,36 В ; 2 2 0 ЕО 2H О 1,8 B. Так как Zn Zn Е / 2 > 2 2 0 Е2Н О H , Так как 2 0 Cl 2Cl Е
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Электролиз расплавов и растворов
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Электролиз — это окислительно-восстановительная реакция, которая протекает на электродах и основана на пропускании электрического тока через раствор или расплав.
Не менее важными участниками электролиза являются электроды: катод и анод. Если вы вдруг забыли, что такое катод и анод в химии, напомним.
Катод — это отрицательно заряженный электрод, который притягивает положительно заряженные ионы (катионы). А анод — это положительно заряженный электрод, который притягивает к себе отрицательно заряженные ионы (анионы). Таким образом, на катоде всегда происходит процесс восстановления, а на аноде всегда происходит процесс окисления.
Электроды бывают растворимые и инертные. Растворимые изготавливаются из металлов, например, меди и подвергаются химическим превращениям в ходе электролиза. А вот инертные или нерастворимые электроды не подвергаются химическим превращениям и остаются в неизменном виде как до реакции, так и после нее. Как правило, такие электроды изготавливают из графита или платины.
Видео:Электролиз. 10 класс.Скачать

Виды электролиза
Различают два вида электролиза:
Электролиз водного раствора.
Прежде чем мы рассмотрим каждый процесс отдельно, давай познакомимся с общими для двух видов процессами на электродах.
Процесс на катоде K (−)
Катион принимает электроны и восстанавливается:
Me +n + ne − → Me 0 (восстановление).
Процесс на аноде A (+)
Анион отдает электроны и окисляется:
неMe −n − ne − → неMe 0 (окисление).
Процессы, протекающие при электролизе в общем случае:
К − : Ме +n + ne − → Ме 0 ;
А + : неМе −n − ne − → неМе 0 .
Суммарное уравнение электролиза:
Видео:Гидролиз солей. 9 класс.Скачать

Электролиз расплава
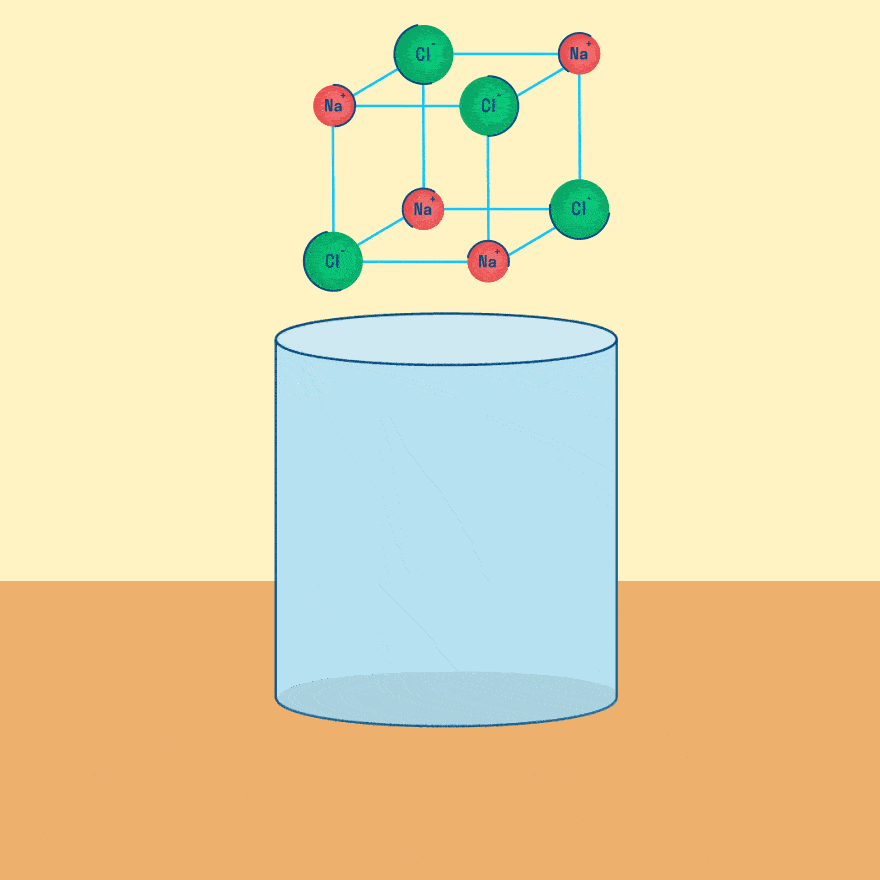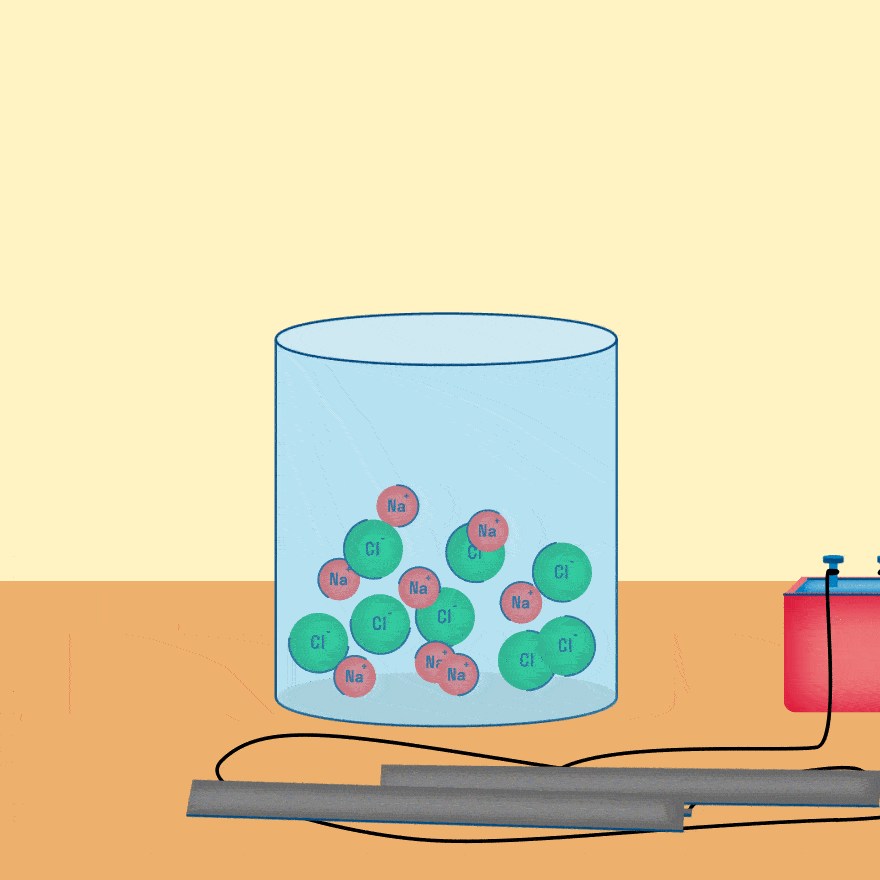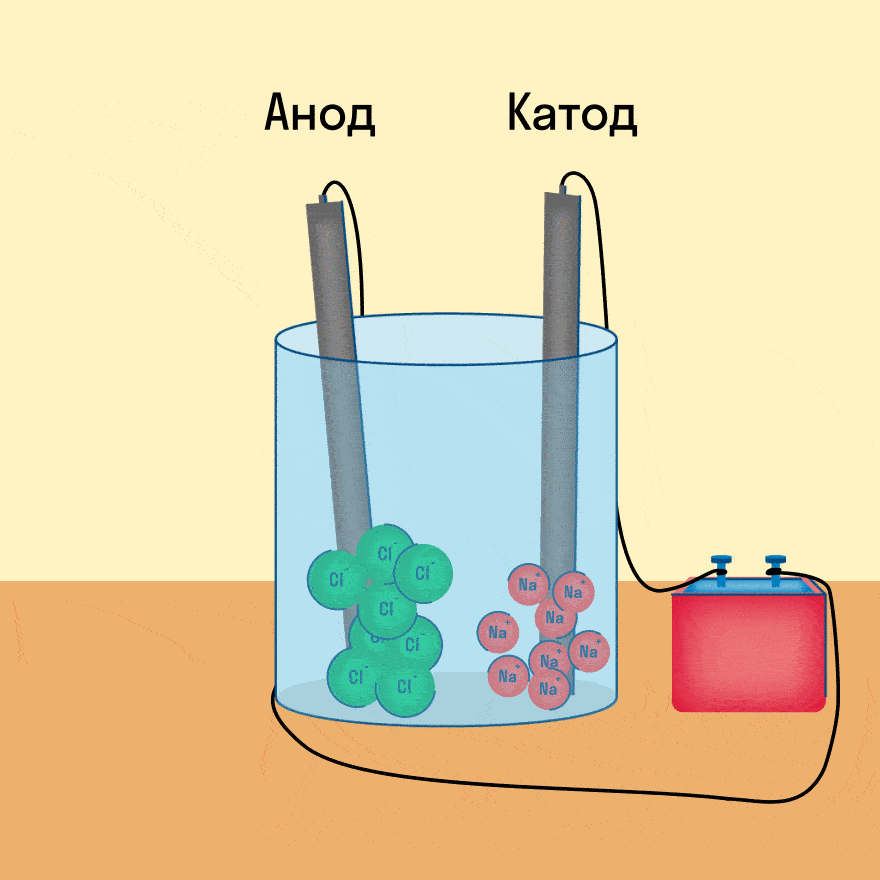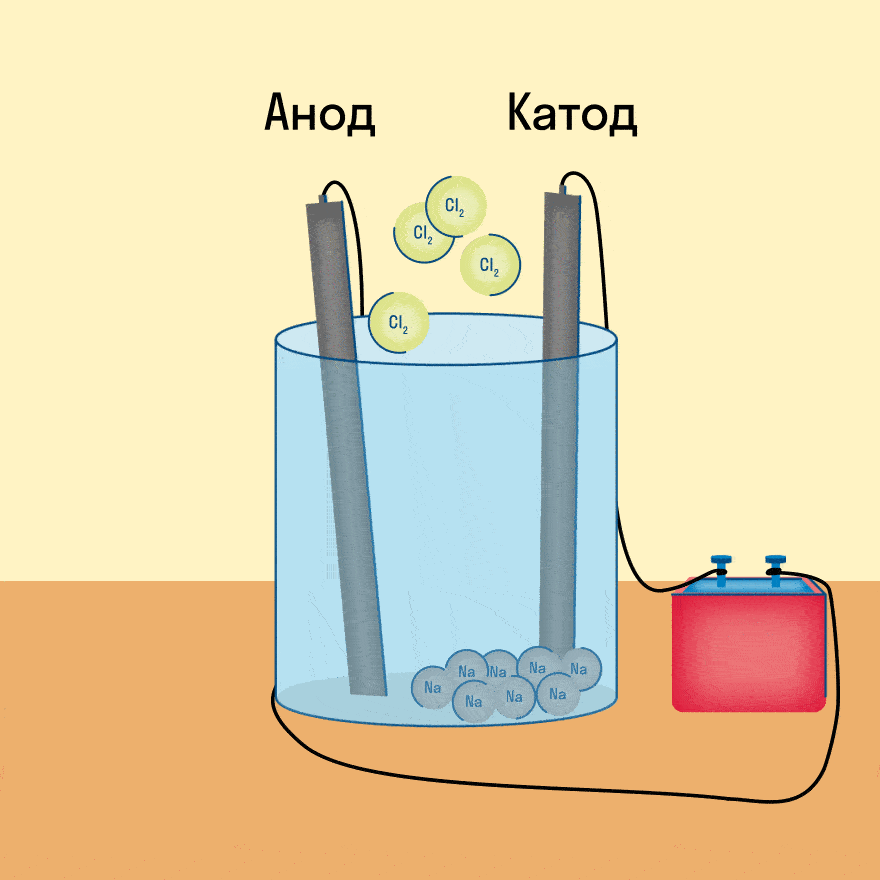
Рассмотрим электролиз расплава пищевой соли — хлорида натрия. При сильном нагревании кристаллический твердый хлорид натрия плавится. Полученный расплав содержит подвижные ионы хлора и натрия, освободившиеся из кристаллической решетки, и проводит электрический ток.
К − : 2Na + + 2e − = 2Na 0
А + : 2Cl − − 2e − = Cl2
Суммарное уравнение электролиза:
При опускании в расплав угольных (инертных) электродов, присоединенных к источнику тока, ионы приобретают направленное движение: катионы движутся к отрицательно заряженному электроду (катоду), анионы — к положительно заряженному электроду (аноду) и отдают электроны.
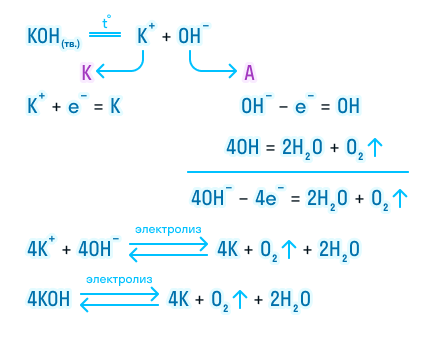
Теперь давайте рассмотрим электролиз расплава гидроксида калия.
На катоде происходит восстановление калия за счет принятия электронов. А на аноде протекает более сложная реакция. Гидроксогруппы отдают свой электрон и становятся нейтральными, но такое состояние для них крайне невыгодно, так как неустойчиво, и они объединяются в группы, чтобы потом разложиться с выделением газообразного кислорода и воды
Итог электролиза расплава — металлический калий на катоде, газообразный кислород и пары воды на аноде.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз раствора
Основным отличием водного раствора от расплава является присутствие молекул воды и ионов H + и OH — как продуктов диссоциации воды. В связи с этим возле катода и анода скапливаются ионы, которые конкурируют как друг с другом, так и с молекулами воды. Рассмотрим электролиз на примере водного раствора KF:
К − : 4H2O + 4e − = 2H2 0 + 4OH −
Суммарное уравнение электролиза:
Как видно, ни калий, ни фтор не фигурируют в продуктах электролиза. Почему так происходит?
Наиболее активные металлы — сильные восстановители. Калий — как раз такой металл, поэтому обратный процесс восстановления активных металлов из соединений осуществить сложно. При электролизе водных растворов солей активных металлов на катоде протекает восстановление не катионов этих металлов, а воды с образованием водорода.
Разберем порядок восстановления катионов металлов на катоде в зависимости от их активности.
Последовательность разрядки катионов зависит от положения металла в электрохимическом ряду напряжения.
Если у катода накапливаются молекулы воды и катионы металла, который находится в ряду напряжения после водорода, то восстанавливаются ионы металла.
Если у катода накапливаются молекулы воды и катионы металла, который стоит в начале ряда напряжения от лития до алюминия включительно, то восстанавливаются ионы водорода из молекул воды. Катионы металла не восстанавливаются, остаются в растворе.
Если у катода накапливаются молекулы воды и катионы металла, который расположен в ряду напряжения между алюминием и водородом, то восстанавливаются и ионы металла, и частично ионы водорода из молекул воды.
Если в растворе находится смесь катионов разных металлов, то сначала восстанавливаются катионы менее активного металла.
При электролизе раствора кислоты на катоде восстанавливаются катионы водорода до газообразного водорода.
Для удобства мы собрали информацию об электролизе в таблице:
Теперь разберемся, что происходит с анионами в водных растворах при электролизе. Для начала познакомимся с последовательностью восстановления анионов на аноде:
Чем меньше выражена восстановительная активность, тем хуже анионы могут окисляться на аноде. К тому же процесс на аноде зависит от материала анода и от природы аниона.
Если анод инертный или нерастворимый, то на нем протекают следующие реакции:
При электролизе растворов солей бескислородных кислот (кроме фторидов!), на аноде происходит процесс окисления аниона.
При электролизе растворов солей кислородсодержащих кислот и фторидов на аноде выделяется газообразный кислород вследствие окисления молекул воды. Анион при этом не окисляется, оставаясь в растворе.
При электролизе растворов щелочей происходит окисление гидроксид-ионов.
Если анод растворимый, то на нем всегда происходит окисление металла анода — независимо от природы аниона.
Исключением является электролиз солей карбоновых кислот. Таблица выше не описывает происходящее на аноде. Давайте рассмотрим, что же там происходит.
В результате электролиза водных растворов солей щелочных металлов карбоновых кислот происходит образование углеводородов вследствие рекомбинации углеводородных радикалов.
В общем виде электролиз солей карбоновых кислот можно записать так:
На катоде образуется газообразный водород, а на аноде — углекислый газ, углеводород, полученный удвоением радикала. В катодном пространстве накапливается щелочь.
В случае разделения катодного и анодного пространства углекислый газ реагирует со щелочью с образованием гидрокарбоната.
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Применение электролиза
А теперь самое главное: зачем вообще нужен электролиз? Рассмотрим применение этого вида ОВР:
С помощью электролиза расплавов природных соединений в металлургической промышленности получают активные металлы (калий, натрий, бериллий, кальций, барий). С помощью электролиза растворов солей — цинк, кадмий, кобальт и другие.
В химической промышленности электролиз используют для получения фтора, хлора, водорода, кислорода, щелочей, бертолетовой соли и других веществ.
Электролиз с растворимым анодом используют для нанесения металлических покрытий (из хрома, золота, никеля, серебра), что предохраняет металлические изделия от коррозии и придает им декоративный вид.
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Вопросы для самопроверки
1. Выберите верное продолжение фразы «катод — это. »:
Положительно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Положительно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются положительно заряженные ионы.
Отрицательно заряженный электрод, к которому притягиваются отрицательно заряженные ионы.
2. Продолжите фразу «электролиз — это…»:
ОВР с применением тока.
Реакция без изменения степеней окисления с применением тока.
ОВР с применением катализаторов.
3. Как заряжен анион?
Не имеет заряда.
4. Чем отличается электролиз раствора от электролиза расплава?
В расплаве плавится твердое.
Присутствием молекул воды и продуктов ее диссоциации.
5. Если металл стоит в ряду активности металлов между алюминием и водородом, что выделится на катоде?
Металл и водород.
При электролиза водного раствора фторида лития что на аноде выделится?
🌟 Видео
ЭлектролизСкачать

Электролиз расплавов и растворов солей.Теория для задания 22 ЕГЭ по химииСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Is ZnCl2 (Zinc chloride) an Electrolyte or Non-Electrolyte?Скачать

Электролиз. Решение задач. 1 часть. 10 класс.Скачать

Электролиз расплавов и растворов. 10 класс.Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Is Zn + HCl = ZnCl2 + H2 Redox Reaction?Скачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Схема электролиза водного раствора AgNO3Скачать

Электролиз растворов. 2 часть. 10 класс.Скачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Химия / 9 класс / ЭлектролизСкачать