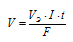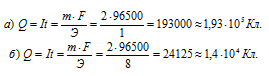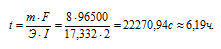- Ваш ответ
- решение вопроса
- Похожие вопросы
- Составьте схему электролиза расплава и водного раствора солей SnCl2 и Ba(NO2)2 на инертных электродах. Определите объем газа (108С, 4атм.) и массу металла, выделившихся на электродах при электролизе
- Описание и исходные данные задания, 50% решения + фотография:
- Как рассчитать количество электричества, для выделения из раствора на электродах водорода и кислорода
- 🎬 Видео
Видео:Делаем хлорное олово SnCl2Скачать

Ваш ответ
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

решение вопроса
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Электролиз. 10 класс.Скачать

Составьте схему электролиза расплава и водного раствора солей SnCl2 и Ba(NO2)2 на инертных электродах. Определите объем газа (108С, 4атм.) и массу металла, выделившихся на электродах при электролизе






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Составьте схему электролиза расплава и водного раствора солей SnCl 2 и Ba ( N O2)2 на инертных электродах. Определите объем газа (108 ° С, 4атм.) и массу металла, выделившихся на электродах при электролизе 13,8 г расплава SnCl 2
Решение :
На аноде: 2 Cl — — 2 e = Cl 2
На катоде: Sn 2+ + 2 e = Sn
Суммарная реакция: SnCl 2 Sn + Cl 2
На аноде: 2 Cl — — 2 e = Cl 2
На катоде: Sn 2+ + 2 e = Sn
Суммарная реакция: SnCl 2 Sn + Cl 2
| Если вам нужно решить химию, тогда нажмите ➔ заказать химию. |
| Похожие готовые решения: |
- Где коррозия никеля протекает быстрее: в растворе Na2SO3 или ZnCl2? Дать мотивированный ответ
- В две колбы налито по 0,1 л золя гидроксида железа. Коагуляция в первой наступила при добавлении 0,063л раствора Na2SO4 с Сэк=0,01н, а во второй при добавлении 0,037л раствора Na3PO4 c Cэк=0.001 н.
- Уравняйте реакции ионно-электронным методом, укажите окислитель и восстановитель, рассчитайте ЭДС, определите направление протекания реакции и ее тип: Cr(OH)3 + NaClO + NaOH → Na2CrO4 + NaCl + H2O
- Составьте схему гальванического элемента, состоящего из двух металлических пластин, опущенных в растворы их солей. Напишите уравнения электродных процессов
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Как рассчитать количество электричества, для выделения из раствора на электродах водорода и кислорода
Задача 704.
Какое количество электричества потребуется для выделения из раствора: а) 2 г водорода; 6) 2 г кислорода?
Решение:
Эквивалентная масса водорода равна М/2 = 2/2 = 1г/моль, а кислорода – М/4 = 32/4 = 8г/моль.
Для расчета количества электричества (Q = It) используем уравнение Фарадея:
Здесь m — масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса;
I — сила тока; t — время; F — постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно количества электричества и подставим данные задачи, получим:
Ответ: а) 1,93 . 105 Кл; б) 2,4 . 104 Кл.
Задача 705.
При электролизе водного раствора Сг2(SO4)3 током силой 2 А масса катода увеличилась на 8 г. В течение какого времени проводили электролиз?
Решение:
Для расчета времени используем уравнение закона Фарадея:
Здесь m — масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса;
I — сила тока; t — время; F — постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
Решим уравнение закона Фарадея относительно времени и подставим данные задачи:
(m = 8г, I = 2 A, Э = М/3 = 17,332г/моль), получим:
Ответ: 6,19ч.
Задача 706.
При электролизе водного раствора SnCl2 на аноде выделилось 4,48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова.
Решение:
Схема электродного процесса имеет вид:
Катод: Sn 2+ + 2 
Анод: 2Cl — — 2 
Следовательно, эквивалентная масса олова равна М/2 = 118,710/2 = 59,355г/моль, а эквивалентный объём хлора равен:
Рассчитаем количество, выделившегося хлора:
Так как n(Sn) = n(Cl2), то массу олова рассчитаем по формуле:
m(Sn) = n(Sn) . MЭ(Sn) = 0,4 . 59,355 = 23,742 г.
Ответ: 23,742г.
Задача 707.
За 10 мин из раствора платиновой соли ток силой 5 А выделил 1,517 г Рt. Определить эквивалентную массу платины.
Решение:
Для расчета эквивалентной массы платины используем уравнение закона Фарадея:
Здесь m — масса образовавшегося или подвергшегося превращению вещества; Э — его эквивалентная масса;
I — сила тока; t — время; F — постоянная Фарадея (96500 Кл/моль), т.е. количество электричества, необходимое для осуществления электрохимического превращения одного эквивалента вещества.
(m = 1,517г, I = 5 A, t = 10мин = 10 . 60 = 600с), получим:
🎬 Видео
Электролиз растворов. 1 часть. 10 класс.Скачать

ЭлектролизСкачать

Хлорное олово SnCl2 готовим самиСкачать

Электролиз! Возможно ли получить хлорное олово с помощью электролиза или что то ещёСкачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

рецепт электролита для оловаСкачать

Хлорное олово SnCl2 - получение Как выбрать олово Тест на золотоСкачать

Солошенко К.В. Производство едкого натра, хлора, водорода и соляной кислоты.Скачать

Электролиз с растворимым электродомСкачать

Электролиз раствора KIСкачать

Электролиз расплавов и растворов. 10 класс.Скачать

Урок 187 (осн). Применения электролизаСкачать

Электролиз под микроскопом. Выращивание кристаллов олова и меди. [ChemistryToday]Скачать
![Электролиз под микроскопом. Выращивание кристаллов олова и меди. [ChemistryToday]](https://i.ytimg.com/vi/Jg7b625Nqaw/0.jpg)