Задача 590.
Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
Решение:
ZnCl2 ⇔ Zn 2+ + 2Cl —
Стандартный электродный потенциал системы Zn 2+ + 2 
2H2O + 2 
а ионы цинка Zn 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе Zn 0 + 2 

Уравнения электродных процессов:
А(+): Zn 0 — 2e ⇔ Zn 2+
К(-): 2H2O + 2 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Zn 0 ⇔ H2↑ + 2OH- + Zn 2+
катод анод
Таким образом, при электролизе ZnCl2 с цинковым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк) и будут накапливаться ионы цинка и хлорид-ионы.
б) При электролизе ZnCl2 с угольным анодом будут происходить следующие процессы:
на катоде: 2H2O + 2 
на аноде: 2Cl — — 2 
хотя стандартные электродные потенциалы системы 2H2O — 4 

Таким образом, при электролизе раствора хлорида цинка с угольным электродом на катоде будет будет наблюдаться выделение газообразного водорода и в катодном пространстве будет выпадать осадок гидроксида цинка, а на аноде будет наблюдаться выделение газообразного хлора.
Задача 691.
Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
Решение:
CaSO4 ⇔ Ca 2+ + SO4 2-
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе Cu 2+ — 2 

Уравнения электродных процессов:
А(+): Cu 0 — 2e ⇔ Cu 2+
К(-): Cu 2+ + 2e ⇔ Cu 0
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu 0 + Cu 2+ = Cu 2+ + Cu 0
анод катод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид меди, на аноде будет происходить растворение материала анода (медь) и будут накапливаться ионы меди и сульфат-ионы.
б) При электролизе CuSO4 с угольным анодом будут происходить следующие процессы ( стандартный электродный потенциал системы 2H2O — 4 

на катоде: 2|4|Cu 2+ + 2 
на аноде: 1|2|2H2O — 4 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + 2Cu 2+ ⇔ О2 ↑ + 4Н + + 2Cu (ионно-молекулярная форма);
анод катод
2CuSO4 + 2H2O → 2H2SO4 + O2↑ + 2Cu ( молекулярная форма).
Таким образом, при электролизе раствора сульфата меди с угольным анодом на аноде будет наблюдаться выделение газообразного кислорода, и в анодном же пространстве будет накапливаться сульфат-ионы, которые с ионами водорода создают кислую среду, будет накапливаться серная кислота (2H + + SO4 2- = H2SO4); на катоде будет откладываться металлическая медь.
Видео:получение хлорида цинка /Скачать

Электролиз водного раствора zncl2
Задача 590.
Составить схемы электролиза водного раствора хлорида цинка, если: а) анод цинковый; б) анод угольный.
Решение:
ZnCl2 ⇔ Zn 2+ + 2Cl –
Стандартный электродный потенциал системы Zn 2+ + 2 
2H2O + 2 
а ионы цинка Zn 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе Zn 0 + 2 

Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Zn ⇔ H2↑ + 2OH- + Zn 2+
катод анод
Таким образом, при электролизе ZnCl2 с никелевым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк) и будут накапливаться ионы цинка и хлорид-ионы.
б) При электролизе ZnCl2 с угольным анодом будут происходить следующие процессы:
на катоде: 2H2O + 2 
на аноде: 2Cl – – 2 
хотя стандартный электродный потенциал системы 2H2O – 4 

Таким образом, при электролизе раствора хлорида цинка с угольным электродом на катоде будет будет наблюдаться выделение газообразного водорода и в катодном пространстве будет выпадать осадок гидроксида цинка, а на аноде будет наблюдаться выделение газообразного хлора.
Задача 691.
Составить схемы электролиза водного раствора сульфата меди, если: а) анод медный; б) анод угольный.
Решение:
CaSO4 ⇔ Ca 2+ + SO4 2-
Стандартный электродный потенциал системы Cu 2+ + 2 
Cu 2+ + 2 
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе Cu 2+ – 2 

Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu 0 + Cu 2+ = Cu 2+ + Cu 0
катод анод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид меди, на аноде будет происходить растворение материала анода (медь) и будут накапливаться ионы меди и сульфат-ионы.
б) При электролизе CuSO4 с угольным анодом будут происходить следующие процессы:
так как стандартный электродный потенциал системы 2H2O – 4 

на катоде: Cu 2+ + 2 
на аноде: 2H2O – 4 
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2H2O + Cu ⇔ H2 ↑ + 2OH – + Cu
катод анод
Таким образом, при электролизе раствора сульфата меди с угольным анодом на катоде будет наблюдаться выделение газообразного водорода, и в катодном пространстве будет выпадать осадок гидроксида меди, а на аноде будет наблюдаться выделение газообразно-го кислорода и будет накапливаться серная кислота.
Тема электролиза довольна большая, формул в ней много и, как мне кажется, больше ее изучают на уроках физики… Я хочу рассмотреть ту часть, которая касается химии, и при этом только формат ЕГЭ — электролиз водных растворов солей.
Электролиз водных растворов солей
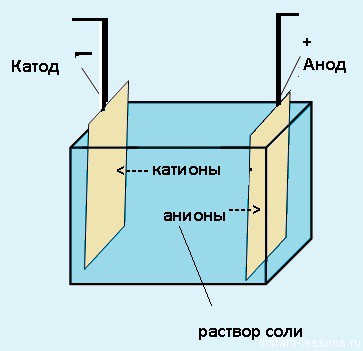
Для начала давайте представим себе систему, в которой происходит электролиз.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, который возникает при прохождении электрического тока через раствор либо расплав электролита.
Электроды — это такие пластинки или стержни, опущенные в раствор, они подключены к источнику тока.
- Анод — положительно заряженный электрод
- Катод — отрицательно заряженный электрод
Мы будем рассматривать случай инертных электродов — т.е. они не будут вступать ни в какие химические реакции.
При пропускании электрического тока, вещество раствора будет претерпевать химические изменения, т.е. буду образовываться новые химические вещества. Они будут притягиваться к электродам следующим образом:
- Неметаллы и их производны, анионы — к аноду
- Металлы и их производный, катионы — к катоду
Теперь рассмотрим электролиз водных растворов различных солей
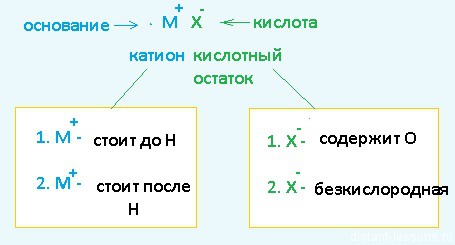
Разберем сначала катионы :
- Если металл стоит до Н, то вместо него электролизу подвергается вода:
2H2O + 2е = H2 + 2OH – Образовавшийся водород H2 идет к катоду - Если металл стоит после Н, то он сам восстанавливается:
Cu 2+ + 2е = Cu 0 Медь осаждается на катоде - Катионы металлов, стоящие в ряду напряжений после алюминия до водорода, могут восстанавливаться вместе с молекулами воды :
2Н2О + 2е = Н2+ 2ОН — Zn 2+ + 2e = Zn 0
Теперь анионы-кислотные остатки :
- Кислородсодержащие кислотные остатки — вместо них электролизу подвергается вода:
2H2O — 4e = O2 + 4H + Образовавшийся O2 выделяется на аноде - Бескислородные кислотные остатки — окисляются до простого вещества:
Cl − — 1e = Cl2 0 Хлор выделяется на аноде - Исключение: F − — вместо него будет выделяться кислород.
Примеры:
1 .1. Катион стоит в ряду до Н, кислотный остаток содержит кислород О:
1.2. Катион стоит в ряду до Н, кислотный остаток беcкислородный:
анод (+): Cl − — 1e = Cl 0 ; Cl 0 +Cl 0 =Cl2
2.1. Катион стоит в ряду после Н, кислотный остаток содержит кислород О:
K(-): Cu 2+ + 2e = Cu 0
2.2. Катион стоит в ряду после Н, кислотный остаток беcкислородный:
катод (-): Cu 2+ + 2e = Cu 0
анод (+): 2Cl − — 2e = 2Cl 0
Электролиз водных растворов солей отличается от электролиза расплавов.
Отличие — в наличии растворителя. При электролизе водных растворов солей кроме ионов самого вещества в процессе участвуют ионы растворителя. При электролизе расплавов — только ионы самого вещества.
- ЕГЭ это вопрос Части B № 3
Элетролиз раствора Cu(NO3)2
А(+): 2 H2O – 4e —> 4 H+ + O 2 | 1 | – окисление
К(-): Сu2+ + 2e —> Cu 0 | 2 | – восстановление
2 Cu2+ + 2 H 2O –эл. ток–> 2 Cu + 4 H+ + O 2
2 Cu(NO3)2 + 2 H 2O –эл. ток–> 2 Cu + 4 HNO3 + O 2
электролиз водного раствора ZnCl2
ZnCl2 = Zn2+ + 2Cl-
H20 = H+ + OH-
К(-) Zn2+, H2O; Zn2+ +2e = Zn
А(+) Cl-, H20; 2Cl- 2e = Cl2;
ZnCl2 = Zn + Cl2
Электролиз водного раствора гидроксида калия:
К(-) 2H2O + 2e = H2 + 2OH –
А(+) 4OH- = O 2 + 2H 2 O + 4e
2H2O = O2 + 2H 2
Видео:Электролиз. 10 класс.Скачать

Правила составления окислительно-восстановительных реакций
Видео:Zn + 2HCl → ZnCl2 + H2 | Реакция цинка и соляной кислотыСкачать

Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
🌟 Видео
ЭлектролизСкачать

Опыты по химии. Растворение цинка в кислотах и щелочахСкачать

Гидролиз солей. 9 класс.Скачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз раствора соли сульфата цинка с цинковым анодомСкачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Электролиз растворов. 1 часть. 10 класс.Скачать

Качественная реакция ионов цинка со щелочью. Получение и свойства гидроксида цинкаСкачать

Опыты по химии. Электролиз раствора сульфата натрияСкачать

При электролизе водного раствора. Укенова Илхамия, химия 301Скачать

7. ЭлектролизСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Получение цинка электролизомСкачать

Электролиз раствора соли сульфата цинка с нейтральными (угольными) электродамиСкачать

Электролиз раствора хлорида меди. Химический опытСкачать

Уравнение реакции электролизаСкачать