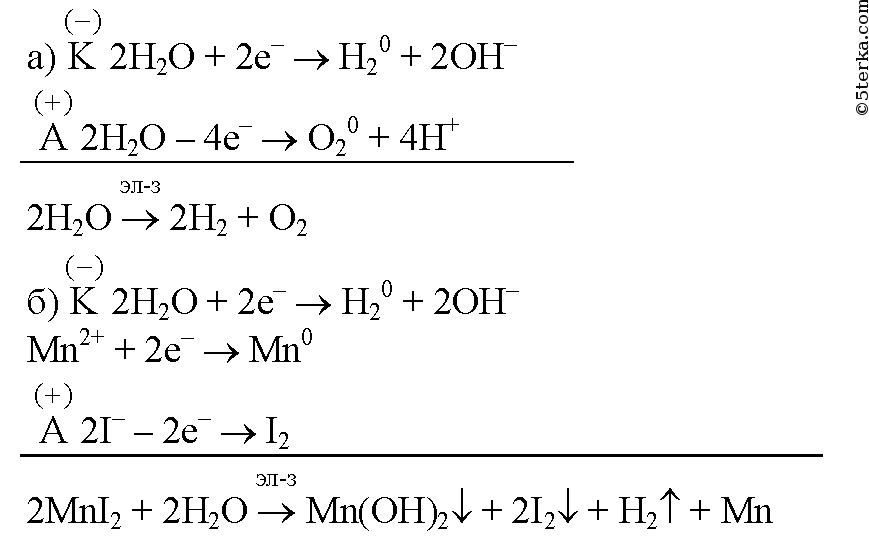задача №24
к главе «Глава 4. Вещества и их свойства. §18. Металлы».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
- Расчеты массы веществ и составление уравнений электродных процессов при электролизе растворов электролитов
- Расчет массы гидроксида калия, образовавшегося при электролизе раствора фосфата калия
- Расчет количество вещества меди, перешедшего в раствор с анода при электролизе сульфата меди (II)
- Расчет массы металла и объема газа, выделившихся при электролизе раствора соли
- Электролиз раствора гидроксида натрия
- Электролиз раствора сульфата цинка
- Электролиз
- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- 📽️ Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Расчеты массы веществ и составление уравнений электродных процессов при электролизе растворов электролитов
Видео:Электролиз. 10 класс.Скачать

Расчет массы гидроксида калия, образовавшегося при электролизе раствора фосфата калия
Задача 199.
Сколько граммов KOH образуется у катода при электролизе раствора K3PO4 если на аноде выделилось 11,2 л кислорода?
Решение:
Уравнение диссоциации соли:
Стандартный электродный потенциал системы К + + 1ē = К 0 (-2,92 В) значительно отрицательнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода, а ионы К+, приходящие к катоду, будут накапливаться в прилегающей к нему зоне (катодное пространство):
На аноде будет происходить электрохимическое окисление ионов ОН — , приводящее к выделению кислорода:
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный электродный потенциал (+1,23 В), характеризующий систему: 2Н2О — 4ē = О2↑ + 4Н + .
Уравнения электродных процессов:
К(-): 2|(–)2H2O + 2ē → H2↑ + 2OH — (в растворе: K⁺, 2OH⁻);
А(+): 1|(+)2H₂O – 4ē → 4H + + O2↑ (В растворе: 4H + , PO4 3- ).
Сложив уравнения электродных процессов на катоде и аноде, получим полное ионно-молекулярное уравнение электролиза соли К3РО4:
После приведения равенства получим молекулярное уравнение электролиза:
С учетом того, что диссоциация соли фосфата калия в растворе протекает полностью, запишем молекулярное уравнение реакции её электролиза, получим:
Из уравнения электролиза К3РО4 вытекает, что на 1 моль О2 образуется 3 моль КОН, т.е. n(O2) = 3n(KOH).
Находим количество выделившегося кислорода, получим:
n(KOH) = 3n(O2) = 0,5 • 3 = 1,5 моль.
m(KOH) = n(KOH)•M(KOH) = 1,5 • 56 = 84 г.
Ответ: m(KOH) = 84 г.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Расчет количество вещества меди, перешедшего в раствор с анода при электролизе сульфата меди (II)
Задача 200.
При электролизе водного раствора сульфата меди (II) с медным анодом масса катода увеличилась на 3,2 г. Какое количество вещества меди перешло в раствор с анода?
Ответ: 0,05 моль.
Решение:
Уравнение диссоциации сульфата меди:
Стандартный электродный потенциал системы: Cu 2+ + 2ē ⇔ Cu 0 (+0,34 В) значительно положительнее потенциала водородного электрода в нейтральной среде (-0,41 В). Поэтому на катоде будет происходить электрохимическое восстановление ионов меди: Cu 2+ + 2ē ⇔ Cu 0 .
На аноде будет происходить электрохимическое окисление меди – материала анода, поскольку, отвечающий системе:
Cu 0 — 2ē ⇔ Cu 2+ (+0,34 В) значительно ниже 2SO4 2- + 2ē ⇔ S2O8 2- (+2,01 В). Ионы SO4 2- , движущиеся к аноду, будут накапливаться в анодном пространстве. Таким образом, на аноде будет происходить растворение меди — материал анода, а на катоде – отложение чистой меди.
Уравнения электродных процессов:
А(+): Cu 0 — 2ē ⇔ Cu 2+
К(-): Cu 2+ + 2ē ⇔ Cu 0
Суммарное уравнение катодного и анодного процессов будет иметь вид:
2Cu 0 + Cu 2+ = Cu 2+ + Cu 0
анод катод
Таким образом, при электролизе CuSO4 на катоде будет наблюдаться выделение чистой меди, на аноде — растворение медного электрода (медь анода будет переходить в раствор в виде ионов Cu 2+ ). Значит, nкатод(Cu) = nанод(Cu)
nкатод(Cu) = nанод(Cu) = m(Cu)/M(Cu) = 3,2/64 = 0,05 моль.
Ответ: 0б5 моль.
Расчет массы металла и объема газа, выделившихся при электролизе раствора соли
Задача 201.
Через растворы NiSO4 и Pb(NO3)2 пропускали одно и то же количество электричества. На одном из катодов выделилось 25,9 г свинца. Сколько граммов никеля выделилось на другом катоде? Какой газ и в каком объеме, измеренном при нормальных условиях, выделился на каждом из электродов?
Решение:
М(Ni) = 58,6934 г/моль;
M(Pb) = 207,2 г/моль;
m(Pb) = 25,9 г;
m(Ni) = ?
V(H2) = ?
V(O2) = ?
Для никеля и свинца, как металлов со средней химической активностью, расположенных в ряду активности после алюминия, на катоде происходят одновременно две
реакции – образование водорода и выделение металла.
Так как NiSO4 и Pb(NO3)2 являются кислородсодержащими кислотами, то на аноде будет происходить окисление воды с выделением кислорода.
Схемы электродных процессов электролиза водных растворов солей NiSO4 и Pb(NO3)2 выглядят следующим образом:
Суммарное ионно-молекулярное уравнение:
После приведения членов, получим:
Суммарное молекулярное уравнение:
Суммарное ионно-молекулярное уравнение:
После приведения членов, получим:
Суммарное молекулярное уравнение:
Из суммарных уравнений процессов электролизов солей вытекает, что при электролизе водных растворов NiSO4 и Pb(NO3)2 при пропускании через их растворы одного и того же количества электричества, на катодах будет выделяется метал и водород, на анодах — кислород, в равных количествах.
n(Pb) = n(Ni) = n(H2) = n(O2)
n(Pb) = m(Pb)/M(Pb) = 25,9/207,2 = 0,125 моль.
m(Ni) = n(Ni) • M(Ni) = 0,125 • 58,6934 = 7,3 г.
V(H2) = n(H2) • Vm = 0,125 • 22,4 = 2,8 л.
V(O2) = V(H2) = 2,8 л.
Ответ: m(Ni) = 7,3 г; V(H2) = 2,8 л; V(O2) = 2,8 л.
Электролиз раствора гидроксида натрия
Задача 202.
При электролизе водного раствора NaOH, через Pt-электроды пропустили ток, силой 3 А. Напишите уравнения электродных реакций. Рассчитайте объемы газов, выделившихся на электродах за 3 часа (н. у.).
Решение:
Электродные процессы:
на катоде: 2|2Н2О + 2ē = Н2↑ + 2ОН − ;
на аноде: 1|2Н2О — 4ē = О2↑ + 4Н + .
Суммарное уравнение процесса получим, умножив уравнение на катоде на два и, сложив его с анодным уравнением:
6Н2О = 2Н2↑ + 4ОН − + О2↑ + 4Н + .
у катода у анода
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
Здесь V – объём выделившегося газа, л;
m(B) – масса выделившегося вещества, г;
VЭ – эквивалентный объём газа, л/моль;
МЭ(В) – масса эквивалента вещества, г/моль;
I – сила тока, А;
t – время, с;
F – число Фарадея, 96500 Кл/моль.
V(H2) = 11,2•3•10800/96500 = 3,76 л;
V(О2) = 5,6•3•10800/96500 = 1,88 л.
Электролиз раствора сульфата цинка
Задача 203.
Какие реакции протекают на электродах при электролизе раствора сульфата цинка: а) с графитовым анодом; б) с цинковым анодом.
Решение:
а) электролиз раствора сульфата цинка с графитовым анодом
1-й вариант электролиза раствора сульфата цинка с графитовым анодом
Для цинка, как металла со средней химической активностью, расположенного в ряду активности после алюминия, на катоде происходят одновременно две
реакции – образование водорода и выделение металла.
Так как ZnSO4 является кислородсодержащей кислотой, то на аноде будет происходить окисление воды с выделением кислорода.
Схемы электродных процессов электролиза раствора ZnSO4 выглядят следующим образом:
ZnSO4 = Zn 2+ + SO4 2- (диссоциация соли)
К(-): 1|Zn 2+ + 2ē = Zn 0
1|2Н2О + 2ē = Н2↑ + 2ОН —
А(+): 1|2Н2О — 4ē = О2↑ + 4Н +
Суммарное ионно-молекулярное уравнение:
После приведения членов, получим:
Суммарное молекулярное уравнение:
Таким образом, при электролизе раствора сульфата цинка с угольным электродом на катоде будет наблюдаться выделение газообразного водорода и металлического цинка, а на аноде будет наблюдаться выделение газообразного кислорода.
Выводы:
1) В случае электролиза водного раствора ZnSO4 одновременно протекают два процесса:
2-й вариант электролиза раствора сульфата цинка с графитовым анодом
Рассмотрим альтернативное протекание электролиза водного раствора ZnSO4.
Замечено, что в растворе есть гидроксид-ионы (ОН — ), но в предыдущей записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор (Zn 2+ ). Так как удвоилось количество ионов цинка, необходимо удвоить и количество сульфат-ионов:
К(-): Zn 2+ + 2ē = Zn 0
2Н2О + 2ē = Н2↑ + 2ОН —
Zn 2+ (в растворе)
А(+): 2Н2О — 4ē = О2↑ + 4Н +
2SO4 2- (в растворе)
Складываем левые и правые части катодных и анодных процессов получим суммарное ионно-молекулярное уравнение:
Zn 2+ + 2H2O + Zn 2+ + + 2H2O + 2SO4 2- = Zn 0 + Zn 2+ + Н2↑ + + 2ОН — + О2↑ + 2SO4 2- + 4Н + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза, получим:
Выводы:
1) В случае электролиза водного раствора ZnSO4 одновременно протекают два процесса:
Таким образом, при электролизе раствора сульфата цинка с угольным электродом на катоде будет наблюдаться выделение газообразного водорода, металлического цинка и гидроксида цинка, а на аноде будет наблюдаться выделение газообразного кислорода.
б) электролиз раствора сульфата цинка с цинковым анодом
На катоде так же как и при электролизе раствора ZnSO4 с угольным электродом происходят одновременно две реакции – образование водорода и выделение металла, а ионы цинка Zn2+, приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление цинка – материала анода, поскольку, отвечающий системе: Zn 0 + 2ē ⇔ Zn 2+ (-0,76 В) значительно ниже системы:
S2O8 2- +2ē =2SO4 2- (+2,01 В).
Сульфат-ионы, движущиеся к аноду, будут накапливаться в анодном пространстве.
Таким образом, на аноде будет происходить растворение цинка — материал анода, а на катоде – выделение газообразного водорода и малорастворимого соединения Zn(OH)2 [Zn 2+ + 2OH — = Zn(OH)2].
Уравнения электродных процессов:
К(-): 1|Zn 2+ + 2ē = Zn 0
1|2Н2О + 2ē = Н2↑ + 2ОН —
A(+): 2|Zn 0 — 2ē = Zn 2+
Суммарное ионно-молекулярное уравнение:
Zn 2+ + 2H2O + 2Zn 0 = Zn 0 + Н2↑ + 2OH — + Zn 2+
у катода у анода
После приведения равенства, получим:
2H2O + Zn 0 = Н2↑ + 2OH — + Zn 2+ (ионно-молекулярная форма);
2H2O + Zn 0 = Н2↑ + Zn(ОН2 (молекулярная форма).
Таким образом, при электролизе ZnSO4 с цинковым анодом на катоде будет наблюдаться выделение газообразного водорода и в осадок выпадает гидроксид цинка, на аноде будет происходить растворение материала анода (цинк).
Видео:Схема электролиза водного раствора NaClСкачать

Электролиз
Видео:Химия ЕГЭ 2022 / Задание 20Скачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Электролиз раствора KIСкачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:8 класс. Химия. Соли (получение фосфата кальция).Скачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:ЕГЭ. Химия.Задача 34. Электролиз. Часть 3.Скачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
📽️ Видео
Задание 20. ЕГЭ 2022 по химии (ЕГЭ по химии 2018. Демо. Задание 22. Электролиз)Скачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. 1 часть. 11 класс.Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

Разбор задания 20 ЕГЭ 2024. Электролиз расплавов и растворовСкачать

Разбор всех типов 31 задания из сборника Добротина 2023 | Екатерина СтрогановаСкачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Гидролиз солей. 9 класс.Скачать

Электролиз растворов. 1 часть. 10 класс.Скачать

92. Электролиз. ЕГЭ (часть 3)Скачать