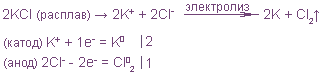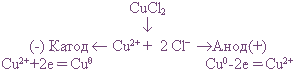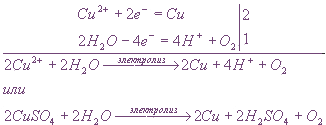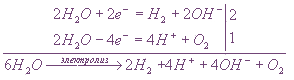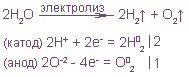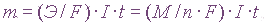- Электролиз
- Электролиз растворов
- Катодные процессы
- Анодные процессы
- Суммарные процессы электролиза
- Электролиз расплавов
- Электролиз с растворимыми электродами
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 1. Электролиз расплава хлорида меди (II).
- 2. Электролиз расплава хлорида калия:
- Электролиз растворов
- 1. На аноде могут образовываться следующие продукты:
- 2. На катоде могут образовываться следующие продукты:
- Пример: Электролиз водного раствора нитрата серебра на инертных электродах
- Пример: Электролиз водного раствора хлорида меди на инертных электродах
- Пример: Электролиз водного раствора хлорида магния на инертных электродах
- Пример: Электролиз водного раствора сульфата меди на инертных электродах
- Пример: Диссоциация сульфата калия в водном растворе:
- Электролиз расплава гидроксида натрия
- Закон Фарадея
- Гидролиз неорганических соединений
- Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
- Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
- Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
- Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
- 🎬 Видео
Видео:Электролиз. 10 класс.Скачать

Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
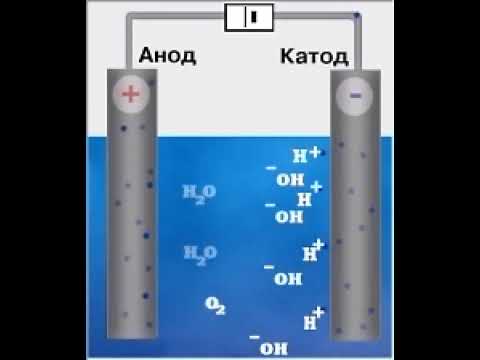
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.
Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Видео:Электролиз раствора нитрата калияСкачать

Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :
Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
2 H + 2O +2ē → H2 0 + 2OH —
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Me n+ + nē → Me 0
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
2H2 O -2 – 4ē → O2 0 + 4H +
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются хлорид-ионы до молекулярного хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На катоде восстанавливается водород из воды:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
2 H2 + O -2 → 2 H2 0 + O2 0
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавли-ваются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Анод (+): 2 Cl – – 2ē → Cl2 0
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0
Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0
В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Видео:Электролиз раствора сульфата натрияСкачать

Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присут-ствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Видео:Электролиз растворов. 2 часть. 10 класс.Скачать

Please wait.
Видео:электролиз раствора сульфата натрияСкачать

We are checking your browser. gomolog.ru
Видео:Электролиз раствора сульфата меди(II)Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Электролиз раствора иодида калияСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6ded0f4ae9719725 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:уравнения электролизаСкачать

1. Электролиз расплава хлорида меди (II).
Электродные процессы могут быть выражены полуреакциями:
на катоде K(-): Сu 2+ + 2e = Cu 0
на аноде A(+): 2Cl – — 2e = Cl2
Общая реакция электрохимического разложения вещества представляет собой сумму двух электродных полуреакций, и для хлорида меди она выразится уравнением:
Cu 2+ + 2 Cl – = Cu + Cl2
При электролизе щелочей и солей оксокислот на аноде выделяется кислород:
Видео:Опыты по химии. Электролиз раствора хлорида медиСкачать

2. Электролиз расплава хлорида калия:
Электролиз растворов
Совокупность окислительно-восстановительных реакций, которые протекают на электродах в растворах или расплавах электролитов при пропускании через них электрического тока, называют электролизом.
источника тока происходит процесс передачи электронов катионам из раствора или расплава, поэтому катод является «восстановителем».
происходит отдача электронов анионами, поэтому анод является «окислителем».
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого)
анода (например, графита или платины), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
— окисление анионов и гидроксид-ионов,
— восстановление катионов и ионов водорода.
При проведении электролиза с использованием активного (расходуемого)
анода процесс усложняется и конкурирующими реакциями на электродах являются:
— окисление анионов и гидроксид-ионов, анодное растворение металла — материала анода;
— восстановление катиона соли и ионов водорода, восстановление катионов металла, полученных при растворении анода.
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с инертным электродом используют следующие правила:
Видео:Электролиз раствора иодида калияСкачать

1. На аноде могут образовываться следующие продукты:
а) при электролизе растворов, содержащих в своем составе анионы SO4 2- , NО — 3, РО4 3- , а также растворов щелочей на аноде окисляется вода и
б) при окислении анионов Сl — , Вr — , I — выделяются соответственно
А + Cl — +e — = Cl 0
Видео:Электролиз иодида калияСкачать

2. На катоде могут образовываться следующие продукты:
а) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений левее Аl 3+ , на катоде восстанавливается вода и
б) если ион металла расположен в ряду напряжений правее водорода, то на катоде
К — Me n+ + ne — = Me 0
в) при электролизе растворов солей, содержащих ионы, расположенные в ряду напряжений между Al + и Н + , на катоде могут протекать конкурирующие процессы как
восстановления катионов, так и выделения водорода
Видео:Электролиз раствора сульфата меди(II)Скачать

Пример: Электролиз водного раствора нитрата серебра на инертных электродах
Диссоциация нитрата серебра:
При электролизе водного раствора АgNО3 на катоде происходит восстановление ионов Аg + , а на аноде — окисление молекул воды:
Катод: Аg + + е = А g
Составьте схемы электролиза водных растворов: а) сульфата меди; б) хлорида магния; в) сульфата калия.
Во всех случаях электролиз проводится с использованием угольных электродов.
Видео:Электролиз. Часть 4. Расплав сульфата натрияСкачать

Пример: Электролиз водного раствора хлорида меди на инертных электродах
Диссоциация хлорида меди:
В растворе находятся ионы Си 2+ и 2Сl — , которые под действием электрического тока направляются к соответствующим электродам:
Катод — Cu 2+ + 2e = Cu 0
Анод + 2Cl — — 2e = Cl2
На катоде выделяется металлическая медь, на аноде — газообразный хлор.
Если в рассмотренном примере электролиза раствора CuCl2 в качестве анода взять медную пластинку, то на катоде выделяется медь, а на аноде, где происходят процессы окисления, вместо разрядки ионов Сl 0 и выделения хлора протекает окисление анода (меди).
В этом случае происходит растворение самого анода, и в виде ионов Сu 2+ он переходит в раствор.
Электролиз CuCl2 с растворимым анодом можно записать так:
Электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
Видео:Опыты по химии. Электролиз раствора йодида калияСкачать

Пример: Электролиз водного раствора хлорида магния на инертных электродах
Диссоциация хлорида магния в водном растворе:
Ионы магния не могут восстанавливаться в водном растворе
(идет восстановление воды)
Видео:Гидроксид калия ЭлекиролизСкачать
Пример: Электролиз водного раствора сульфата меди на инертных электродах
В растворе сульфат меди диссоциирует на ионы:
Ионы меди могут восстанавливаться на катоде в водном растворе.
Сульфат-ионы в водном растворе не окисляются, поэтому на аноде будет протекать окисление воды.
Электролиз водного раствора соли активного металла и кислородсодержащей кислоты (К2SО4) на инертных электродах
Видео:Делаю электролиз раствора нитрата калия при помощи модуля НПО УнитехСкачать

Пример: Диссоциация сульфата калия в водном растворе:
Ионы калия и сульфат-ионы не могут разряжаться на электродах в водном растворе, следовательно,
на катоде будет протекать восстановление
аноде — окисление воды.
или, учитывая, что
(осуществляется при перемешивании),
H2O 
Если пропускать электрический ток через водный раствор соли активного металла и кислородсодержащей кислоты, то ни катионы металла, ни ионы кислотного остатка не разряжаются.
На катоде выделяется водород, а на аноде — кислород, и электролиз сводится к электролитическому разложению воды.
Видео:Электролиз раствора сульфата меди(II)Скачать

Электролиз расплава гидроксида натрия
проводится всегда в присутствии инертного электролита (для увеличения электропроводности очень слабого электролита — воды):
Видео:Электролиз раствора KIСкачать

Закон Фарадея
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фарадея:
— масса образовавшегося при электролизе вещества (г);
— эквивалентная масса вещества (г/моль);
— молярная масса вещества (г/моль);
— количество отдаваемых или принимаемых электронов;
— продолжительность процесса (с);
— константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества
(F = 96 500 Кл/моль = 26,8 Ач/моль).
Гидролиз неорганических соединений
Взаимодействие ионов соли с водой, приводящее к образованию молекул слабого электролита, называют
Если рассматривать соль как продукт нейтрализации основания кислотой, то можно разделить соли на четыре группы, для каждой из которых гидролиз будет протекать по-своему.
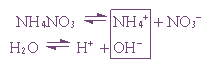
1. Соль, образованная сильным основанием и сильной кислотой KBr, NaCl, NaNO3)
, гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется. Реакция среды остается нейтральной.
2. В соли, образованной слабым основанием и сильной кислотой FeCl2, NH4Cl, Al2(SO4)3, MgSO4)
гидролизу подвергается катион:
FeCl2 + HOH → Fe(OH)Cl + HCl
Fe 2+ + 2Cl — + H + + OH — → FeOH + + 2Cl — + Н +
В результате гидролиза образуется слабый электролит, ион H + и другие ионы. рН раствора
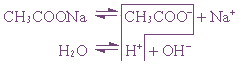
3. Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3, CH3COONa)
подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид ион и другие ионы.
2K + +SiO3 2- + Н + + ОH — → НSiO3 — + 2K + + ОН —
рН таких растворов > 7 ( раствор приобретает щелочную реакцию).
гидролизуется и по катиону, и по аниону. В результате образуется малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания.
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и силиного основания
Различают несколько вариантов гидролиза солей:
1. Гидролиз соли слабой кислоты и сильного основания:
Пример 1. Гидролиз ацетата натрия.
или CH3COO – + Na + + H2O ↔ CH3COOH + Na + + OH –
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H + , и равновесие диссоциации воды смещается вправо согласно принципу Ле Шателье.
В растворе накапливаются ионы OH — ( pH >7)
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато.
Например, гидролиз карбоната:
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей.
Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3 – ), чем на второй (H2CO3)
Пример 2 . Гидролиз ортофосфата рубидия.
1. Определяем тип гидролиза:
Рубидий – щелочной металл, его гидроксид — сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, — слабая кислота.
Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Продукты — гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Получили кислую соль – гидрофосфат рубидия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и слабого основания
2. Гидролиз соли сильной кислоты и слабого основания:
Пример 1. Гидролиз нитрата аммония.
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень : Cu 2+ + HOH ↔ CuOH + + H +
II ступень : CuOH + + HOH ↔ Cu(OH)2 + H +
При этом концентрация ионов водорода и pH среды в растворе также определяются главным образом первой ступенью гидролиза.
Пример 2. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза.
На этом этапе необходимо написать уравнение диссоциации соли:
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты.
Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu 2+ + H-OH ↔ CuOH + + H + .
Образуется катион гидроксомеди(II) и ион водорода,
3. Составляем молекулярное уравнение.
Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два.
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)».
Алгоритм написания уравнений реакций гидролиза соли слабой кислоты и слабого основания
3. Гидролиз соли слабой кислоты и слабого основания:
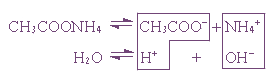
Пример 1. Гидролиз ацетата аммония.
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора, например, в виде осадка или газообразного вещества, то гидролиз протекает до конца.
Пример 2. Гидролиз сульфида алюминия.
2А l 3+ + 3 S 2- + 6Н2О = 2Аl(OН)3(осадок) + ЗН2S (газ)
Пример 3. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Соль образована катионом слабого основания и анионами слабой кислоты.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al 3+ + H–OH ↔ AlOH 2+ + H + ,
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону.
Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3 . Составляем молекулярное уравнение:
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Алгоритм написания уравнений реакций гидролиза соли сильной кислоты и сильного основания
4. Соли, образованные сильной кислотой и сильным основанием
, гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O.
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален.
🎬 Видео
Электролиз сульфата МАРГАНЦАСкачать