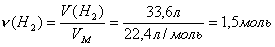Одним из способов получения металлов является электролиз. Активные металлы встречаются в природе только в виде химических соединений. Как выделить из этих соединений в свободном состоянии?
Растворы и расплавы электролитов проводят электрический ток. Однако при пропускании тока через раствор электролита могут происходить химические реакции. Рассмотрим, что будет происходить, если в раствор или расплав электролита поместить две металлические пластинки, каждая из которых соединена с одним из полюсов источника тока. Эти пластинки называются электродами. Электрический ток представляет собой движущийся поток электронов. В результате того, что электроны в цепи движутся от одного электрода к другому, на одном из электродов возникает избыток электронов. Электроны имеют отрицательный заряд, поэтому этот электрод заряжается отрицательно. Его называют катодом. На другом электроде создается недостаток электронов, и он заряжается положительно. Этот электрод называют анодом. Электролит в растворе или расплаве диссоциирует на положительно заряженные ионы — катионы и отрицательно заряженные ионы — анионы. Катионы притягиваются к отрицательно заряженному электроду — катоду. Анионы притягиваются к положительно заряженному электроду — аноду. На поверхности электродов может происходить взаимодействие между ионами и электронами.
Электролизом называются процессы, происходящие при пропускании через растворы или расплавы электролитов электрического тока.
Процессы, происходящие при электролизе растворов и расплавов электролитов, достаточно сильно отличаются. Рассмотрим подробно оба этих случая.
В качестве примера рассмотрим электролиз расплава хлорида натрия. В расплаве хлорид натрия диссоциирует на ионы Na +
и Cl — : NaCl = Na + + Cl —
Катионы натрия перемещаются к поверхности отрицательно заряженного электрода — катода. На поверхности катода имеется избыток электронов. Поэтому происходит передача электронов от поверхности электрода к ионам натрия. При этом ионы Na + превращаются в атомы натрия, то есть происходит восстановление катионов Na + . Уравнение процесса:
Хлорид-ионы Cl — перемещаются к поверхности положительно заряженного электрода — анода. На поверхности анода создан недостаток электронов и происходит передача электронов от анионов Cl — к поверхности электрода. При этом отрицательно заряженные ионы Cl — превращаются в атомы хлора, которые сразу же соединяются в молекулы хлора С l 2 :
2С l — -2е — = Cl 2
Хлорид-ионы теряют электроны, то есть происходит их окисление.
Запишем вместе уравнения процессов, происходящих на катоде и аноде
2 С l — -2 е — = Cl2
В процессе восстановления катионов натрия участвует один электрон, а в процессе окисления ионов хлора — 2 электрона. Однако должен соблюдаться закон сохранения электрического заряда, то есть общий заряд всех частиц в растворе должен быть постоянным Следовательно, число электронов, участвующих в восстановлении катионов натрия, должно быть равно числу электронов, участвующих в окислении хлорид-ионов Поэтому первое уравнение умножим на 2:
2С l — -2е — = Cl 2 1
Сложим вместе оба уравнения и получим общее уравнение реакции.
2 Na + + 2С l — = 2 Na + Cl 2 (ионное уравнение реакции), или
2 NaCl = 2 Na + Cl 2 (молекулярное уравнение реакции)
Итак, на рассмотренном примере мы видим, что электролиз является окислительно-восстановительной реакцией. На катоде происходит восстановление положительно заряженных ионов — катионов, на аноде окисление отрицательно заряженных ионов – анионов. Запомнить, какой процесс где происходит, можно с помощью «правила Т»:
каТод — каТион – воссТановление.
Пример 2. Электролиз расплава гидроксида натрия.
Гидроксида натрия в растворе диссоциирует на катионы и гидроксид-ионы .
Катод (-) Na + + OH — à Анод (+)
На поверхности катода происходит восстановление катионов натрия, при этом образуются атомы натрия:
катод (-) Na + +e à Na
На поверхности анода окисляются гидрокисд-ионы, при этом выделяется кислород и образуются молекулы воды:
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Na + + e à Na
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2
Число электронов, участвующих в реакции восстановления катионов натрия и в реакции окисления гидроксид-ионов, должно быть одинаковым. Поэтому умножим первое уравнение на 4:
катод (-) Na + + e à Na 4
анод (+) 4 OH — – 4 e à 2 H 2 O + O 2 1
Сложим вместе оба уравнения и получим уравнение реакции электролиза:
4 NaOH à 4 Na + 2 H 2 O + O 2
Пример 3. Рассмотрим электролиз расплава Al 2 O 3
При помощи этой реакции получают алюминий из боксита – природного соединения, в котором содержится много оксида алюминия. Температура плавления оксида алюминия очень высокая (более 2000º С), поэтому к нему добавляют специальные добавки, понижающие температуру плавления до 800-900º С. В расплаве оксид алюминия диссоциирует на ионы Al 3+ и O 2- . H а катоде восстанавливаются катионы Al 3+ , превращаясь в атомы алюминия:
На аноде окисляются анионы O 2- , превращаясь в атомы кислорода. Атомы кислорода сразу же соединяются в молекулы О2:
2 O 2- – 4 e à O 2
Число электронов, участвующих в процессах восстановления катионов алюминия и окисления ионов кислорода, должно быть равно, поэтому умножим первое уравнение на 4, а второе на 3:
Al 3+ +3 e à Al 0 4
2 O 2- – 4 e à O 2 3
Сложим оба уравнения и получим общее уравнение электролиза:
4 Al 3+ + 6 O 2- à 4 Al 0 +3 O 2 0 (ионное уравнение реакции)
В случае пропускания электрического тока через водный раствор электролита дело осложняется тем, что в растворе присутствуют молекулы воды, которые также могут взаимодействовать с электронами. Вспомним, что в молекуле воды атомы водорода и кислорода связаны полярной ковалентной связью. Электроотрицательность кислорода больше, чем электроотрицательность водорода, поэтому общие электронные пары смещены к атому кислорода. На атоме кислорода возникает частичный отрицательный заряд, его обозначают δ-, а на атомах водорода -частичный положительный заряд, его обозначают δ+.
Благодаря такому смещению зарядов молекула воды имеет положительный и отрицательный «полюса». Поэтому молекулы воды могут положительно заряженным полюсом притягиваться к отрицательно заряженному электроду — катоду, а отрицательным полюсом — к положительно заряженному электроду — аноду. На катоде может происходить восстановление молекул воды, при этом выделяется водород:
На аноде может происходить окисление молекул воды с выделением кислорода:
Поэтому на катоде могут восстанавливаться либо катионы электролита, либо молекулы воды. Эти два процесса как бы конкурируют между собой. Какой процесс в действительности происходит на катоде, зависит от природы металла. Будут ли на катоде восстанавливаться катионы металла или молекулы воды, зависит от положения металла в ряду напряжений металлов.
Li K Na Ca Mg Al ¦¦ Zn Fe Ni Sn Pb (H2) ¦¦ Cu Hg Ag Au
Если металл находится в ряду напряжений правее водорода, на катоде восстанавливаются катионы металла и выделяется свободный металл. Если металл находится в ряду напряжений левее алюминия, на катоде восстанавливаются молекулы воды и выделяется водород. Наконец, в случае катионов металлов от цинка до свинца может происходить либо выделение металла, либо выделение водорода, а иногда одновременно выделяются и водород, и металл. Вообще это довольно сложный случай, многое зависит от условий реакции: концентрации раствора, сипы электрического тока и других.
На аноде также может происходить один из двух процессов — либо окисление анионов электролита, либо окисление молекул воды. Какой именно процесс будет протекать на самом деле, зависит от природы аниона. При электролизе солей бескислородных кислот или самих кислот на аноде окисляются анионы. Единственным исключением является фторид-ион F — . В случае кислородсодержащих кислот на аноде окисляются молекулы воды и выделяется кислород.
Пример 1. Давайте рассмотрим электролиз водного раствора хлорида натрия.
В водного растворе хлорида натрия будут находиться катионы натрия Na + , анионы хлора Cl — и молекулы воды.
2 NaCl à 2 Na + + 2 Cl —
2Н2О à 2 H + + 2 OH —
катод (-) 2 Na + ; 2 H + ; 2Н + + 2е à Н 0 2
анод (+) 2 Cl — ; 2 OH — ; 2 Cl — – 2е à 2 Cl 0
Химическая активность анионов в ряду уменьшается.
Пример 2. А если в состав соли входит SO 4 2- ? Рассмотрим электролиз раствора сульфата никеля ( II ). Сульфата никеля ( II ) диссоциирует на ионы Ni 2+ и SO 4 2- :
Катионы никеля находятся между ионами металлов Al 3+ и Pb 2+ , занимающих в ряду напряжения среднее положение, процесс восстановления на катоде происходит по обеим схемам:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
Анионы кислородсодержащих кислот не окисляются на аноде ( ряд активности анионов), происходит окисление молекул воды:
анод (+) SO4 2- ; OH — ; 2H2O – 4 е à O2 + 4H +
Запишем вместе уравнения процессов, происходящих на катоде и аноде:
катод (-) Ni 2+ ; H + ; Ni 2+ + 2е à Ni 0
анод (+) SO4 2- ; OH — ; 2H2O – 4 е à O2 + 4H +
В процессах восстановления участвуют 4 электрона и в процессе окисления тоже участвуют 4 электрона. Сложим вместе эти уравнения и получим общее уравнение реакции:
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 + 2ОН — + O 2 + 4 H +
В правой части уравнения находятся одновременно ионы Н + и OH — , которые соединяются с образованием молекул воды:
Н + + OH — à H 2 О
Поэтому в правой части уравнения вместо 4 ионов Н + и 2 ионов OH — запишем 2 молекулы воды и 2 иона Н + :
Ni 2+ +2 H 2 О + 2 H 2 О à Ni 0 + H 2 +2 H 2 О + O 2 + 2 H +
Сократим по две молекулы воды в обеих частях уравнения:
Ni 2+ +2 H 2 О à Ni 0 + H 2 + O 2 + 2 H +
Это краткое ионное уравнение. Чтобы получить полное ионное уравнение, нужно добавить в обе части по сульфат-иону SO 4 2- , образовавшиеся при диссоциации сульфата никеля ( II ) и не участвовавшие в реакции:
Таким образом, у нас при электролизе раствора сульфата никеля ( II ) на катоде выделяется водород и никель, а на аноде – кислород.
Пример 3. Написать уравнения процессов, происходящих при электролизе водного раствора сульфата натрия с инертным анодом.
Стандартный электродный потенциал системы Na + + e = Na 0 значительно отрицательнее потенциала водного электрода в нейтральной водной среде (-0,41 В).Поэтому на катоде будет происходить электрохимическое восстановление воды, сопровождающееся выделением водорода
2Н2О à 2 H + + 2 OH —
а ионы Na + , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство).
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода
2 H 2 O – 4е à O 2 + 4 H +
поскольку отвечающий этой системе стандартный электродный потенциал (1,23 В) значительно ниже, чем стандартный электродный потенциал (2,01 В), характеризующий систему
Ионы SO 4 2- , движущиеся при электролизе к аноду, будут накапливаться в анодном пространстве.
Умножая уравнение катодного процесса на два, и складывая его с уравнением анодного процесса, получаем суммарное уравнение процесса электролиза:
6 H 2 O = 2 H 2 + 4 OH — + O 2 + 4 H +
Приняв во внимание, что одновременно происходит накопление ионов в катодном пространстве и ионов в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Таким образом, одновременно с выделением водорода и кислорода образуется гидроксид натрия (в катодном пространстве) и серная кислота (в анодном пространстве).
Пример 4. Электролиз раствора сульфата меди ( II ) CuSO 4 .
Катод (-) 2+ + SO4 2- à анод (+)
катод (-) Cu 2+ + 2e à Cu 0 2
анод (+) 2H2O – 4 е à O2 + 4H + 1
В растворе остаются ионы Н + и SO 4 2- , т. к. накапливается серная кислота.
Пример 5. Электролиз раствора хлорида меди ( II ) CuCl 2 .
Катод (-) 2+ + 2Cl — à анод (+)
катод (-) Cu 2+ + 2e à Cu 0
анод (+) 2Cl — – 2e à Cl 0 2
В обоих уравнениях участвуют по два электрона.
Cu 2+ + 2e à Cu 0 1
2Cl — -– 2e à Cl2 1
Cu 2+ + 2 Cl — à Cu 0 + Cl 2 (ионное уравнение)
CuCl 2 à Cu + Cl 2 (молекулярное уравнение)
Пример 6. Электролиз раствора нитрата серебра AgNO 3 .
Катод (-) + + NO3 — à Анод (+)
катод (-) Ag + + e à Ag 0
Ag + + e à Ag 0 4
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 (ионное уравнение)
4 Ag + + 2 H 2 O à 4 Ag 0 + 4 H + + O 2 + 4 NO 3 — (полное ионное уравнение)
4 AgNO 3 + 2 H 2 O à 4 Ag 0 + 4 HNO 3 + O 2 (молекулярное уравнение)
Пример 7. Электролиз раствора соляной кислоты HCl .
Катод (-) H + + Cl — à анод (+)
катод (-) 2 H + + 2 e à H 2
анод (+) 2 Cl — – 2 e à Cl 2
2 H + + 2 Cl — à H 2 + Cl 2 (ионное уравнение)
2 HCl à H 2 + Cl 2 (молекулярное уравнение)
Пример 8. Электролиз раствора серной кислоты H 2 SO 4 .
Катод (-) + + SO4 2- à анод (+)
катод (-) 2H+ + 2e à H2
Пример 9. Электролиз раствора гидроксида калия KOH .
Катод (-) K + + OH — à анод (+)
Катионы калия не будут восстанавливаться на катоде, так как калий находится в ряду напряжения металлов левее алюминия, вместо этого будет происходить восстановление молекул воды:
катод (-) 2H2O + 2e à H2 +2OH — 2
анод (+) 4OH — — 4e à 2H2O +O2 1
Пример 10. Электролиз раствора нитрата калия KNO 3 .
катод (-) 2H2O + 2e à H2 + 2OH- 2
анод (+) 2H2O – 4 е à O2 + 4H+ 1
При пропускании электрического тока через растворы кислородосодержащих кислот, щелочей и солей кислородсодержащих кислот с металлами, находящимися в ряду напряжения металлов, левее алюминия, практически происходит электролиз воды. При этом на катоде выделяется водород, а на аноде кислород.
Выводы. При определении продуктов электролиза водных растворов электролитов можно в простейших случаях руководствоваться следующими соображениями:
1. Ионы металлов с малой алгебраической величиной стандартного потенциала – от Li + до Al 3+ включительно – обладают весьма слабой тенденцией к обратному присоединению электронов, уступая в этом отношении ионам H + (см. Ряд активности катионов). При электролизе водных растворов соединений, содержащих эти катионы, функцию окислителя на катоде выполняют ионы H + , восстанавливаясь при этом по схеме:
2 H 2 O + 2 е à H 2 + 2OH —
2. Катионы металлов с положительными значениями стандартных потенциалов ( Cu 2+ , Ag + , Hg 2+ и др.) обладают большой тенденцией к присоединению электронов по сравнению с ионами. При электролизе водных растворов их солей функцию окислителя на катоде выделяют эти катионы, восстанавливаясь при этом до металла по схеме, например:
Cu 2+ +2 e à Cu 0
3. При электролизе водных растворов солей металлов Zn , Fe , Cd , Ni и др., занимающих в ряду напряжения среднее положение между перечисленными группами, процесс восстановления на катоде происходит по обеим схемам. Масса, выделившегося металла не соответствует в этих случаях количеству протекшего электрического тока, часть которого расходуется на образование водорода.
4. В водных растворах электролитов функцию восстановителей по отношению к аноду-окислитею могут одноатомные анионы ( Cl — , Br — , J — ), кислородосодержащие анионы ( NO 3 — , SO 4 2- , PO 4 3- и другие), а также гидроксильные ионы воды. Более сильными восстановительными свойствами из них обладают галогенид ионы, за исключением F . Ионы OH занимают промежуточное положение между ними и многоатомными анионами. Поэтому при электролизе водных растворов HCl , HBr , HJ или их солеей на аноде происходит окисление галогенид-ионов по схеме:
2 X — -2 e à X 2 0
При электролизе водных растворов сульфатов, нитратов, фосфатов и т.п. функцию восстановителя выполняют ионы , окисляясь при этом по схеме:
4 HOH – 4 e à 2 H 2 O + O 2 + 4 H +
З а дача 1. При электролизе раствора сульфата меди на катоде выделилось 48 г меди. Найдите объем газа, выделившегося на аноде, и массу серной кислоты, образовавшейся в растворе.
Сульфат меди в растворе диссоциирует ни ионы Си 2+ и S 04 2 ‘.
Запишем уравнения процессов, происходящих на катоде и аноде. На катоде восстанавливаются катионы Си , на аноде происходит электролиз воды:
2H20-4e- = 4H + + 02 
Общее уравнение электролиза:
2Cu2+ + 2H2O = 2Cu + 4H+ + O2 (краткоеионное уравнение)
Добавим в обе части уравнения по 2 сульфат-иона, которые образуются при диссоциации сульфата меди, получим полное ионное уравнение:
2Си2+ + 2S042″ + 2Н20 = 2Cu + 4Н+ + 2SO4 2′ + О2
Перепишем уравнение в молекулярном виде:
2CuSO4 + 2H2O = 2Cu + 2H2SO4 + О2
Газ, выделяющийся на аноде — кислород. В растворе образуется серная кислота.
Молярная масса меди равна 64 г/моль, вычислим количество вещества меди:
По уравнению реакции при выделении на катоде 2 моль меди ла аноде выделяется 1 моль кислорода. На катоде выделилось 0,75 моль меди, пусть на аноде выделилось х моль кислорода. Составим пропорцию:
На аноде выделилось 0,375 моль кислорода,
Вычислим объем выделившегося кислорода:
V(O2) = v(O2)«VM = 0,375 моль«22,4 л/моль = 8,4 л
По уравнению реакции при выделении на катоде 2 моль меди в растворе образуется 2 моль серной кислоты, значит, если на катоде выделилось 0,75 моль меди, то в растворе образовалось 0,75 моль серной кислоты, v(H2SO4) = 0,75 моль. Вычислим молярную массу серной кислоты:
M(H2SO4) = 2-1+32+16-4 = 98 г/моль.
Вычислим массу серной кислоты:
m(H2S04) = v(H2S04>M(H2S04) = = 0,75 моль«98 г/моль = 73,5 г.
Ответ: на аноде выделилось 8,4 л кислорода; в растворе образовалось 73,5 г серной кислоты
Задача 2. Найдите объем газов, выделившихся на катоде и аноде, при электролизе водного раствора, содержащего 111,75 г хлорида калия. Какое вещество образовалось в растворе? Найдите его массу.
Хлорид калия в растворе диссоциирует на ионы К+ и Сl:
Ионы калия не восстанавливаются на катоде, вместо этого происходит восстановление молекул воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 20Н- |1
Общее уравнение электролиза:
2СГl+ 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение) В растворе присутствуют также ионы К+, образовавшиеся при диссоциации хлорида калия и не участвующие в реакции:
2К+ + 2Сl + 2Н20 = Н2 + 2К+ + 2ОН’ + С12
Перепишем уравнение в молекулярном виде:
2КС1 + 2Н2О = Н2 + С12 + 2КОН
На катоде выделяется водород, на аноде хлор, в растворе образуется гидроксид калия.
В растворе содержалось 111,75 г хлорида калия.
Вычислим молярную массу хлорида калия:
М(КС1) = 39+35,5 = 74,5 г/моль
Вычислим количество вещества хлорида калия:

По уравнению реакции при электролизе 2 моль хлорида калия выделяется 1 моль хлора. Пусть при электролизе 1,5 моль хлорида калия выделяется х моль хлора. Составим пропорцию:


Выделится 0,75 моль хлора, v(C!2) = 0,75 моль. По уравнению реакции при выделении 1 моль хлора на аноде на катоде выделяется 1 моль водорода. Следовательно, если на аноде выделится 0,75 моль хлора, то на катоде выделится 0,75 моль водорода, v(H2) = 0,75 моль.
Вычислим объем хлора, выделившегося на аноде:
V(C12) = v(Cl2)-VM = 0,75 моль«22,4 л/моль = 16,8 л.
Объем водорода равен объему хлора:
По уравнению реакции при электролизе 2 моль хлорида калия образуется 2 моль гидроксида калия, значит, при электролизе 0,75 моль хлорида калия образуется 0,75 моль гидроксида калия. Вычислим молярную массу гидроксида калия:
М(КОН) = 39+16+1 — 56 г/моль.
Вычислим массу гидроксида калия:
m(KOH) = v(KOH>M(KOH) = 0,75 моль-56 г/моль = 42 г.
Ответ: на катоде выделилось 16,8 л водорода, на аноде выделилось 16,8 л хлора, в растворе образовалось 42 г гидроксида калия.
Задача 3. При электролизе раствора 19 г хлорида двухвалентного металла на аноде выделилось 8,96 л хлора. Определите, хлорид какого металла подвергли электролизу. Вычислите объем водорода, выделившегося на катоде.
Обозначим неизвестный металл М, формула его хлорида МС12. На аноде окисляются хлорид-ионы и выделяется хлор. В условии сказано, что на катоде выделяется водород, следовательно, происходит восстановление молекул воды:
2Н20 + 2е- = Н2 + 2ОH |1
Общее уравнение электролиза:
2Сl + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
В растворе присутствуют также ионы М2+, которые при реакции не изменяются. Запишем полное ионное уравнение реакции:
2СГ + М2+ + 2Н2О = Н2 + М2+ + 2ОН- + С12
Перепишем уравнение реакции в молекулярном виде:
МС12 + 2Н2О — Н2 + М(ОН)2 + С12
Найдем количество вещества выделившегося на аноде хлора:
По уравнению реакции при электролизе 1 моль хлорида неизвестного металла выделяется 1 моль хлора. Если выделилось 0,4 моль хлора, то электролизу подвергли 0,4 моль хлорида металла. Вычислим молярную массу хлорида металла:
Молярная масса хлорида неизвестного металла 95 г/моль. На два атома хлора приходится 35,5»2 = 71 г/моль. Следовательно, молярная масса металла равна 95-71 = 24 г/моль. Этой молярной массе соответствует магний.
По уравнению реакции на 1 моль выделившегося на аноде хлора приходится 1 моль выделившегося на катоде водорода. В нашем случае на аноде выделилось 0,4 моль хлора, значит, на катоде выделилось 0,4 моль водорода. Вычислим объем водорода:
V(H2) = v(H2>VM = 0,4 моль«22,4 л/моль = 8,96 л.
Ответ: электролизу подвергли раствор хлорида магния; на катоде выделилось 8,96 л водорода.
*3адача 4. При электролизе 200 г раствора сульфата калия с концентрацией 15% на аноде выделилось 14,56 л кислорода. Вычислите концентрацию раствора по окончании электролиза.
В растворе сульфата калия и на катоде, и на аноде реагируют молекулы воды:
2Н20 + 2е’ = Н2 + 20Н- |2
2Н2О — 4е’ = 4Н+ + О2 ! 1
Сложим вместе оба уравнения:
6Н2О = 2Н2 + 4ОН» + 4Н+ + О2, или
6Н2О = 2Н2 + 4Н2О + О2, или
Фактически при электролизе раствора сульфата калия происходит электролиз воды.
Концентрация растворенного вещества в растворе определяется по формуле:
С=m(растворенного вещества) 
Чтобы найти концентрацию раствора сульфата калия по окончании электролиза, необходимо знать массу сульфата калия и массу раствора. Масса сульфата калия при реакции не изменяется. Вычислим массу сульфата калия в исходном растворе. Обозначим концентрацию исходного раствора Сь
m(K2S04) = C2 (K2S04 ) 

Масса раствора во время электролиза изменяется, так как часть воды превращается в водород и кислород. Вычислим количество вещества выделившегося кислорода:

По уравнению реакции из 2 моль воды образуется 1 моль кислорода. Пусть 0,65 моль кислорода выделяется при разложении х моль воды. Составим пропорцию:
Разложилось 1,3 моль воды, v(H2O) = 1,3 моль.
Вычислим молярную массу воды:
М(Н2О) =1-2+16=18 г/моль.
Вычислим массу разложившейся воды:
m(H2O) = v(H2O>M(H2O) = 1,3 моль* 18 г/моль = 23,4 г.
Масса раствора сульфата калия уменьшилась на 23,4 г и стала равна 200-23,4 = 176,6 г. Вычислим теперь концентрацию раствора сульфата калия по окончании электролиза:
С2 (K2 SO4 )=m(K2 SO4 ) 

Ответ: концентрация раствора по окончании электролиза равна 17%.
*3адача 5. 188,3 г смеси хлоридов натрия и калия растворили в воде и пропустили через полученный раствор электрический ток. При электролизе на катоде выделилось 33,6 л водорода. Вычислите состав смеси в процентах по массе.
После растворения смеси хлоридов калия и натрия в воде в растворе содержатся ионы К+, Na+ и Сl-. Ни ионы калия, ни ионы натрия не восстанавливаются на катоде, восстанавливаются молекулы воды. На аноде окисляются хлорид-ионы и выделяется хлор:
2Н2О + 2е’ = Н2 + 2ОН» ] 1
Общее уравнение электролиза:
2СГ + 2Н2О = Н2 + 2ОН» + С12 (краткое ионное уравнение)
Полные ионные уравнения реакций электролиза хлорида натрия и хлорида калия.
2К+ + 2Cl 

2Na+ + 2С1 

Перепишем уравнения в молекулярном виде:
2КС1 + 2Н20 = Н2 + С12 + 2КОН
2NaCl + 2Н2О = Н2 + С12 + 2NaOH
Обозначим количество вещества хлорида калия, содержащегося в смеси, х моль, а количество вещества хлорида натрия у моль. По уравнению реакции при электролизе 2 моль хлорида натрия или калия выделяется 1 моль водорода. Поэтому при электролизе х моль хлорида калия образуется х/2 или 0,5х моль водорода, а при электролизе у моль хлорида натрия 0,5у моль водорода. Найдем количество вещества водорода, выделившегося при электролизе смеси:
Составим уравнение: 0,5х + 0,5у =1,5
Вычислим молярные массы хлоридов калия и натрия:
М(КС1) = 39+35,5 = 74,5 г/моль
M(NaCl) = 23+35,5 = 58,5 г/моль
Масса х моль хлорида калия равна:
m(KCl) = v(KCl)-M(KCl) = х моль-74,5 г/моль = 74,5х г.
Масса у моль хлорида натрия равна:
m(KCl) = v(KCl)-M(KCl) = у моль-74,5 г/моль = 58,5у г.
Масса смеси равна 188,3 г, составим второе уравнение:
74,5х + 58,5у= 188,3
Итак, решаем систему из двух уравнений с двумя неизвестными:
Из первого уравнения выразим х:
Подставим это значение х во второе уравнение, получим:
74,5-(3-у) + 58,5у= 188,3
223,5-74,5у + 58,5у= 188,3
Найдем теперь значение х:
В смеси содержится 0,8 моль хлорида калия и 2,2 моль хлорида натрия.
Вычислим массу хлорида калия и хлорида натрия:
m(KCl) = v(KCl) 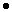
m(KCl) = v(KCl) 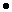
Вычислим массовую долю хлорида калия в смеси:
w(KCl)=m(KCl) 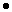
Вычислим массовую долю хлорида натрия:
w(NaCl) = 100% — w(KCl) = 68,35%
Ответ: в смеси содержится 31,65% хлорида калия и 68,35% хлорида натрия.
- Правила составления окислительно-восстановительных реакций
- Электролиз растворов электролитов с инертными электродами
- Процессы, протекающие на катоде:
- Процессы, протекающие на аноде:
- Примеры:
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Содержание:
- Особенности электролиза расплавов
- Особенности электролиза растворов
- Применение электролиза
- 📽️ Видео
Видео:Электролиз. 10 класс.Скачать

Правила составления окислительно-восстановительных реакций
Видео:ЭлектролизСкачать

Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Видео:Электролиз раствора соляной кислоты | ЕГЭ по химииСкачать

Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
Видео:Соляная кислота. Свойства и особенности. То чего вы не знали.Скачать

Электролиз расплавов и растворов (солей, щелочей, кислот)
Содержание:
Сильнейшим окислительно — восстановительным действием обладает электрический ток. С помощью воздействия электрического тока на вещество можно получить чистый металл. Этот метод называется электролизом.
Электролиз – процесс, при котором происходит разложение вещества электрическим током.
Процесс электролиза может протекать только в веществах, проводящих электрический ток, то есть электролитах. К электролитам относят представителей основных классов неорганических соединений – кислоты, соли, щелочи.
Для протекания процесса требуется устройство, называемое электролизером.
Данное устройство работает от внешнего источника питания, который подает электрический ток. Представляет собой емкость, в которую опущены два электрода (катод и анод), заполнена емкость электролитом. При подаче электрического тока происходит разложение вещества. Для того чтобы узнать протекает электролиз или нет, в цепь включают лампочку, если лампочка загорается, значит в системе есть ток, если при замыкании цепи, лампочка не горит, то электролиз не протекает – вещество является не электролитом.
Катод (-) – является отрицательно заряженным электродом, катионы ( + ) перемещаются к нему и происходит процесс восстановления.
Анод (+) – положительно заряженный электрод, к нему перемещаются анионы (-) и происходит процесс окисления.
Можно выделить два типа электролиза для расплавов и растворов. Ход этих двух процессов происходит по-разному. Зависит по большей части это от содержания воды в растворе, которая тоже принимает участие в процессе. В расплаве происходит разложение только вещества.
Видео:Химия 9 класс (Урок№10 - Галогены. Хлор. Хлороводород. Соляная кислота и её соли.)Скачать

Особенности электролиза расплавов
В расплаве электролит непосредственно подвергается воздействию электрического тока. Металл всегда образуется на катоде, а продукт анода зависит от природы вещества.
При разложении расплава оснований на катоде образуется металл, а на аноде окисляется кислород. (расплав соли – это чистое вещество без примесей в основном твердые вещества)
Разложение расплавов солей происходит по-разному у бескислородных и кислородосодержащих. У бескислородной соли на аноде окисляется анион – кислотный остаток, а у кислородосодержащей – окисляется кислород.
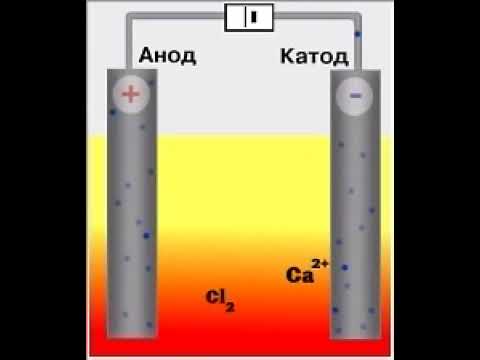
Рассмотрим пример электролиза расплава бескислородной соли – хлорида калия. Под действием постоянного электрического тока соль разлагается на катионы калия и анионы хлора.
Катионы K + перемещаются к катоду и принимают электроны, происходит восстановление металлического калия.
Анионы Cl — движутся к аноду, отдавая электроны, происходит образование газообразного хлора.
Суммарное уравнение процесса электролиза расплава хлористого калия можно представить следующим образом:
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Особенности электролиза растворов
В растворах электролитов, помимо самого вещества, присутствует вода. Под действием электрического тока водный раствор электролита разлагается.
Процессы, происходящие на катоде и аноде, различаются.
1. Процесс на катоде не зависит от материала, из которого он изготовлен. Однако, зависит от положения металлов в электрохимическом ряду напряжений.
2. Процесс на аноде зависит от материала, из которого состоит анод и от его природы.
а) Растворимый анод (Cu, Ag, Ni, Cd) подвергается Me => Me n+ + ne
б) На не растворимом аноде (графит, платина) обычно окисляются анионы S — , J — , Br — , Cl — , OH — и молекулы H2O:
Рассмотрим примеры различных вариантов электролиза растворов:
1. Разложение бескислородной соли на нерастворимом электроде
Чтобы ознакомиться с этим вариантом электролиза, возьмем йодистый калий. Под действием тока ионы калия устремляются к катоду, а ионы йода к аноду.
Калий находится в диапазоне активности слева от алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется атомарный водород.
Процесс протекает на нерастворимом аноде и в состав соли входит бескислородный остаток, поэтому на аноде образуется йод.
В результате можно создать общее уравнение электролиза:
2. Разложение бескислородной соли на растворимом электроде (медь)
Рассмотрим на примере хлорида натрия. Данная соль разлагается на ионы натрия и хлора, но следует учитывать материал анода. Медный анод сам подвергается окислению. На аноде выделяется чистая медь, и ионы меди переходят с анода на катод, где также осаждается медь. В итоге процесс можно представить следующими уравнениями реакций.
- NaCl → Na + + Cl —
- Катод: Cu 2+ + 2e — → Cu 0
- Анод: Cu 0 — 2e — → Cu 2+
В растворе концентрация хлорида натрия остается неизменной, поэтому составить общее уравнение реакции процесса не представляется возможным.
3. Разложение кислородосодержащей соли на нерастворимом (инертном) электроде
Возьмем для примера раствор нитрата калия. В процессе электролиза происходит распад на ионы калия и кислотного остатка.
В ряду активности металлов калий находится левее алюминия, поэтому на катоде восстанавливаются молекулы воды и образуется газообразный водород.
Молекулы воды окисляются на аноде и выделяется кислород.
В результате получаем общее уравнение электролиза:
4. Электролиз раствора щелочи на инертном электроде
В случае разложения щелочи в процесс электролиза включаются молекулы воды и гидроксид-ионы.
Барий находится левее алюминия, поэтому на катоде происходит восстановление воды и выделение водорода.
На аноде откладываются молекулы кислорода.
Получаем суммарное уравнение электролиза:
5. Электролиз раствора кислоты на инертном электроде
При разложении азотной кислоты под действием электрического тока в процесс вступают катионы водорода и молекула воды.
На катоде выделяется водород, на аноде – кислород. Получаем суммарное уравнение процесса:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Применение электролиза
Процессы электролиза нашли свое применение в промышленности в первую очередь для получения чистых металлов электрохимическим путем. Побочными продуктами этого процесса являются кислород и водород, поэтому он является промышленным способом получения этих газов. Очень часто применяют для очистки металлов от примесей и защиты от коррозии.
📽️ Видео
Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Получение СОЛЯНОЙ кислотыСкачать

Солошенко К.В. Производство едкого натра, хлора, водорода и соляной кислоты.Скачать

Химия 8 класс Взаимодействие карбоната натрия и соляной кислотыСкачать

Хлороводородная кислота. 9 класс.Скачать

Электролиз растворов. 2 часть. 10 класс.Скачать

Взаимодействие металлов с соляной кислотойСкачать

Химия 8 класс. Хлороводород и соляная кислотаСкачать

Электролиз сульфата МАРГАНЦАСкачать

СОЛЯНАЯ КИСЛОТА | HCl | Химические свойства СОЛЯНОЙ КИСЛОТЫ | Хлороводород | Нитрат серебра | ХимияСкачать

хлорид кальция ; электролизСкачать
Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Опыты по химии. Соляная кислота и металлыСкачать