Видео:Качественная реакция ионов хрома(III) со щелочью. Получение и свойства гидроксида хромаСкачать

Электролиз растворов электролитов с инертными электродами
Напомним, что на катоде протекают процессы восстановления, на аноде — процессы окисления.
Процессы, протекающие на катоде:
В растворе имеются несколько видов положительно заряженных частиц, способных восстанавливаться на катоде:
1) Катионы металла восстанавливаются до простого вещества, если металл находится в ряду напряжений правее алюминия (не включая сам Al). Например:
Zn 2+ +2e → Zn 0 .
2) В случае раствора соли или щелочи: катионы водорода восстанавливаются до простого вещества, если металл находится в ряду напряжений металлов до H2:
2H2O + 2e → H2 0 + 2OH – .
Например, в случае электролиза растворов NaNO3 или KOH.
3) В случае электролиза раствора кислоты: катионы водорода восстанавливаются до простого вещества:
2H + +2e → H2.
Например, в случае электролиза раствора H2SO4.
Процессы, протекающие на аноде:
На аноде легко окисляются кислотные остатки не содержащие кислород. Например, галогенид-ионы (кроме F – ), сульфид-анионы, гидроксид-анионы и молекулы воды:
1) Галогенид-анионы окисляются до простых веществ:
2Cl – – 2e → Cl2.
2) В случае электролиза раствора щелочи в гидроксид-анионах кислород окисляется до простого вещества. Водород уже имеет степень окисления +1 и не может быть окислен дальше. Также будет выделение воды — почему? Потому что больше ничего написать и не получится: 1) H + написать не можем, так как OH – и H + не могут стоять по разные стороны одного уравнения; 2) H2 написать также не можем, так как это был бы процесс восстановления водорода (2H + +2e → H2), а на аноде протекают только процессы окисления.
4OH – – 4e → O2 + 2H2O.
3) Если в растворе есть анионы фтора или любые кислородсодержащие анионы, то окислению будет подвергаться вода с подкислением прианодного пространства согласно следующему уравнению:
2H2O – 4e → O2 + 4H + .
Такая реакция идет в случае электролиза растворов кислородсодержащих солей или кислородсодержащих кислот. В случае электролиза раствора щелочи окисляться будут гидроксид-анионы согласно правилу 2) выше.
4) В случае электролиза раствора соли органической кислоты на аноде всегда происходит выделение CO2 и удвоение остатка углеродной цепи:
2R-COO – – 2e → R-R + 2CO2.
Видео:Хлорид хрома (III)Скачать

Примеры:
1. Раствор NaCl
Расписываем диссоциацию на ионы:
NaCl → Na + + Cl –
Металл Na стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается водород. Хлорид-анионы будут окисляться на аноде до простого вещества:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2Cl – – 2e → Cl2
Коэффициент 2 перед Na + появился из-за наличия аналогичного коэффициента перед хлорид-ионами, так как в соли NaCl их соотношение 1:1.
Проверяем, что количество принимаемых и отдаваемых электронов одинаковое, и суммируем левые и правые части катодных и анодных процессов:
2Na + + 2Cl – + 2H2O → H2 0 + 2Na + + 2OH – + Cl2. Соединяем катионы и анионы:
2NaCl + 2H2O → H2 0 + 2NaOH + Cl2.
2. Раствор Na2SO4
Расписываем диссоциацию на ионы:
Na2SO4 → 2Na + + SO4 2–
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. Сульфат-анионы содержат кислород, поэтому окисляться не будут, также оставаясь в растворе. Согласно правилу выше, в этом случае окисляются молекулы воды:
К: 2H2O + 2e → H2 0 + 2OH –
А: 2H2O – 4e → O2 0 + 4H + .
Уравниваем число принимаемых и отдаваемых электронов на катоде и аноде. Для этого необходимо умножить все коэффициенты катодного процесса на 2:
К: 4H2O + 4e → 2H2 0 + 4OH –
А: 2H2O – 4e → O2 0 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
6H2O → 2H2 0 + 4OH – + 4H + + O2 0 .
4OH- и 4H+ соединяем в 4 молекулы H2O:
6H2O → 2H2 0 + 4H2O + O2 0 .
Сокращаем молекулы воды, находящиеся по обе стороны уравнения, т.е. вычитаем из каждой части уравнения 4H2O и получаем итоговое уравнение гидролиза:
2H2O → 2H2 0 + O2 0 .
Таким образом, гидролиз растворов кислородсодержащих солей активных металлов (до Al включительно) сводится к гидролизу воды, так как ни катионы металлов, ни анионы кислотных остатков не принимают участие в окислительно-восстановительных процессах, протекающих на электродах.
3. Раствор CuCl2
Расписываем диссоциацию на ионы:
CuCl2 → Cu 2+ + 2Cl –
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться только хлорид-анионы.
К: Cu 2+ + 2e → Cu 0
A: 2Cl – – 2e → Cl2
Записываем суммарное уравнение:
CuCl2 → Cu 0 + Cl2.
4. Раствор CuSO4
Расписываем диссоциацию на ионы:
CuSO4 → Cu 2+ + SO4 2–
Медь находится в ряду напряжений металлов после водорода, следовательно, только она будет восстанавливаться на катоде. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Cu 2+ + 2e → Cu 0
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Уравниваем количество электронов на катоде и аноде. Для это умножим все коэффициенты катодного уравнения на 2. Количество сульфат-ионов также необходимо удвоить, так как в сульфате меди соотношение Cu 2+ и SO4 2– 1:1.
К: 2Cu 2+ + 4e → 2Cu 0
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Записываем суммарное уравнение:
2Cu 2+ + 2SO4 2– + 2H2O → 2Cu 0 + O2 + 4H + + 2SO4 2– .
Соединив катионы и анионы, получаем итоговое уравнение электролиза:
2CuSO4 + 2H2O → 2Cu 0 + O2 + 2H2SO4.
5. Раствор NiCl2
Расписываем диссоциацию на ионы:
NiCl2 → Ni 2+ + 2Cl –
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться только хлорид-анионы.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: 2Cl – – 2e → Cl2
Уравниваем количество электронов, принимаемых и отдаваемых на катоде и аноде. Для этого умножаем все коэффициенты анодного уравнения на 2:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 4Cl – – 4e → 2Cl2
Замечаем, что согласно формуле NiCl2, соотношение атомов никеля и хлора 1:2, следовательно, в раствор необходимо добавить Ni 2+ для получения общего количества 2NiCl2. Также это необходимо сделать, так как в растворе должны присутствовать противоионы для гидроксид-анионов.
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 4Cl – + 2H2O → Ni 0 + H2 0 + 2OH – + Ni 2+ + 2Cl2.
Соединяем катионы и анионы для получения итогового уравнения электролиза:
2NiCl2 + 2H2O → Ni 0 + H2 0 + Ni(OH)2 + 2Cl2.
6. Раствор NiSO4
Расписываем диссоциацию на ионы:
NiSO4 → Ni 2+ + SO4 2–
Никель находится в ряду напряжений металлов после алюминия и до водорода, следовательно, на катоде будут восстанавливаться и металл, и водород. На аноде будут окисляться молекулы воды, так как кислородсодержащие кислотные остатки в растворах на аноде не окисляются.
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
A: SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Проверяем, что количество принятых и отданных электронов совпадает. Также замечаем, что в растворе есть гидроксид-ионы, но в записи электродных процессов для них нет противоионов. Следовательно, нужно добавить в раствор Ni 2+ . Так как удвоилось количество ионов никеля, необходимо удвоить и количество сульфат-ионов:
К: Ni 2+ + 2e → Ni 0
2H2O + 2e → H2 0 + 2OH –
Ni 2+ (в растворе)
A: 2SO4 2– (в растворе)
2H2O – 4e → O2 + 4H + .
Складываем левые и правые части катодных и анодных процессов:
Ni 2+ + Ni 2+ + 2SO4 2– + 2H2O + 2H2O → Ni 0 + Ni 2+ + 2OH – + H2 0 + O2 0 + 2SO4 2– + 4H + .
Соединяем катионы и анионы и записываем итоговое уравнение электролиза:
2NiSO4 + 4H2O → Ni 0 + Ni(OH)2 + H2 0 + O2 0 + 2H2SO4.
В других источниках литературы также говорится об альтернативном протекании электролиза кислородсодержащих солей металлов средней активности. Разница состоит в том, что после сложения левых и правых частей процессов электролиза необходимо соединить H + и OH – с образованием двух молекул воды. Оставшиеся 2H + расходуются на образование серной кислоты. В этом случае не нужно прибавлять дополнительные ионы никеля и сульфат-ионы:
Ni 2+ + SO4 2– + 2H2O + 2H2O → Ni 0 + 2OH – + H2 0 + O2 0 + SO4 2– + 4H + .
Ni 2+ + SO4 2– + 4H2O → Ni 0 + H2 0 + O2 0 + SO4 2– + 2H + + 2H2O.
NiSO4 + 2H2O → Ni 0 + H2 0 + O2 0 + H2SO4.
7. Раствор CH3COONa
Расписываем диссоциацию на ионы:
CH3COONa → CH3COO – + Na +
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу выше, на катоде восстанавливается только водород. На аноде будет происходит окисление ацетат-ионов с образованием углекислого газа и удвоением остатка углеродной цепи:
К: 2Na + (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 2CH3COO – – 2e → CH3-CH3 + CO2
Так как количества электронов в процессах окисления и восстановления совпадают, составляем суммарное уравнение:
2Na + + 2CH3COO – + 2H2O → 2Na + + 2OH – + H2 0 + CH3-CH3 + CO2
Соединяем катионы и анионы:
2CH3COONa + 2H2O → 2NaOH + H2 0 + CH3-CH3 + CO2.
8. Раствор H2SO4
Расписываем диссоциацию на ионы:
H2SO4 → 2H + + SO4 2–
Из катионов в растворе присутствуют только катионы H+, они и будут восстанавливаться до простого вещества. На аноде будет протекать окисление воды, так как кислород содержащие кислотные остатки в растворах на аноде не окисляются.
К: 2H + +2e → H2
A: 2H2O – 4e → O2 + 4H +
Уравниваем число электронов. Для этого удваиваем каждый коэффициент в уравнении катодного процесса:
К: 4H + +4e → 2H2
A: 2H2O – 4e → O2 + 4H +
Суммируем левые и правые части уравнений:
4H + + 2H2O → 2H2 + O2 + 4H +
Катионы H + находятся в обеих частях реакции, следовательно, их нужно сократить. Получаем, что в случае растворов кислот, электролизу подвергаются только молекулы H2O:
2H2O → 2H2 + O2.
9. Раствор NaOH
Расписываем диссоциацию на ионы:
NaOH → Na + + OH –
Натрий стоит в ряду напряжений до алюминия, следовательно, восстанавливаться на катоде не будет (катионы остаются в растворе). Согласно правилу, на катоде восстанавливается только водород. На аноде будут окисляться гидроксид-анионы с образованием кислорода и воды:
К: Na+ (в растворе)
2H2O + 2e → H2 0 + 2OH –
А: 4OH – – 4e → O2 + 2H2O
Уравниваем число электронов, принимаемых и отдаваемых на электродах:
К: Na + (в растворе)
4H2O + 4e → 2H2 0 + 4OH –
А: 4OH – – 4e → O2 + 2H2O
Суммируем левые и правые части процессов:
4H2O + 4OH – → 2H2 0 + 4OH – + O2 0 + 2H2O
Сокращая 2H2O и ионы OH – , получаем итоговое уравнение электролиза:
2H2O → 2H2 + O2.
Вывод:
При электролизе растворов 1) кислородсодержащих кислот;
2) щелочей;
3) солей активных металлов и кислородсодержащих кислот
на электродах протекает электролиз воды:
2H2O → 2H2 + O2.
Видео:Электролиз. 10 класс.Скачать

Электролиз
Электролиз (греч. elektron — янтарь + lysis — разложение) — химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы — положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) — на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды — выделяется водород.
В случае, если на катод поступают ионы водорода — H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + — 2e = H2
К аноду притягиваются анионы — отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl — , Br — , I — , F — , S 2- , CH3COO — .
При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- — на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор — если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор — самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ — CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
Теперь вы точно будете знать, что выделяется на катоде 😉
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.
Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись «NaOH», не подвергая его дальнейшему электролизу)
Натрий — активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген — хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно 🙂 Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача — получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Видео:Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Решение химических задач
на закон Фарадея в курсе
средней школы
Среди великого множества разнообразных химических задач, как показывает практика преподавания в школе, наибольшие затруднения вызывают задачи, для решения которых помимо прочных химических знаний требуется неплохо владеть материалом курса физики. И хотя далеко не в каждой средней школе уделяется внимание решению хотя бы простейших задач с использованием знаний двух курсов – химии и физики, задачи такого типа иногда встречаются на вступительных экзаменах в вузах, где химия является профилирующей дисциплиной. А потому, не разобрав задачи такого типа на уроках, учитель может неумышленно лишить своего ученика шанса на поступление в вуз на химическую специальность.
Эта авторская разработка содержит свыше двадцати задач, так или иначе связанных с темой «Электролиз». Для решения задач данного типа необходимо не только хорошо знать тему «Электролиз» школьного курса химии, но и знать закон Фарадея, который изучается в школьном курсе физики.
Возможно, эта подборка задач не будет интересна абсолютно всем ученикам в классе или всем доступна. Тем не менее задачи данного типа рекомендуется разобрать с группой заинтересованных учащихся на кружковом или факультативном занятии. Можно с уверенностью отметить, что задачи такого типа усложненные и по крайней мере не являются типовыми для школьного курса химии (речь идет о средней общеобразовательной школе), а потому задачи данного типа можно смело включать в варианты школьной или районной химической олимпиады для 10-х или 11-х классов.
Наличие подробного решения для каждой задачи делает разработку ценным подспорьем, особенно для начинающих учителей. Разобрав несколько задач с учащимися на факультативном занятии или занятии кружка, творчески работающий учитель непременно задаст несколько однотипных задач на дом и воспользуется данной разработкой в процессе проверки домашних заданий, что позволит существенно сэкономить бесценное учительское время.
Химические реакции, протекающие под действием электрического тока на электродах, помещенных в раствор или расплав электролита, называют электролизом. Рассмотрим пример.
В стаканчике при температуре около 700 °С находится расплав хлорида натрия NaCl, в него погружены электроды. До пропускания через расплав электрического тока ионы Na + и Cl – движутся хаотически, однако при наложении электрического тока движение этих частиц становится упорядоченным: ионы Na + устремляются к отрицательно заряженному электроду, а ионы Cl – – к положительно заряженному электроду.
Ион – заряженный атом или группа атомов, обладающая зарядом.
Катион – положительно заряженный ион.
Анион – отрицательно заряженный ион.
Катод – отрицательно заряженный электрод (к нему движутся положительно заряженные ионы – катионы).
Анод – положительно заряженный электрод (к нему движутся отрицательно заряженные ионы – анионы).


или в молекулярной форме:

В электрохимическом ряду активности металлов медь расположена правее водорода, поэтому медь и будет восстанавливаться на катоде, а на аноде будет окисляться хлор.

Аналогично происходит электролиз водного раствора нитрата калия (платиновые электроды).





Концентрация CuSO4 в растворе остается постоянной, процесс сводится к переносу материала анода на катод. В этом и заключается сущность процесса электрохимического рафинирования (получение чистого металла).
При составлении схем электролиза той или иной соли нужно помнить, что:
– катионы металлов, имеющие больший стандартный электродный потенциал (СЭП), чем у водорода (от меди до золота включительно), при электролизе практически полностью восстанавливаются на катоде;
– катионы металлов с небольшими значениями СЭП (от лития до алюминия включительно) не восстанавливаются на катоде, а вместо них восстанавливаются молекулы воды до водорода;
– катионы металлов, у которых значения СЭП меньше, чем у водорода, но больше, чем у алюминия (от алюминия до водорода), при электролизе на катоде восстанавливаются одновременно с водой;
– если водный раствор содержит смесь катионов различных металлов, например Ag + , Cu 2+ , Fe 2+ , то в этой смеси первым восстановится серебро, затем медь и последним – железо;
– на нерастворимом аноде в процессе электролиза происходит окисление анионов или молекул воды, причем анионы S 2– , I – , Br – , Cl – окисляются легко;
– если в растворе находятся анионы кислородсодержащих кислот 



– если анод растворим, то при электролизе он сам подвергается окислению, т. е. посылает электроны во внешнюю цепь: при отдаче электронов смещается равновесие между электродом и раствором и анод растворяется.
Если из всего ряда электродных процессов выделить только те, которые отвечают общему уравнению
то получим ряд напряжений металлов. В этот ряд всегда помещают также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот, а какие нет (табл.).
Ряд напряжений металлов
| Уравнение электродного процесса | Стандартный электродный потенциал при 25 °С, В | Уравнение электродного процесса | Стандартный электродный потенциал при 25 °С, В |
|---|---|---|---|
| Li + + 1e = Li 0 | –3,045 | Co 2+ + 2e = Co 0 | –0,277 |
| Rb + + 1e = Rb 0 | –2,925 | Ni 2+ + 2e = Ni 0 | –0,250 |
| K + + 1e = K 0 | –2,925 | Sn 2+ + 2e = Sn 0 | –0,136 |
| Cs + + 1e = Cs 0 | –2,923 | Pb 2+ + 2e = Pb 0 | –0,126 |
| Ca 2+ + 2e = Ca 0 | –2,866 | Fe 3+ + 3e = Fe 0 | –0,036 |
| Na + + 1e = Na 0 | –2,714 | 2H + + 2e = H2 | 0 |
| Mg 2+ + 2e = Mg 0 | –2,363 | Bi 3+ + 3e = Bi 0 | 0,215 |
| Al 3+ + 3e = Al 0 | –1,662 | Cu 2+ + 2e = Cu 0 | 0,337 |
| Ti 2+ + 2e = Ti 0 | –1,628 | Cu + +1e = Cu 0 | 0,521 |
| Mn 2+ + 2e = Mn 0 | –1,180 | Hg2 2+ + 2e = 2Hg 0 | 0,788 |
| Cr 2+ + 2e = Cr 0 | –0,913 | Ag + + 1e = Ag 0 | 0,799 |
| Zn 2+ + 2e = Zn 0 | –0,763 | Hg 2+ + 2e = Hg 0 | 0,854 |
| Cr 3+ + 3e = Cr 0 | –0,744 | Pt 2+ + 2e = Pt 0 | 1,2 |
| Fe 2+ + 2e = Fe 0 | –0,440 | Au 3+ + 3e = Au 0 | 1,498 |
| Cd 2+ + 2e = Cd 0 | –0,403 | Au + + 1e = Au 0 | 1,691 |
В более простом виде ряд напряжений металлов можно представить так:
Для решения большинства задач на электролиз требуется знание закона Фарадея, формульное выражение которого приведено ниже:
где m – масса выделившегося на электроде вещества, F – число Фарадея, равное 96 485 А•с/моль, или 26,8 А•ч/моль , М – молярная масса элемента, восстанавливающегося в процессе электролиза, t – время проведения процесса электролиза (в секундах), I – сила тока (в амперах), z – число электронов, участвующих в процессе.
1. Какая масса никеля выделится в процессе электролиза раствора нитрата никеля в течение 1 ч при силе тока 20 А?
2. При какой силе тока необходимо проводить процесс электролиза раствора нитрата серебра, чтобы в течение 10 ч получить 0,005 кг чистого металла?
3. Какая масса меди выделится при электролизе расплава хлорида меди(II) в течение 2 ч при силе тока 50 А?
4. В течение какого времени нужно проводить процесс электролиза водного раствора сульфата цинка при силе тока 120 А, чтобы при этом получить 3,5 г цинка?
5. Какая масса железа выделится в процессе электролиза раствора сульфата железа(III) при силе тока 200 А в течение 2 ч?
6. При какой силе тока необходимо проводить процесс электролиза раствора нитрата меди(II), чтобы в течение 15 ч получить 200 г чистого металла?
7. В течение какого времени необходимо проводить процесс электролиза расплава хлорида железа(II) при силе тока 30 А, чтобы при этом получить 20 г чистого железа?
8. При какой силе тока необходимо проводить процесс электролиза раствора нитрата ртути(II), чтобы в течение 1,5 ч получить 0,5 кг чистого металла?
9. При какой силе тока необходимо проводить процесс электролиза расплава хлорида натрия, чтобы в течение 1,5 ч получить 100 г чистого металла?
10. Расплав хлорида калия подвергли электролизу в течение 2 ч при силе тока 5 А. Полученный металл прореагировал с водой массой 2 кг. Какой концентрации раствор щелочи получился при этом?
11. Сколько граммов 30%-го раствора соляной кислоты потребуется для полного взаимодействия с железом, полученным при электролизе раствора сульфата железа(III) в течение 0,5 ч при силе тока
10 А?
12. В процессе электролиза расплава хлорида алюминия, проводимого в течение 245 мин при силе тока 15 А, получили чистый алюминий. Сколько граммов железа можно получить алюминотермическим методом при взаимодействии данной массы алюминия с оксидом железа(III)?
13. Сколько миллилитров 12%-го раствора КОН плотностью 1,111 г/мл потребуется для взаимодействия с алюминием (с образованием тетрагидроксиалюмината калия), полученным электролизом раствора сульфата алюминия в течение 300 мин при силе тока 25 А?
14. Сколько миллилитров 20%-го раствора серной кислоты плотностью 1,139 г/мл потребуется для взаимодействия с цинком, полученным электролизом раствора сульфата цинка в течение 100 мин при силе тока 55 А?
15. Какой объем оксида азота(IV) (н.у.) получится при взаимодействии избытка горячей концентрированной азотной кислоты с хромом, полученным электролизом раствора сульфата хрома(III) в течение 100 мин при силе тока 75 А?
16. Какой объем оксида азота(II) (н.у.) получится при взаимодействии избытка раствора азотной кислоты с медью, полученной электролизом расплава хлорида меди(II) в течение 50 мин при силе тока 10,5 А?
17. В течение какого времени необходимо проводить электролиз расплава хлорида железа(II) при силе тока 30 А, чтобы получить железо, необходимое для полного взаимодействия со 100 г 30%-го раствора соляной кислоты?
18. В течение какого времени необходимо проводить электролиз раствора нитрата никеля при силе тока 15 А, чтобы получить никель, необходимый для полного взаимодействия с 200 г 35%-го раствора серной кислоты при нагревании?
19. Расплав хлорида натрия подвергли электролизу при силе тока 20 А в течение 30 мин, а расплав хлорида калия подвергли электролизу в течение 80 мин при силе тока 18 А. Оба металла растворили в 1 кг воды. Найдите концентрацию щелочей в полученном растворе.
20. Магний, полученный электролизом расплава хлорида магния в течение 200 мин при силе тока
10 А, растворили в 1,5 л 25%-го раствора серной кислоты плотностью 1,178 г/мл. Найдите концентрацию сульфата магния в полученном растворе.
21. Цинк, полученный электролизом раствора сульфата цинка в течение 100 мин при силе тока
17 А, растворили в 1 л 10%-го раствора серной кислоты плотностью 1,066 г/мл. Найдите концентрацию сульфата цинка в полученном растворе.
22. Железо, полученное электролизом расплава хлорида железа(III) в течение 70 мин при силе тока 11 А, превратили в порошок и погрузили в 300 г 18%-го раствора сульфата меди(II). Найдите массу меди, выпавшей в осадок.
23. Магний, полученный электролизом расплава хлорида магния в течение 90 мин при силе тока
17 А, погрузили в раствор соляной кислоты, взятый в избытке. Найдите объем и количество выделившегося водорода (н.у.).
24. Раствор сульфата алюминия подвергли электролизу в течение 1 ч при силе тока 20 А. Сколько граммов 15%-го раствора соляной кислоты потребуется для полного взаимодействия с полученным алюминием?
25. Сколько литров кислорода и воздуха (н.у.) потребуется для полного сжигания магния, полученного электролизом расплава хлорида магния в течение 35 мин при силе тока 22 А?
Ответы и решения см. в следующих номерах
🎬 Видео
Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз | ХИМИЯ ЕГЭ | Лия МенделееваСкачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз растворов. 3 часть. 10 класс.Скачать
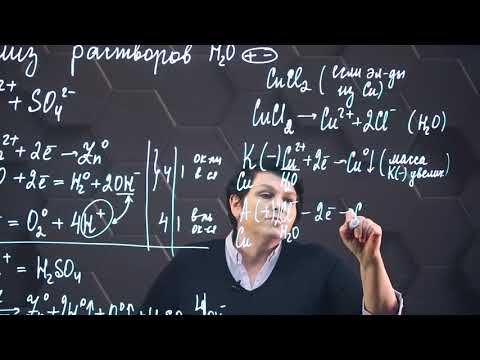
Получение ХРОМА Cr. Реакция ЛИТИЯ и ОКСИДА ХРОМА 3. Опыты по химии. Эксперименты дома. Li + Cr2O3Скачать

Электролиз - варианты задания 20Скачать

Электролиз. Часть 1. Процесс электролиза, основные закономерности.Скачать

ЗАДАЧА 34: все типы + самые вероятные задачи на ЕГЭ 2023 | ЕГЭ по химии 2023Скачать

Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]Скачать
![Электролиз растворов: получение кадмия, никеля, хлора, йода и других. [ChemistryToday]](https://i.ytimg.com/vi/CRgMweu9_nE/0.jpg)
Реакция ХЛОРИДА ХРОМА и ФОСФОРНОЙ КИСЛОТЫ. Reaction of CHROMIUM CHLORIDE and PHOSPHORIC ACID.ОпытыСкачать

11 класс. Хром. Часть 1.Скачать

Задача №34 на электролиз и протоны | ЕГЭ по химии 2024Скачать

Все опыты с хромом в одном видео | Химия ЕГЭСкачать

ch0705 Примеры решения задачСкачать

Решаем Тренировочный вариант №3 по химии от 11.10.2021 | ЕГЭ100БАЛЛОВ | ЕГЭ по химии 2022Скачать

КАК ХРОМИРОВАТЬ ПОВЕРХНОСТЬСкачать


























