- Электролиз раствора сульфата марганца MnSO4
- Электролиз раствора иодида натрия
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Правила составления уравнений электронно-ионного баланса электролиза расплавов и растворов электролитов
- 📺 Видео
Видео:При электролизе раствора йодида натрия, образуется смесь газов количеством 1/2 mol со среднейСкачать

Электролиз раствора сульфата марганца MnSO4
Задача 137.
Составить схемы электролиза раствора сульфата марганца, если электроды: а) угольные; б) марганцевые. Напишите электродные уравнения для процессов, протекающих на катоде и аноде.
Решение:
MnSO4 — соль менее активного металла и кислородсодержащей кислоты. Для Mn,металла со средней химической активностью, на катоде происходят одновременно две реакции – образование водорода и выделение металла.
1. Составляем уравнения реакций, протекающих при электролизе водного раствора сульфата марганца(II) с инертными электродами. На катоде восстанавливаются ионы марганца (II) (восстановлением воды можно пртнебречь), на аноде окисляются молекулы воды:
MnSO4 = Mn 2+ + SO4 2–
Mn 2+ + 2 
2H2O + 2 
2H2O — 4 
Mn 2+ + 2 


Таким образом, при электролизе водного раствора MnSO4 на катоде выделяется газообразный водород и металлический марганец, на аноде газообразный кислород. Продукты электролиза: марганец, водород, кислород и серная кислота.
2. Составляем уравнения реакций, протекающих при электролизе водного раствора сульфата марганца(II) с марганцевыми электродами.
При использовании марганцевого анода окислению подвергается материал анода — марганец, в результате чего анод будет растворяться.
Mn 2+ + 2 
2H2O + 2 
Mn 0 — 2 
Mn 2+ + 2Н2О + 2Mn 0 = Mn 0 + 2Mn 2+ + H2↑ + 2OH –
После приведения равенства, получим:
Электролиз раствора иодида натрия
Задача 1.
Найти массу продуктов электролиза раствора иодида натрия, взятого массой 1 кг и содержащего 10% примесей. Выход по току считать равным 90 %. Уравнения электролиза раствора иодида натрия написать подробно с обоснованием катодного и анодного процессов.
Решение:
M(NaI) = 149,89 г/моль;
V(I2) = 253,8089 г/моль;
M(H2) = 2,01588 г/моль.
1. Электродные процессы электролиза
Стандартный электродный потенциал системы Na + + 1 
(-) К: 2Н2О + 2 
На анодух будет происходить окисление хлрид-ионов с выделением газообразного хлора, так как стандартные электродные потенциалы систем:
2I – -2е = I2 0 ; 2H2O -4е = O2^ = 4H + соответственно равны + 0,536 В; 1,23 В:
(+) А: 2I – -2 
(-) К: 2Н2О + 2 
(+) А: 2I – -2 
2Н2О + 2NaI = Н2↑ + 2NaОН (у катода) + I2 (у анода).
Таким образом, при электролизе NaI на катоде будет происходить электрохимическое восстановление воды с выделением газообразного водорода, а ионы ОН – и N + будут образовывать щелочную среду: Na + + ОН – = КОН — растворимое основание. В анодом пространстве будет накапливаться свободный I2.
2. Расчет массы продуктов электролиза
Уравнение реакции имеет вид:
Из уравнения вытекает: n(NaI) = 0,5n(H2) = 09,5n(I2)
n(NaI) = m(NaI)/M(NaI) = 900/149,89 = 6 моль.
n(H2) = n(I2) = n(NaI)/2 = 6/2 = 3 моль.
m(H2) = n(H2) . M(H2) = 3 . 2,01588 = 6,05 г.
m(I2) = n(I2) . M(I2) = 3 . 253,8089 = 761,43 г.
Ответ: m(H2) = 6,05 г; m(I2) = 761,43 г.
Видео:Опыты по химии. Электролиз раствора йодида калияСкачать

Please wait.
Видео:Электролиз раствора соли иодида натрия NaI | Схема электролизаСкачать

We are checking your browser. gomolog.ru
Видео:Электролиз раствора иодида калия / Electrolysis of potassium iodide solutionСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ЭЛЕКТРОЛИЗ РАСТВОРА ЙОДИДА КАЛИЯСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e20d903ab858766 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Электролиз раствора иодида калияСкачать

Правила составления уравнений электронно-ионного баланса электролиза расплавов и растворов электролитов
Правила составления уравнений электронно-ионного баланса
электролиза расплавов и растворов электролитов.
I. Электролиз Р А С П Л А В О В.
На катоде НЕЗАВИСИМО от места расположения
металла в ряду активностей металлов ( в ряду напряжений )
ВСЕГДА восстанавливаются катионы металла:
n — заряд иона металла
На аноде рассматривают процессы окисления анионов
( ионов кислотных остатков ) и гидроксид ионов ( ОН — ).
( F -, Cl — , Br — , I — , S 2- ),
то происходит его
окисление до простого
(где Г-галоген: F, Cl, Br, I )
SO4 2- или СO3 2- ),
до молекул кислорода.
При этом образуется
стабильный в условиях
2 CO3e Þ 2 CO2 + O2
Гидроксид ионы ( ОН — ),
кислорода и воды:
4 ОН — — 4 е Þ O2 + 2 H2O
Если электролизу подвергается расплав оксида металла,
на аноде образуется кислород:
Оксид алюминия сначала диссоциирует в расплаве:
Al2O3 Þ Al 3+ + AlO3 3-
на аноде: 2 AlO3e Þ Al2O3 + 1,5 O2
II. Электролиз Р А С Т В О Р О В.
На катоде рассматривают процессы восстановления катионов металлов, ионов водорода и молекул воды. Для определения катодного процесса необходимо знать активность металла в водном растворе. Эту активность определяют по ряду активностей металлов в водных растворах ( ряд напряжений металлов ):
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Металл стоит в ряду
Металл стоит в ряду
МЕЖДУ алюминием и водородом.
Металл стоит в ряду
На катоде металл не
водород из воды:
2 H2O + 2 e Þ H2 + 2 OH —
На катоде происходят
восстановление металла и
n — заряд иона металла
2 H2O + 2 e Þ H2 + 2 OH —
происходит только процесс восстановления
n — заряд иона металла
На аноде рассматривают процессы окисления анионов
( ионов кислотных остатков ), гидроксид ионов ( ОН — ) и молекул воды.
Если анод из активного
металла (Сu, Ni, Fe),
то происходит только
( Cl — , Br — , I — , S 2- ),
то происходит его
окисление до простого
(где Г-галоген: Cl, Br, J )
( SO3 2- , SO4 2-, NO3 — ,
СO3 2- , PO4 3-, SiO3 2- и
кислорода из воды
до молекул кислорода:
2 H2O — 4 e Þ O2 + 4 H +
Если электролизу подвергается раствор щёлочи, то окислению подвергаются
атомы кислорода до молекул кислорода:
4 ОН — — 4 е Þ O2 + 2 H2O
Примеры составления уравнений электролиза.
I. Электролиз Р А С П Л А В О В.
Пример 1. Электролиз расплава хлорида меди (II).

 |  |
Катод ( ¾ ) : Cu 2+ + 2 e Þ Cu • 1
Катионы металла ( Cu 2+ )
при электролизе расплава
на катоде всегда
до простого вещества:
Анод ( + ) : 2 Cl — — 2 e Þ Cl2 • 1
кислоты ( Cl — ) при электролизе
расплава на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:
Cu 2+ + 2 Сl — Þ Cu + Cl2
Над знаком Þ запишите
слово электролиз и знак
Cуммарное молекулярное уравнение
CuСl2 Þ Cu + Cl2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Пример 2. Электролиз расплава сульфата калия.

 |  |
Катод ( ¾ ) : K+ + e Þ K • 2
Катионы металла ( K+ )
при электролизе расплава
на катоде всегда
до простого вещества:
Анод ( + ) : SO4e Þ SO2 + O2 • 1
кислоты ( SO4 2-) при электролизе
расплава на аноде всегда окисляются до кислорода и оксида неметалла:
Cуммарное ионное уравнение электродных реакций:

2 K+ + SO4 2- Þ 2 K + SO2 + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Cуммарное молекулярное уравнение

K2SO4 Þ 2 K + SO2 + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Пример 3. Электролиз расплава гидроксида натрия.

 |  |
Катод ( ¾ ) : Na+ + e Þ Na • 4
Катионы металла ( Na + )
при электролизе расплава
на катоде всегда
до простого вещества:
Анод ( + ) : 4 OH — — 4 e Þ 2 H2O + O2 • 1
Гидроксид ионы ( OH — )
при электролизе расплава
на аноде всегда окисляются до
кислорода и воды:
Cуммарное ионное уравнение

4 Na+ + 4 OH — Þ 4 Na + 2 H2O + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Cуммарное молекулярное уравнение

4 NaOH Þ 4 Na + 2 H2O + О2
на катоде на аноде
Над знаком Þ запишите
слово электролиз и знак
Электролиз растворов с инертными электродами.
Инертные электроды — электроды, которые при электролизе служат лишь передатчиками электронов. Материал таких электродов не участвует в электродных процессах (например: Pt, Ir, C (графит)).
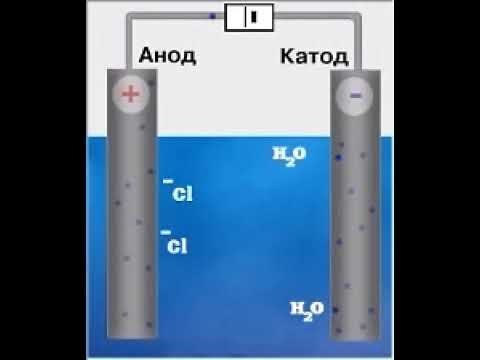
Пример 1. Электролиз раствора иодида натрия.

Ряд напряжений металлов:
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 1
Натрий — стоит в ряду напряжений
левее алюминия, поэтому,
натрий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
Анод ( + ) : 2 I — — 2 e Þ I2 • 1
кислоты ( J — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:

2 H2O + 2 I — Þ H2 + 2 OH — + I2
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение

2 NaI + 2 H2O Þ H2 + 2 NaOH + I2
на катоде на аноде
Над знаком Þ запишите
Пример 2. Электролиз раствора бромида железа (III).

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Fe 3+ + 3 e Þ Fe
2 H2O + 2 e Þ H2 + 2 OH-
Железо — стоит в ряду напряжений
между алюминием и водородом,
поэтому, при электролизе раствора
на катоде железо восстанавливается,
вместе с водородом из молекул воды:
Анод ( + ) : 2 Br — — 2 e Þ Br2
кислоты ( Br — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
На катоде происходят 2 реакции восстановления, поэтому, необходимо составить 2 суммарных уравнения электролиза. Для этого реакцию на аноде суммируют с каждой катодной реакцией.
Первая пара полуреакций:
Вторая пара полуреакций:


Катод (-): Fe 3+ + 3 e Þ Fe •2
Анод ( + ) : 2 Br — — 2 e Þ Br2 •3
Катод (-): 2 H2O + 2 e Þ H2 + 2 OH — •1
Анод ( + ): 2 Br — — 2 e Þ Br2 •1
Первое суммарное ионное
Второе суммарное ионное

2 Fe 3+ + 6 Br — Þ 2 Fe + 3 Br2
на катоде на аноде
Над знаком Þ запишите слово электролиз.
2 H2O + 2 Br — Þ H2 + 2 OH — + Br2
на катоде на аноде
Над знаком Þ запишите слово электролиз.
Cуммарное молекулярное уравнение
Cуммарное молекулярное уравнение

2 FeBr3 Þ 2 Fe + 3 Br2
на катоде на аноде
6 H2O+2 FeBr3 Þ 3 H2 +2 Fe(OH)3 ¯ + 3 Br2
на катоде на аноде
Пример 3. Электролиз раствора хлорида меди (II).

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Cu 2+ + 2 e Þ Cu • 1
Медь ( Cu )- стоит в ряду напряжений
поэтому, при электролизе раствора
на катоде восстанавливаются
только атомы меди:
Анод ( + ) : 2 Cl — — 2 e Þ Cl2 • 1
кислоты ( Cl — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:
Сu 2+ + 2 Cl — Þ Cu + Cl2
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение
СuCl2 Þ Cu + Cl2
на катоде на аноде
Над знаком Þ запишите
Пример 4. Электролиз раствора карбоната калия.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 2
Калий ( K ) — стоит в ряду напряжений
левее алюминия, поэтому,
калий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
из молекул воды:
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
кислоты ( CO3 2- ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
Cуммарное ионное уравнение электродных реакций:


4 H2O + 2 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
на катоде на аноде
6 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение электродных реакций:


6 H2O + 2 K2CO3 Þ 2 H2 + 4 KOH + O2 + 2 H2СО3
на катоде на аноде
6 H2O + 2 K2CO3 Þ 2 H2 + 4 KOH + O2 + 2 H2О + 2 CO2
электролиз на катоде на аноде
4 H2O + 2 K2CO3 Þ 2 H2 + 4 KOH + O2 + 2 CO2
на катоде на аноде
Над знаком Þ запишите
Пример 5. Электролиз раствора сульфата цинка.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Zn 2+ + 2 e Þ Zn
2 H2O + 2 e Þ H2 + 2 OH-
Цинк ( Zn )- стоит в ряду напряжений
между алюминием и водородом,
поэтому, при электролизе раствора
на катоде железо восстанавливается,
вместе с водородом из молекул воды:
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+
кислоты ( SO4 2- ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
На катоде происходят 2 реакции восстановления, поэтому, необходимо составить 2 суммарных уравнения электролиза. Для этого реакцию на аноде суммируют с каждой катодной реакцией.
Первая пара полуреакций:
Вторая пара полуреакций:


Катод (-): Zn 2+ + 2 e Þ Zn • 2
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
Катод (-): 2 H2O + 2 e Þ H2 + 2 OH — • 2
Анод ( + ): 2 H2O — 4 e Þ O2 + 4 H+ • 1
Первое суммарное ионное
Второе суммарное ионное
2 Zn 2+ + 2 H2O Þ 2 Zn + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите слово электролиз.
4 H2O + 2 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
6 H2O Þ 2 H2 + 4 OH — + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите слово электролиз.
Cуммарное молекулярное уравнение
Cуммарное молекулярное уравнение
2 ZnSO4 + 2 H2O Þ 2 Zn + O2 + 2 H2SO4
на катоде на аноде
6 H2O + 4 ZnSO4 Þ 2 H2 + 2 Zn(OH)2 + O2+ 2 H2SO4
на катоде на аноде
Пример 6. Электролиз раствора нитрата серебра.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au
Катод ( ¾ ) : Ag+ + e Þ Ag • 4
Серебро ( Ag )- стоит в ряду
напряжений правее водорода,
поэтому, при электролизе раствора
на катоде восстанавливаются
только атомы меди:
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
кислоты ( NO3 — ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
Cуммарное ионное уравнение электродных реакций:

4 Ag + + 2 H2O Þ 4 Ag + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение

4 AgNO3 + 2 H2O Þ 4 Ag + O2 + 4 HNO3
на катоде на аноде
Над знаком Þ запишите
Пример 7. Электролиз раствора соляной кислоты.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H + + 2 e Þ H2 • 1
Ионы водорода ( H+ )
при электролизе раствора
на катоде восстанавливаются
до молекул водорода
Анод ( + ) : 2 Cl — — 2 e Þ Cl2 • 1
кислоты ( Cl — ) при электролизе
раствора на аноде всегда окисляются
до простого вещества:
Cуммарное ионное уравнение электродных реакций:
2 H + + 2 Cl — Þ H2 + Cl2
на катоде на аноде
Над знаком Þ запишите
Cуммарное молекулярное уравнение
2 HCl Þ H2 + Cl2
на катоде на аноде
Над знаком Þ запишите
Пример 8. Электролиз раствора серной кислоты.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H + + 2 e Þ H2 • 2
Ионы водорода ( H+ )
при электролизе раствора
на катоде восстанавливаются
до молекул водорода
Анод ( + ) : 2 H2O — 4 e Þ O2 + 4 H+ • 1
кислоты ( SO4 2- ) при электролизе
раствора на аноде не окисляются,
а окисляются атомы кислорода
из молекул воды:
Cуммарное ионное уравнение электродных реакций:
4 H + + 2 H2O Þ 2 H2 + O2 + 4 H+
на катоде на аноде
Над знаком Þ запишите
В этом уравнении в левой и правой частях есть одинаковых частицы
( H + ), поэтому, в левой и правой
частях уравнения сократите эти
Cуммарное молекулярное уравнение

2 H2SO4 + 2 H2O Þ 2 H2 + O2 + 2 H2SO4
на катоде на аноде
2 H2O Þ 2 H2 + O2
на катоде на аноде
Над знаком Þ запишите
Пример 9. Электролиз раствора гидроксида калия.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 2
Калий ( K )- стоит в ряду напряжений
левее алюминия, поэтому,
калий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
из молекул воды:
Анод ( + ) : 4 OH — — 4 e Þ 2 H2O + O2 • 1
Гидроксид ионы ( OH — )
при электролизе раствора
на аноде всегда окисляются до
кислорода и воды:
Cуммарное ионное уравнение электродных реакций:


4 H2O + 4 OH — Þ 2 H2 + 4 OH — + 2 H2O + O2
cокращаем на 2 молекулы воды
Над знаком Þ запишите
В этом уравнении в левой и правой частях есть одинаковых частицы
( OH — и H2O ), поэтому, в левой и правой частях уравнения
сократите эти частицы.
Cуммарное молекулярное уравнение
После сокращения имеем:
2 H2O Þ 2 H2 + O2
на катоде на аноде
Над знаком Þ запишите
Материал для дополнительного изучения.
II. Электролиз Р А С Т В О Р О В
C использованием растворимого анода.
При электролизе раствора электролита ( соли, щёлочи или кислоты ) с растворимым анодом ( например медным ( Cu ), никелевым ( Ni ), железным ( Fe ) ) не происходят процессы окисления анионов кислотного остатка, гидроксид-ионов (ОН — ) и молекул воды, а происходит разрушение анода ( окисление ) по реакции: _
n — заряд иона металла
Если анод из меди ( Сu ):
Если анод из меди ( Ni ):
Если анод из меди ( Fe ):
Пример 1. Электролиз раствора иодида натрия на медных электродах.

Ряд напряжений металлов.
Li Rb K Ba Sr Ca Na Mg Al
Mn Zn Cr Fe Cd Co Ni Sn Pb
H2 Sb Bi Cu Hg Ag Pd Pt Au


Катод ( ¾ ) : 2 H2O + 2 e Þ H2 + 2 OH — • 1
Натрий (Na )- стоит в ряду напряжений
левее алюминия, поэтому,
натрий при электролизе раствора
на катоде не восстанавливается,
а восстанавливается водород
из молекул воды:
Анод ( + ) : Cu — 2 e Þ Cu 2+ • 1
Независимо от того, каким анионом
всегда окисляется растворимый анод.
Cуммарное ионное уравнение электродных реакций:
2 H2O + Cu Þ H2 + 2 OH — + Cu 2+
на катоде на аноде
Над знаком Þ запишите

2 H2O + Cu + 2 NaJ Þ H2 + 2 NaOH + CuJ2
на катоде на аноде
Над знаком Þ запишите
Задания для самостоятельного решения.
Задание 1: Составьте уравнения электронного баланса процессов протекающих на электродах при электролизе расплавов. Напишите уравнения реакций электролиза.
1) хлорид кальция
2) бромид натрия
3) сульфат калия
4) карбонат натрия
5) гидроксид калия
6) хлорид железа (III)
7) сульфат натрия
8) карбонат калия
9) гидроксид натрия
Задание 2: Составьте уравнения электронного баланса процессов протекающих на электродах при электролизе растворов. Напишите уравнения реакций электролиза.
📺 Видео
Электролиз раствора иодида калияСкачать

При проведении электролиза 0,1 kg 45 -го раствора йодида натрия, определенная часть солиСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Электролиз раствора KIСкачать

Неорганическая химия. Химия и электрический ток. Опыты по химииСкачать

Электролиз раствора иодида калия и добавления раствора фенолфталеина и крахмального клейстераСкачать

Опыты по химии. Взаимодействие хлора с растворами бромида и йодида натрияСкачать

Электролиз иодида калияСкачать

Опыты по химии. Электролиз раствора сульфата натрияСкачать

Электролиз растворов солей в ЕГЭ за 8 минутСкачать

электролиз хлорида натрияСкачать
уравнения электролизаСкачать

101 Электролиз раствора йодида калияСкачать

электролиз раствора сульфата натрияСкачать






















