Кислоты — это электролиты, которые при диссоциации образуют только один вид катионов — катионы водорода Н + . Составим уравнение электролитической диссоциации сильных кислот: а) одноосновной азотной кислоты HNО3 и б) двухосновной серной кислоты H2SO4:
Число ступеней диссоциации зависит от основности слабой кислоты Нх(Ас), где х — основность кислоты.
Пример: Составим уравнения электролитической диссоциации слабой двухосновной угольной кислоты Н2СО3.
Первая ступень диссоциации (отщепление одного иона водорода Н + ):
Константа диссоциации по первой ступени:
Вторая ступень диссоциации (отщепление иона водорода Н + от сложного иона НСО3 — ):
Растворы кислот имеют некоторые общие свойства, которые, согласно теории электролитической диссоциации, объясняются присутствием в их растворах гидратированных ионов водорода Н + (Н3О + ).
Основания — это электролиты, которые при диссоциации образуют только один вид анионов — гидроксид-ионы ОН — .
Составим уравнение электролитической диссоциации однокислотного основания гидроксида калия КОН:
Сильное двухкислотное основание Ca(OH)2 диссоциирует так:
Слабые многокислотные основания диссоциируют ступенчато. Число ступеней диссоциации определяется кислотностью слабого основания Ме(ОН)у, где у — кислотность основания.
Составим уравнения электролитической диссоциации слабого двухкислотного основания — гидроксида железа (II) Fe(OH)2.
Первая ступень диссоциации (отщепляется один гидроксид-ион ОН — ):
Вторая ступень диссоциации (отщепляется гидроксид-ион ОН — от сложного катиона FeOH + ):
Основания имеют некоторые общие свойства. Общие свойства оснований обусловлены присутствием гидроксид-ионов ОН — .
Каждая ступень диссоциации слабых многоосновных кислот и слабых многокислотных оснований характеризуется определенной константой диссоциации: K1, K2, K3, причем K1 > K2 > K3. Это объясняется тем, что энергия, которая необходима для отрыва иона Н + или ОН — от нейтральной молекулы кислоты или основания, минимальна. При диссоциации по следующей ступени энергия увеличивается, потому что отрыв ионов происходит от противоположно заряженных частиц.
Амфотерные гидроксиды могут реагировать и с кислотами, и с основаниями. Теория электролитической диссоциации объясняет двойственные свойства амфотерных гидроксидов.
Амфотерные гидроксиды — это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода Н + и гидроксид-анионы ОН — , т. е. диссоциируют по типу кислоты и по типу основания.
К амфотерным гидроксидам относятся Ве(ОН)2, Zn(OH)2, Sn(OH)2, Al(OH)3, Cr(OH)3 и другие. Амфотерным электролитом является также вода Н2O.
В амфотерных гидроксидах диссоциация по типу кислот и по типу оснований происходит потому, что прочность химических связей между атомами металла и кислорода (Ме—О) и между атомами кислорода и водорода (О—Н) почти одинаковая. Поэтому в водном растворе эти связи разрываются одновременно, и амфотерные гидроксиды при диссоциации образуют катионы Н + и анионы ОН — .
Составим уравнение электролитической диссоциации гидроксида цинка Zn(OH)2 без учета ее ступенчатого характера:
Нормальные соли — сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка.
Составим уравнения электролитической диссоциации нормальных солей: а) карбоната калия K2CO3, б) сульфата алюминия Al2(SO4)3:
Кислые соли — сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.
Составим уравнения электролитической диссоциации кислой соли гидрокарбоната натрия NaHCО3.
Сложный анион НСО3 — (гидрокарбонат-ион) частично диссоциирует по уравнению:
Основные соли — электролиты, которые при диссоциации образуют анионы кислотного остатка и сложные катионы состоящие из атомов металла и гидроксогрупп ОН — .
Составим уравнение электролитической диссоциации основной соли Fe(OH)2Cl — дигидроксохлорида железа (III):
Сложный катион частично диссоциирует по уравнениям:
Для обеих ступеней диссоциации Fe(OH)2 + .
- Уравнение электролитической диссоциации угольной кислоты по ступеням
- Напиши уравнение ступенчатой диссоциации угольной кислоты?
- При электролитической диссоциации соли образуется катионов в 3 раза больше, чем анионов?
- Диссоциация катионом металла и гидроксильных формируется анионами веществ , которые включают : 1 ) кислот 2 ) соль 3 ) основания?
- Написать 15 примеров солей, чтобы среди них было : 5 по катиону, 5 по аниону, 2 по катиону и аниону, 3 не подвергающиеся гидролизу?
- Составьте формулы гидроксида бария, нитрата алюминия, сероводородной кислоты, оксида кремния?
- Помогите, сколько сможете?
- Напишите пять формул солей различающихся по кислотному остатку (аниону) и назовите эти соли?
- Напишите уравнение ступенчатой диссоциации фосфорной кислоты, назовите все образовавшиеся ионы?
- Вещества диссоциации с образованием катионов металлов и анионов кислотной остатки?
- В чем разница гидролиза солей по катиону и аниону и нейтральному?
- 1. Вещество,при диссоциации которого образовались катионы натрия Na + и анионы хлора Cl — , являетсяA?
- 💥 Видео
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Уравнение электролитической диссоциации угольной кислоты по ступеням
1.1. Электролитическая диссоциация. Степень диссоциации. Сила электролитов
Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.
Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией. Вещества, диссоциирующие на ионы в растворах, называют электролитами. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы ( n ), к общему числу его молекул в растворе ( N ), или
α = 
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,03 (3%) до 0,3 (30%)—средними, менее 0,03 (3%)—слабыми электролитами. Так, для 0,1 M раствора CH 3 COOH α = 0,013 (или 1,3 %). Следовательно, уксусная кислота является слабым электролитом. Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы. Степень электролитической диссоциации электролита в водных растворах зависит от природы электролита, его концентрации и температуры.
По своей природе электролиты можно условно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью (α = 1).
К сильным электролитам относятся:
1) кислоты ( H 2 SO 4 , HCl , HNO 3 , HBr , HI , HClO 4 , H М nO 4 );
2) основания – гидроксиды металлов первой группы главной подгруппы (щелочи) – LiOH , NaOH , KOH , RbOH , CsOH , а также гидроксиды щелочноземельных металлов – Ba ( OH )2 , Ca ( OH )2, Sr ( OH )2;.
3) соли, растворимые в воде (см. таблицу растворимости).
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме). Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относятся:
1) неорганические кислоты ( H 2 CO 3 , H 2 S , HNO 2 , H 2 SO 3 , HCN , H 3 PO 4 , H 2 SiO 3 , HCNS , HСlO и др.);
3) гидроксид аммония ( NH 4 OH );
4) большинство органических кислот
(например, уксусная CH3COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов (см. таблицу растворимости).
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация соляной кислоты (НС l ) записывается следующим образом:
Основания диссоциируют с образованием катионов металла и гидроксид-ионов. Например, диссоциация КОН
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например,
H2CO3
HCO3 – 
Первое равновесие – диссоциация по первой ступени – характеризуется константой

Для диссоциации по второй ступени:

В случае угольной кислоты константы диссоциации имеют следующие значения: KI = 4,3 × 10 –7 , KII = 5,6 × 10 –11 . Для ступенчатой диссоциации всегда KI>KII>KIII> . , т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Средние (нормальные) соли, растворимые в воде, диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка
Кислые соли (гидросоли) – электролиты, содержащие в анионе водород, способный отщепляться в виде иона водорода Н + . Кислые соли рассматривают как продукт, получающийся из многоосновных кислот, в которых не все атомы водорода замещены на металл. Диссоциация кислых солей происходит по ступеням, например:
KHCO 3 → K + + HCO 3 – (первая ступень)
HCO 3 – 
Однако степень электролитической диссоциации по второй ступени очень мала, поэтому раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли (гидроксосоли) – электролиты, содержащие в катионе одну или несколько гидроксо-групп OH – . Основные соли характерны для многовалентных металлов. Основные соли диссоциируют с образованием основных и кислотных остатков. Например:
FeOHCl 2 
FeOH 2+ 
( ZnOH )2 SO 4 
ZnOH + 
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Напиши уравнение ступенчатой диссоциации угольной кислоты?
Химия | 5 — 9 классы
Напиши уравнение ступенчатой диссоциации угольной кислоты.
Назови катионы и анионы.
Составь формулы солей натрия и кальция с полученными анионами, назови их.
H2CO3 < ; — — > ; H( + ) + HCO3( — ) диссоциация по первой ступени ; HCO3( — ) < ; — — > ; H( + ) + CO3(2 — ) диссоциация по второй ступени ;
Суммарно : H2CO3 < ; — — > ; 2H( + ) + CO3(2 — ).
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

При электролитической диссоциации соли образуется катионов в 3 раза больше, чем анионов?
При электролитической диссоциации соли образуется катионов в 3 раза больше, чем анионов.
Название соли — 1) фосфат кальция 2) хлорид железа(III) 3) фосфат натрия 4) сульфат хрома(III).
Видео:Химия 9 класс (Урок№19 - Угольная кислота.)Скачать

Диссоциация катионом металла и гидроксильных формируется анионами веществ , которые включают : 1 ) кислот 2 ) соль 3 ) основания?
Диссоциация катионом металла и гидроксильных формируется анионами веществ , которые включают : 1 ) кислот 2 ) соль 3 ) основания?
Видео:Диссоциация кислот.Скачать

Написать 15 примеров солей, чтобы среди них было : 5 по катиону, 5 по аниону, 2 по катиону и аниону, 3 не подвергающиеся гидролизу?
Написать 15 примеров солей, чтобы среди них было : 5 по катиону, 5 по аниону, 2 по катиону и аниону, 3 не подвергающиеся гидролизу.
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Составьте формулы гидроксида бария, нитрата алюминия, сероводородной кислоты, оксида кремния?
Составьте формулы гидроксида бария, нитрата алюминия, сероводородной кислоты, оксида кремния.
Напишите уравнение диссоциации для формул сильных электролитов.
Подчеркните одной чертой катионы и двумя анионы.
Видео:Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Помогите, сколько сможете?
Помогите, сколько сможете.
Только посторайтесь сами, пожалуйста.
Кислоты – это соединения, которые при диссоциации в воде образуют из катионов только ионы …
Основания — это соединения, которые при диссоциации в воде образуют из анионов только ионы …
Амфотерные гидроксиды – это слабые электролиты, которые при диссоциации в воде образуют одновременно катионы … и анионы … , т.
Е. диссоциируют как … и
Средние соли — это соединения, которые при диссоциации в воде образуют катионы водорода и анионы кислотного остатка.
Видео:Механизм электролитической диссоциации. 9 класс.Скачать

Напишите пять формул солей различающихся по кислотному остатку (аниону) и назовите эти соли?
Напишите пять формул солей различающихся по кислотному остатку (аниону) и назовите эти соли.
Видео:Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать
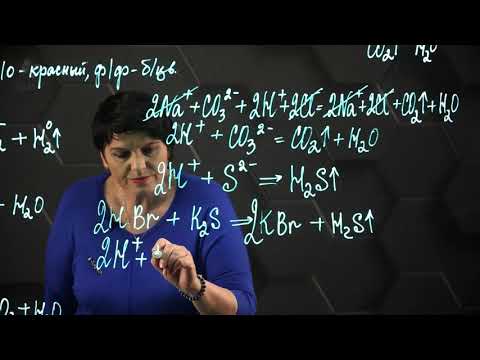
Напишите уравнение ступенчатой диссоциации фосфорной кислоты, назовите все образовавшиеся ионы?
Напишите уравнение ступенчатой диссоциации фосфорной кислоты, назовите все образовавшиеся ионы.
Видео:Электролитическая диссоциация / Диссоциация кислотСкачать

Вещества диссоциации с образованием катионов металлов и анионов кислотной остатки?
Вещества диссоциации с образованием катионов металлов и анионов кислотной остатки.
Видео:9 класс. Химия. Электролитическая диссоциацияСкачать

В чем разница гидролиза солей по катиону и аниону и нейтральному?
В чем разница гидролиза солей по катиону и аниону и нейтральному?
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

1. Вещество,при диссоциации которого образовались катионы натрия Na + и анионы хлора Cl — , являетсяA?
при диссоциации которого образовались катионы натрия Na + и анионы хлора Cl — , являетсяA.
E. двойной солью.
Вы перешли к вопросу Напиши уравнение ступенчатой диссоциации угольной кислоты?. Он относится к категории Химия, для 5 — 9 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей.
Физические : превращение воды в лёд — важно, например, для обитателей водоемов, превращение в пар — круговорот воды в природе. Плавление металлов — изготовление посуды, ювелирных изделий, в конце концов оловянных солдатиков. Химические : гашение из..
2NaNO3 + CuSO4 — Cu(NO3)2 + Na2SO4 (но на практике эта реакция неосуществима, так как не будет осадка) 2NaNO3 + CuCl2 — реакция невозможна.
Ню = м / М = 108, 5 / 217(эт М) = 0, 5ню = v / vm, следовательно V = ню * вм = 0, 5 * 22, 4 = 11, 2.
Оксиген, азот и натрий ковалентный неполярный, все остальные полярные.
Ионная ионная металлическая ковалентная полярная ковалентная полярная ковалентная не полярная ковалентная не полярная.
1) 2Al + 6HCl — > 2AlCl3 + 3H2 / AlCl3 — соль 2) 2Li + 2HOH — > 2LiOH + H2 / LiOH — основание 2LiOH — > Li2O + H2O / Li2O — оксид ме (гидроксид лития особенный и способен к раздражению).
Я невпевнений але Ba(oh)2 + H2So4 = baso4 + h2o.
X1 = C2H2 X2 = C2Na2 X3 = CH3COOH.
Реакции есть на фотографии.
M(CO) = 50 * 56 / 100 = 28г M(CO) = 28г / моль nCO) = 28 / 28 = 1моль CuO + CO = Cu + CO2 nCuO : nCO = 1 : 1 n(CuO) = 1моль количество вещества оксида меди равно = 1моль.
💥 Видео
Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

Электролитическая диссоциацияСкачать

Электролитическая диссоциация.Скачать

Неметаллы. Тема 25. Угольная кислота и ее соли. Видеоопыт «Взаимодействие карбонатов с кислотамиСкачать

Химия. 9 класс. Химические свойства кислот с точки зрения теории электролитической диссоциацииСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Угольная кислота. Соли угольной кислоты. Карбонаты. Гидрокарбонаты. Получение и свойстваСкачать

























