Вопрос по химии:
Напишите плис уравнение диссоциации карбоната кальция
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 2
Не диссоциирует, т. к. выпадает в осадок. Но, например:
CaCl2+K2CO3=CaCO3(выпадает в осадок)+2KCl
Ca(заряд иона 2+)+2Cl(заряд иона -)+2K(заряд иона+)+CO3(заряд иона 2-)=CaCO3+2K(заряд иона +)+2Cl(заряд иона -)
Ca(заряд иона 2+)+CO3(заряд иона 2-)=CaCO3
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Реакции ионного обмена
Этот видеоурок доступен по абонементу
У вас уже есть абонемент? Войти
Урок посвящен изучению темы «Реакции ионного обмена». На нём вы рассмотрите сущность реакций, протекающих между растворами кислот, солей и щелочей. Для этого будут записаны уравнение реакции между двумя веществами. На уроке будет дано определение новому понятию реакции ионного обмена.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Термического разложения карбонатного сырья
Технологические параметры обжига карбонатного сырья определяются на основании термодинамики и кинетики диссоциации СaСО3, т. е. реакции, лежащей в основе процесса.
2.3.1. Термодинамика диссоциации СаСО3.
Процесс диссоциации карбоната кальция протекает с поглощением теплоты:
Изменение энтальпии системы DH или теплового эффекта реакции при постоянном давлении Qр в зависимости от температуры, согласно закону Кирхгофа, соответствует уравнению
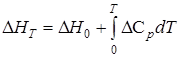
где DСр — разность теплоемкостей конечных и начальных продуктов реакции.
Изменение энтальпии системы DH, ккал/моль, при температуре T будет следующим:
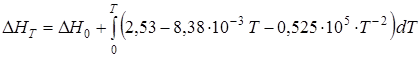
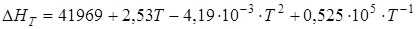
DН1173 = –39,216 (-163,9 кДж) при t = 900°С, DН1473 = –36,67
(-153,5 кДж) при t = 1200°С. В среднем тепловой эффект в зоне обжига, лежащей в диапазоне 900-1200°С, принимается равным -37,94 ккал (- 158,7кДж).
Согласно правилу фаз, в системе СаСО3 ® СаО + СО2 при трех фазах и двух компонентах в состоянии равновесия имеется только одна степень свободы.
В качестве независимого параметра обычно принимают температуру. Тогда, учитывая, что общее давление совпадает с давлением СО2, получаем:

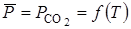
Ввиду того, что диссоциация СаСО3 является процессом эндотермическим, повышение температуры в соответствии с принципом Ле-Шателье сдвигает равновесие реакции вправо, в сторону увеличения 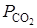
Вид функциональной зависимости 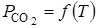
Константа равновесия равна
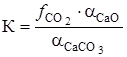
где 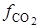
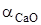
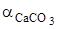
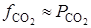
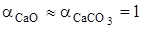
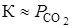
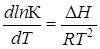
получим искомую функцию:
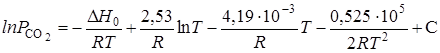
где С — константа интегрирования.
Зависимость 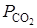
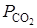
| Парциальное давление СО2, 10 5 Па | 13,0 10,4 7,8 5,2 2,6 |
 | |
| 900 1100 1300 Температура, °С |
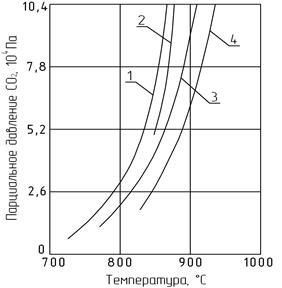
Рис. 2.3. Зависимость парциального давления СО2 от температуры
Энергия Гельмгольца (изохорно-изотермический потенциал, «свободная энергия») твердых тел представляет собой сумму «объемной свободной энергии» 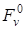
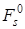
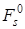
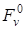
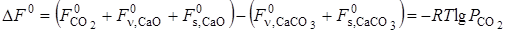
Из этого уравнения следует, что несмотря на постоянство температуры, величина 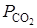
Поскольку образование новых фаз в объеме всегда проходит через стадии зарождения и первоначального роста частиц, в начальный период разложения СаСО3 в системе присутствует высокодисперсный СаО. Обладая повышенной «свободной энергией», мелкие кристаллы СаО будут стремиться к рекристаллизации (образованию крупных кристаллов за счет срастания мелких), в результате чего запас «свободной энергии» уменьшится.
Если полученный СаО крупнокристаллический, то величиной 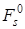
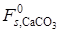
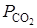
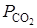
Таким образом, в зависимости от соотношения размеров кристаллов СаО и СаСО3 может получиться не одна функциональная зависимость 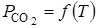
Рис. 2.4. Зависимость парциального давления СО2 над различными
по размерам кристаллами исландского шпата от температуры:
1 — 20-50 мкм; 2 — 80-140 мкм; 3 — 135-300 мкм;
4 — призма с основанием 2´5 мм, высотой 20 мм
Аналогичные данные о влиянии степени дисперсности были получены для некоторых природных карбонатов кальция, из которых следует, что температура их разложения лежит в пределах 892-921°С. Мела разлагаются при 892-895°С, известняки около 900°С, природный кальцит при 911°С, а мрамор при 921°С. Для синтетических карбонатов кальция, в том числе химически осажденных, разница в температурах диссоциации также соблюдается. Так, тонкодисперсные образцы СаСО3 разлагаются в интервале 882-895°С, а крупнокристаллические при более высокой температуре – 911-921°С.
Примеси, присутствующие в природном карбонатном сырье в том или ином количестве, оказывают влияние на величину 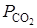
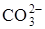
При протекании топохических процессов помимо распада аниона весьма существенную роль играет стадия разрушения кристаллической решетки.
Согласно кинетической теории процесса зарождения новой фазы, в любой системе, находящейся в состоянии теплового равновесия, в различных ее точках происходят отклонения различных параметров от наиболее вероятных значений.
Начиная с некоторой величины, называемой критической, отклонения становятся устойчивыми и не исчезают со временем, а продолжают расти, в результате чего образуются центры кристаллизации новой фазы.
Наиболее благоприятные условия для распада создаются там, где имеются наибольшие искажения решетки и связь между частицами сильно ослаблена, а запас свободной энергии достаточно высок. Такие места являются активными центрами, где начинается и осуществляется распад анионов.
По мере развития процесса распада 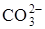
Десорбция СО2 происходит относительно легко и быстро. Большая концентрация О 2 — в поверхностном слое активных участков приводит к возникновению кристаллических зародышей. Такая фаза будет тонкодисперсной, а следовательно, она будет обладать большим запасом свободной энергии. Последнее обстоятельство делает ее метастабильной.
Чем меньше число дефектных мест у исходных кристаллов СaСО3, тем меньше число возникающих зародышей новой фазы. Следовательно, чем крупнее кристаллы у исходного СаСО3 и чем правильнее они огранены, тем медленнее совершается переход активных центров исходной фазы в крупнокристаллические зародыши СаО. Температура начала заметного разложения такого известняка на 6-7°С выше.
С момента образования кристаллических зародышей процесс развивается на границе раздела фаз СаО-СаСО3. Образующийся оксид кальция оказывает деформирующее действие на анион 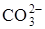
Размер конечных кристаллов СаО будет зависеть от количества образующихся зародышей в единицу времени. Если это число велико, то для роста кристаллов, как правило, не хватает «строительного материала», и поэтому кристаллы СаО будут маленькими, и наоборот.
Кроме того, помимо вышеуказанного факта на конечный размер кристаллов влияет соотношение скоростей образования зародышей и роста кристаллов. Если скорость роста кристаллов выше скорости зарождения зародышей, то продукт будет крупнокристаллическим, в противном случае картина будет обратной.
Однако наиболее действенным параметром, влияющим на размер кристаллов СаО, является температура. Так, при температуре 800°С и выдержке 10 ч размеры кристаллов составляют 0,3 мкм, при 900°С и той же выдержке они увеличиваются до 0,5-0,7 мкм, а после 10 ч прокаливания — до 6-13 мкм.
В зависимости от плотности карбонатного сырья скорость термической диссоциации будет разной (рис. 2.5).
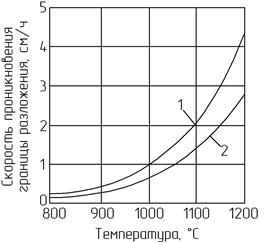
Рис. 2.5. Зависимость средней скорости проникновения
границы разложения для мела (1) и известняка (2) от температуры
Из рисунка видно, что фронт декарбонизации у меловых гранул продвигается быстрее по сравнению с известняком.
По достижении температуры диссоциации и в ходе последующей прокалки образующиеся кристаллы СаО подвергаются спеканию, сопровождающемуся повышением предела прочности при сжатии. Так, если при 100-110°С комовый мел имеет прочность в пределах 340-650 Н/см 2 , то при 700°С эта величина достигает значения 1500 Н/см 2 .
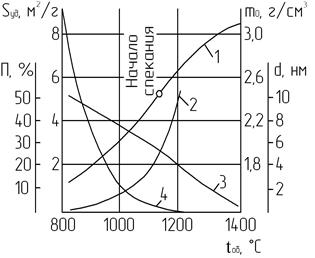
Механизм процесса спекания заключается в следующем. Малые кристаллические зерна СаО под влиянием сил молекулярного сцепления срастаются друг с другом в компактное кристаллическое тело. Образовавшееся таким образом тело еще сохраняет поликристаллическую структуру. Дальнейшее прокаливание (при более высокой температуре) вызывает рекристаллизацию — рост кристаллов. При спекании, наряду с образованием поликристаллических зерен, идет процесс «заживления» кристаллов, имеющих искажения в первичной структуре кристаллической решетки. С повышением температуры «дефектные», «несовершенные», неравновесные кристаллы превращаются в нормальные. Процесс «заживления» кристаллов сопровождается понижением активности вещества. Наличие дефектов в кристаллической решетке выявляется по пониженной плотности, повышенным теплотам гидратации, снижению резкости рефлексов на рентгенограмме и другим свойствам (рис. 2.6).
Рис. 2.6. Зависимость свойств извести от температуры обжига:
1 – объемная масса m0; 2 – размер кристаллов d;
3 – пористость П; 4 – удельная поверхность Sуд
Ход кривых на данном рисунке наглядно свидетельствует о наличии существенной зависимости свойств извести от процессов спекания. Следует отметить, бездефектный монокристалл СаО, выращенный из расплава в воде, может вообще не подвергнуться гидратации.
В заключение следует отметить, что все вышеуказанное относится к процессу термического разложения СаСО3, т. е. не содержащего примесей. Но поскольку природное карбонатное сырье всегда содержит то или иное количество порой самых разнообразных примесей, то их влияние на процесс декарбонизации в ряде случаев становится весьма значительным.
Дата добавления: 2015-06-17 ; просмотров: 3959 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
🔥 Видео
Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Механизм электролитической диссоциации. 9 класс.Скачать

Электролитическая диссоциация / Диссоциация солейСкачать

Химия | Молекулярные и ионные уравненияСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Теория электролитической диссоциацииСкачать

Химия, 10-й класс, Электролитическая диссоциация. Диссоциация сильных электролитовСкачать

Реакции ионного обменаСкачать

Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать