8.2 ЭЛЕКТРОХИМИЧЕСКАЯ КОРРОЗИЯ
Причиной электрохимической коррозии * является возникновение на поверхности металла короткозамкнутых гальванических элементов *.
В тонком слое влаги, обычно покрывающем металл, растворяются кислород, углекислый, сернистый и другие газы, присутствующие в атмосферном воздухе. Это создает условия соприкосновения металла с электролитом *. Различные участки поверхности любого металла обладают разными потенциалами. Причинами этого могут быть наличие примесей в металле, различная обработка отдельных его участков, неодинаковые условия (окружающая среда), в которых находятся различные участки поверхности металла. При этом участки поверхности металла с более электроотрицательным потенциалом становятся анодами и растворяются.
Электрохимическая коррозия может развиваться в результате контакта различных металлов. В этом случае будет возникать не микр о- , а макрогальванопара , и коррозия называется контактной (см. детальную классификацию видов коррозии). Сочетания металлов, сильно отличающихся значениями электродных потенциалов *, в технике недопустимы (например, алюминий – медь). В случае коррозии, возникающей при контакте какого-либо металла со сплавом, последний имеет потенциал, соответствующий наиболее активному металлу, входящему в состав сплава. Например, при контакте латуни (сплав цинка и меди) с железом корродировать будет латунь за счет наличия в ней цинка.
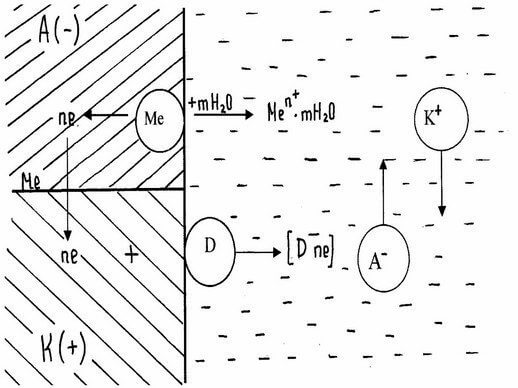
Представим схематично работу короткозамкнутого гальванического элемента, возникающего на поверхности металла, подверженного коррозии в электролите * (рисунок 8.1). Анодный участок имеет более электроотрицательный потенциал, поэтому на нем идет процесс окисления металла. Образовавшиеся в процессе окислен ия ио ны переходят в электролит, а часть освободившихся при этом электронов может перемещаться к катодному участку (на рисунке 8.1 показано стрелками). Процесс коррозии будет продолжаться в том случае, если электроны, перешедшие на катодный участок, будут с него удаляться. Иначе произойдет поляризация электродов *, и работа коррозионного гальванического элемента прекратится.
Рисунок 8.1 – Схема электрохимической коррозии. Д – деполяризатор
Процесс отвода электронов с катодных участков называется деполяризацией. Вещества, при участии которых осуществляется деполяризация, называются деполяризаторами. На практике чаще всего приходится встречаться с двумя типами деполяризации: водородной и кислородной. Тип деполяризации (катодный процесс) зависит от реакции среды раствора электролита.
В кислой среде электрохимическая коррозия протекает с водородной деполяризацией. Рассмотрим коррозию железной пластинки с примесями меди во влажной хлористоводородной атмосфере Имеется в виду атмосфера с примесью газообразного HCl. . В этом случае железо будет анодом ( E ° = –0,44В), а медь – катодом ( E ° =+0,34В). На анодном участке будет происходить процесс окисления железа, а на катодном – процесс деполяризац ии ио нами водорода, которые присутствуют в электролите:
А: Fe – 2e → Fe 2+ – окисление
К: 2 H + + 2e → H2 ↑ – восстановление
Схема возникающего короткозамкнутого гальванического элемента выглядит следующим образом:
A (–) Fe | HCl | Cu (+) К
В нейтральной среде коррозия протекает с кислородной деполяризацией, т.е. роль деполяризатора выполняет кислород, растворенный в воде. Этот вид коррозии наиболее широко распространен в природе: он наблюдается при коррозии металлов в воде, почве и в незагрязненной промышленными газами атмосфере. Если коррозии во влажном воздухе подвергается железо с примесями меди, то электродные процессы можно записать в виде:
(А) Fe – 2e → Fe 2+ – окисление
(К) 2 H2O + O2 + 4e → 4 OH – – восстановление
У поверхности металла в электролите протекают следующие реакции:
Fe 2+ + 2 OH – → Fe( OH)2
Основная масса черных металлов разрушается вследствие процесса ржавления, в основе которого лежат вышеуказанные реакции.
Коррозия металла в результате неравномерного доступа кислорода . Случаи электрохимической коррозии, возникающей вследствие неравномерной аэрации кислородом различных участков металла, очень часто встречаются в промышленности и в подземных сооружениях. Примером может служить коррозия стальной сваи, закопанной в речное дно (рис 8.2).
Рисунок 8.2 – Коррозия в результате неравномерного доступа кислорода. Б – техническое сооружение; А – анодный участок; К – катодный участок.
Часть конструкции, находящаяся в воде, омывается растворенным в ней кислородом и, в случае возникновения условий для электрохимической коррозии, будет выполнять роль катода. Другая же часть конструкции, находящаяся в почве, будет анодом и подвергнется разрушению.
Видео:Опыт 1. Электрохимическая коррозия в кислой средеСкачать

Задачи к разделу Коррозия металлов
В данном разделе вы найдете задачи по теме Коррозия металлов. Приведены уравнения реакций, протекающих при электрохимической коррозии металлов, а также примеры задач на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов.
Задача 1. В каком случае цинк корродирует быстрее: в контакте с никелем, железом или с висмутом? Ответ поясните. Напишите для всех случаев уравнение электрохимической коррозии в серной кислоте. Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Решение.
В месте контакта двух металлов корродирует более активный металл. Происходит отток электронов от более активного металла к менее активному. Металл тем активнее, чем более отрицателен его электродный потенциал. В таблице электродных потенциалов найдем:
В данном случае, цинк корродирует быстрее в контакте с висмутом, так как из перечисленных металлов, Bi является самым неактивным. В образовавшейся паре роль анода выполняет цинк.
Запишем уравнения электрохимической коррозии в серной кислоте:
Zn—Bi
К: 2H + +2e — = H2
А : Zn — 2e — = Zn 2+
Zn + 2H + = Zn 2+ + H2
Fe-Bi
К: 2H + +2e — = H2
А : Fe — 3e — = Fe 3+
2Fe + 6H + = Fe 3+ + 3H2
Ni-Bi
К: 2H + +2e — = H2
А : Ni — 2e — = Ni 2+
Ni + 2H + = Ni 2+ + H2
Будет ли оксидная пленка, образующаяся на кальции, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
т.е α Решение.
Протекторная защита заключается в присоединении к защищаемому металлическому изделию, металла с более отрицательным значением стандартного электродного потенциала E 0 , т.е. более активного металла. Для защиты железа подойдут, например, цинк и бериллий:
Запишем уравнения электрохимической коррозии во влажной среде, насыщенной кислородом:
Fe—Zn
К: O2 + 2H2O + 4e — = 4OH —
А: Zn — 2 e — = Zn 2+
Fe-Be
К: O2 + 2H2O + 4e — = 4OH —
А : Be — 2e — = Be 2+
Будет ли оксидная пленка, образующаяся на алюминии, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мок = 27·2+16·3 = 102 г/моль
т.е 2,5>α>1, а это значит, что оксидная пленка, образующаяся на Al, является сплошной и обладает защитными свойствами.
Задача 3. Деталь сделана из сплава, в состав которого входит магний и марганец. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии: а) в кислой среде; б) в кислой среде, насыщенной кислородом. Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Решение.
При электрохимической коррозии сплава, в первую очередь будет разрушаться более активный металл, т.е. металл, имеющий более отрицательное значение стандартного электродного потенциала. В таблице электродных потенциалов найдем:
По значениям E видно, что магний является более активным металлом, чем марганец, вследствие чего при коррозии Mg будет разрушаться в первую очередь.
Запишем уравнения электрохимической коррозии магния а) в кислой среде; б) в кислой среде, насыщенной кислородом:
а) в кислой среде
А: Mg — 2 e — = Mg 2+
Mg + 2H + = Mg 2+ + H2
б) в кислой среде, насыщенной кислородом
К: O2 + 2H2O + 4e — = 4OH —
А : Mg — 2e — =Mg +
Будет ли оксидная пленка, образующаяся на олове, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Олово может образовать два оксида SnO и SnO2, поэтому рассчитаем значение α для каждого случая
МSnO = 119+16 = 135 г/моль
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 4. С целью защиты от коррозии цинковое изделие покрыли оловом. Какое это покрытие: анодное или катодное? Напишите уравнение атмосферной коррозии данного изделия при нарушении целостности покрытия. Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Решение.
Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный), чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
В таблице электродных потенциалов найдем:
Олово будет выполнять роль катода и покрытие из него – катодное. При нарушении целостности покрытия, корродировать будет цинк, как более активный металл. При атмосферной коррозии протекают следующие уравнения реакций:
К: O2 + 2H2O + 4e — = 4OH —
А: Zn — 2 e — = Zn 2+
Оценить коррозионную стойкость алюминия в серной кислоте, если убыль массы алюминиевой пластины плотностью ρ = 2,7 г/см 3 , размером 70х20х1 мм составила после 8 суток испытания 0,0348 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(7·2) + 2·(7·0,1) + 2·(2·0,1) = 29,8 см 2
h = 0,0348/(29,8·2,7) = 0,00043см = 0,0043 мм
Kн = 365·0,0043/8 = 0,02 мм/год
По десятибалльной шкале коррозионной стойкости металлов, алюминий соответствует 4 баллам и относится к стойким металлам.
Задача 5. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя, а не внешняя часть смоченного металла. Чем это можно объяснить? Какой участок металла, находящийся под влиянием капли, является анодным, а какой катодным? Составьте электронные уравнения соответствующих процессов. Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Решение .
При нанесении на стальной предмет капли воды, наибольший доступ воздуха будет по краям капли, где протекает процесс восстановления кислорода. Т.е. края капли выступают в качестве катода. Для окисления железа остается центр капли, где доступ воздуха минимален. Здесь центр капли является анодом. В этом случае протекают следующие реакции:
А: Fe – 2e — = Fe 2+
Будет ли оксидная пленка, образующаяся на никеле, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Мок = 59+16 = 75 г/моль
Подставим значения в формулу:
α = 75·8,9/(59·1·6,7) = 1,7
т.е α лежит в интервале 2,5>α>1, т.е. оксидная пленка является сплошной и обладает защитными свойствами.
Задача 7. Сплав содержит железо и никель. Какой из названных компонентов будет разрушаться при атмосферной коррозии? Приведите уравнение анодного и катодного процессов. Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Решение.
Исходя из положения металлов в электрохимическом ряду напряжения металлов, находим, что железо более активный металл, чем никель:
Поэтому в первую очередь при атмосферной коррозии будет разрушаться железо. В этом случае протекают следующие реакции:
А: Fe – 2e — = Fe 2+
Далее Fe(OH)2 переходит в Fe(OH)3
Оценить коррозионную стойкость цинка на воздухе при высоких температурах. Образец цинка плотностью ρ = 7,14 г/см 3 , размером 50х30х1 мм после 180 часов окисления и снятия продуктов коррозии весил 10,6032 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(5·3) + 2·(5·0,1) + 2·(3·0,1) = 31,6 см 2
Масса металла до коррозии равна:
Убыль массы:
Δm = m1 – m2 = 10,71 — 10,6032 = 0,1068
h = 0,1068/(31,6·7,14) = 0,00047 см = 0,0047 мм
Kн = 365·0,0047/7,5 = 0,23 мм/год
По десятибалльной шкале коррозионной стойкости металлов, цинк соответствует 6 баллам и относится к пониженностойким металлам.
Задача 8. Почему химически чистое железо является более стойким против коррозии, чем техническое железо? Составьте уравнения анодного и катодного процессов, происходящих при коррозии технического железа во влажном воздухе и в азотной кислоте. Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Решение.
Техническое железо содержит примеси, которые, как правило, выполняют роль катода. Либо, если это углерод, который не передает в раствор положительно заряженных ионов и не имеет заградительного барьера от ионов водорода в кислой среде. Само железо будет служить анодом и подвергаться разрушению.
В химически чистом железе нет примесей, которые образовали бы гальванопару с железом, где бы оно окислялось.
При коррозии технического железа протекают следующие реакции:
Во влажном воздухе
А: Fe – 2e — = Fe 2+
Далее Fe(OH)2 переходит в Fe(OH)3
В азотной кислоте
А: Fe – 2e — = Fe 2+
Будет ли оксидная пленка, образующаяся на свинце, обладать защитными свойствами?
Защитные свойства пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе), значения которого вы найдете в таблице, приведенной в теоретической части данного раздела. Мы рассчитаем значение α по формуле:
Свинец может образовать оксиды состава PbO и PbO2, поэтому рассчитаем значение α для каждого случая
МPbO = 207+16 = 223 г/моль
т.е для всех оксидных пленок α лежит в интервале 2,5>α>1, т.е. они являются сплошными и обладают защитными свойствами.
Задача 9. Приведите примеры двух металлов, пригодных для протекторной защиты никеля. Для обоих случаев напишите уравнение электрохимической коррозии в среде азотной кислоты. Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см 3 , размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Решение.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Для протекторной защиты никеля подойдут, например, железо и цинк:
При электрохимической коррозии в среде азотной кислоты протекают следующие реакции:
Ni — Fe
А: Fe – 2e — = Fe 2+
Ni — Zn
Оценить коррозионную стойкость кадмия на воздухе при высоких температурах. Образец кадмия плотностью ρ = 8,65 г/см 3 , размером 45х25х1 мм после 150 часов окисления и снятия продуктов коррозии весил 10,0031 г.
Оценить коррозионную стойкость металла можно по формуле:
Kн = 365·h/τ
h = Δm/(S·ρ)
Найдем площадь поверхности металла:
S = 2·(4,5·2,5) + 2·(4,5·0,1) + 2·(2,5·0,1) = 23,9 см 2
Масса металла до начала коррозии равна:
m1 = V·ρ = 4,5·2,5·0,1·8,65 = 9,7313 г
Убыль массы:
Δm = m1 – m2 = 10,0031 – 9,7313 = 0,2718
h = 0,2718/(23,9·8,65) = 0,0013 см = 0,013 мм
Kн = 365·0,013·24/150 = 0,76 мм/год
По десятибалльной шкале коррозионной стойкости металлов, определяем, что в данных условиях, кадмий соответствует 7 баллам и относится к пониженностойким металлам.
Видео:Электрохимическая коррозияСкачать

Электрохимическая коррозия
Электрохимическая коррозия — самый распространенный вид коррозии. Электрохимическая коррозия возникает при контакте металла с окружающей электролитически проводящей средой. При этом восстановление окислительного компонента коррозионной среды протекает не одновременно с ионизацией атомов металла и от электродного потенциала металла зависят их скорости. Первопричиной электрохимической коррозии является термодинамическая неустойчивость металлов в окружающих их средах. Ржавление трубопровода, обивки днища морского суда, различных металлоконструкций в атмосфере — это, и многое другое, примеры электрохимической коррозии.
К электрохимической коррозии относятся такие виды местных разрушений, как питтинги, межкристаллитная коррозия, щелевая. Кроме того процессы электрохимической коррозии происходят в грунте, атмосфере, море.
Механизм электрохимической коррозии может протекать по двум вариантам:
1) Гомогенный механизм электрохимической коррозии:
— поверхностный слой мет. рассматривается как гомогенный и однородный;
— причиной растворения металла является термодинамическая возможность протекания катодного или же анодного актов;
— К и А участки мигрируют по поверхности во времени;
— скорость протекания электрохимической коррозии зависит от кинетического фактора (времени);
— однородную поверхность можно рассматривать как предельный случай, который может быть реализован и в жидких металлах.
2) Гетерогенный механизм электрохимической коррозии:
— у твердых металлов поверхность негомогенная, т.к. разные атомы занимают в сплаве различные положения в кристаллической решетке;
— гетерогенность наблюдается при наличии в сплаве инородных включений.
Электрохимическая коррозия имеет некоторые особенности: делится на два одновременно протекающих процесса (катодный и анодный), которые кинетически зависимы друг от друга; на некоторых участках поверхности электрохимическая коррозия может принять локальный характер; растворение основного мет. происходит именно на анодах.
Поверхность любого металла состоит из множества короткозамкнутых через сам металл микроэлектродов. Контактируя с коррозионной средой образующиеся гальванические элементы способствуют электрохимическому его разрушению.
Причины возникновения местных гальванических элементов могут быть самые разные:
1) неоднородность сплава
— неоднородность мет. фазы, обусловленная неоднородностью сплава и наличием микро- и макровключений;
— неравномерность окисных пленок на поверхности за счет наличия макро- и микропор, а также неравномерного образования вторичных продуктов коррозии;
— наличие на поверхности границ зерен кристаллов, выхода дислокации на поверхность, анизотропность кристаллов.
2) неоднородность среды
— область с ограниченным доступом окислителя будет анодом по отношению к области со свободным доступом, что ускоряет электрохимическую коррозию.
3) неоднородность физических условий
— облучение (облученный участок — анод);
— воздействие внешних токов (место входа блуждающего тока — катод, место выхода — анод);
— температура (по отношению к холодным участкам, нагретые являются анодами) и т. д.
При работе гальванического элемента одновременно протекает два электродных процесса:
Анодный — ионы металла переходят в раствор
Происходит реакция окисления.
Катодный — избыточные электроны ассимилируются молекулами или атомами электролита, которые при этом восстанавливаются. На катоде проходит реакция восстановления.
O2 + 2H2O + 4e → 4OH — (кислородная деполяризация в нейтральных, щелочных средах)
O2 + 4H + + 4e → 2H2O (кислородная деполяризация в кислых средах)
2 H + + 2e → H2 (при водородной деполяризации).
Торможение анодного процесса приводит к торможению и катодного.
При соприкосновении двух электропроводящих фаз (например, мет. — среда), когда одна из них заряжена положительно, а другая отрицательно, между ними возникает разность потенциала. Это явление связано с возникновением двойного электрического слоя (ДЭС). Заряженные частицы располагаются несимметрично на границе раздела фаз.
Скачек потенциалов в процессе электрохимической коррозии может происходить из-за двух причин:
При достаточно большой энергии гидратации ионы металла могут отрываться и переходить в раствор, оставляя на поверхности эквивалентное число электронов, которые определяют ее отрицательный заряд. Отрицательно заряженная поверхность притягивает к себе катионы мет. из раствора. Так на границе раздела фаз возникает двойной электрический слой.
На поверхности металла разряжаются катионы электролита. Это приводит к тому, что поверхность мет. приобретает положительный заряд, который с анионами раствора образует двойной электрический слой.
Иногда возникает ситуация, когда поверхность не заряжена и, соответственно, отсутствует ДЭС. Потенциал, при котором это явление наблюдается называется потенциалом нулевого заряда (φN). У каждого металла потенциал нулевого заряда свой.
Величина электродных потенциалов оказывает очень большое влияние на характер коррозионного процесса.
Скачок потенциала между двух фаз не может быть измерен, но при помощи компенсационного метода можно измерить электродвижущую силу элемента (ЭДС), который состоит из электрода сравнения (его потенциал условно принят за ноль) и исследуемого электрода. В качестве электрода сравнения берется стандартный водородный электрод. ЭДС гальванического элемента (стандартный водородный электрод и исследуемый элемент) называют электродным потенциалом. Электродами сравнения могут также выступать хлорсеребряный, каломельный, насыщенный медно-сульфатный.
Международной конвенцией в Стокгольме 1953г. решено при записях электрод сравнения всегда ставить слева. При этом ЭДС рассчитывать, как разность потенциалов правого и левого электродов.
Если положительный заряд внутри системы движется слева направо — ЭДС элемента считается положительной, при этом
где F — число Фарадея. Если положительные заряды будут двигаться в противоположном направлении, то уравнение будет иметь вид:
При коррозии в электролитах самыми распространенными и значимыми являются адсорбционные (адсорбция катионов или анионов на границе раздела фаз) и электродные потенциалы (переход катионов из металла в электролит или наоборот).
Электродный потенциал, при котором металл находится в состоянии равновесия с собственными ионами называется равновесный (обратимый). Он зависит от природы металлической фазы, растворителя, температуры электролита, активности ионов мет.
Равновесный потенциал подчиняется уравнению Нернста:
где, E ο — стандартный потенциал мет.; R — молярная газовая постоянная; n — степень окисления иона мет.; Т — температура; F — число Фарадея;αMe n+ — активность ионов мет.
При установленном равновесном потенциале электрохимическая коррозия не наблюдается.
Если по электроду проходит электрический ток — равновесное состояние его нарушается. Потенциал электрода изменяется в зависимости от направления и силы тока. Изменение разности потенц., приводящее к уменьшению силы тока, принято называть поляризацией. Уменьшение поляризуемости электродов называют деполяризацией.
Скорость электрохимической коррозии тем меньше, чем больше поляризация. Поляризация характеризуется величиной перенапряжения.
Поляризация бывает трех типов:
— электрохимическая (при замедлении анодного или катодного процессов);
— концентрационная (наблюдается, когда скорость подхода деполяризатора к поверхности и отвода продуктов коррозии мала);
— фазовая (связана с образованием на поверхности новой фазы).
Электрохимическая коррозия наблюдается также при контакте двух разнородных металлов. В электролите они образуют гальванопару. Более электроотрицательный из них будет анодом. Анод в процессе будет постепенно растворяться. При этом идет замедление или даже полное прекращение электрохимической коррозии на катоде (более электроположительном). Например, при контакте в морской воде дюралюминия с никелем интенсивно растворятся будет именно дюралюминий.
📹 Видео
Коррозия металла. Химия – ПростоСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Электрохимическая коррозия в кислой средеСкачать

Коррозия металлов и меры по ее предупреждению. 8 класс.Скачать

Коррозия металловСкачать

Электрохимическая коррозия (алюминий — медь)Скачать

Опыты по химии. Электрохимическая коррозия на примере меди и железаСкачать

Опыт: электрохимическая коррозияСкачать

Интересные факты о ржавчине #электрик #электрическийток #германияСкачать

Коррозия металлов и способы защиты от нееСкачать

Химия 11 класс (Урок№9 - Коррозия металлов и её предупреждение.)Скачать

8. Коррозия металловСкачать

Атмосферная коррозияСкачать

§13, 9 кл. Коррозия металловСкачать

Коррозия металлов и её предупреждениеСкачать

Она убьет любую сталь! Гальваническая или электрохимическая коррозия. Как работает и как бороться.Скачать

Межкристаллитная коррозияСкачать

Электрохимическая коррозия металлов и способы защитыСкачать