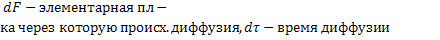В процессах переноса распределяемого вещества (массы) из одной фазы в другую надлежит различать два случая: 1) перенос из потока жидкости в поток жидкости, или массообмен между потоками жидкости, и 2) перенос из твердого тола в поток жидкости (или перенос в обратном направлении), т. е. массообмен между твердой фазой, содержащей внутри пор или капилляров распределяемое вещество, и потоком жидкости.Элементарными законами, которым подчиняется перенос распределяемого вещества из одной фазы в другую, являются закон молекулярной диффузии, закон массоотдачи и закон массопроводности.
Закон молекулярной диффузии или 1ый закон Фика.
Молекулярная диффузия в газах или р-ах жид-ти происходит в результате хаотического движения молекул. Перенос ве-ва осуществляется из области с более высокой концентрации в обл-ть с более низкой концентрацией, независимо от движения потоков.
В этом случае кинетика пр-са подчин. 1му закону Фика: кол-во продифундировавшего ве-ва пропорционально пл-ди перпендикулярной напряж. Диффузионного потока и временем,т.е.
dM=-D* 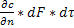
D-показывает какое кол-во ве-ва дифундирует через пов-ть в 1м 2 в течении 1сек. При разности концентраций на расстоянии 1м=1
Размерность D зависит от 1,от агрегатного состояния сис-мы,2. С увелеичением температ.коэф. диффузии увеличивается.3 с увелич.давления коэф.дифуз.уменьшается.
В основу рассмотрения явления конвективной диффузии положена теория диффузионного граничного слоя, которую разделяют большинство ученых Советского Союза.
 |
| Рис. 11-10. К формулировке закона конвективной диффузии. |
Согласно этой теории (рис. 11-10), распределяемое вещество переносится из ядра потока жидкости к границе раздела фаз непосредственно потоками жидкости и молекулярной диффузией. При этом воспринимаю- Гг( щая распределяемое вещество фаза считается либо твердой, либо близкой к ней (по способности гасить турбулентные пульсации потока). В рассматриваемой системе поток можно считать состоящим из двух частей: ядра и граничного диффузионного слоя. В ядре перенос вещества осуществляется преимущественно токами жидкости и в условиях достаточной турбулентности течения; концентрация распределяемого вещества в данном сечении и в условиях стационарного режима сохраняется постоянной. По мере приближения к граничному диффузионному слою турбулентность и, следовательно, турбулентный перенос затухают, с приближением к границе начинает превалировать перенос за счет молекулярной диффузии. Соответственно этому появляется градиент концентрации распределяемого вещества, растущий по мере приближения к границе. Таким образом, область граничного диффузионного слоя — это область появления и роста градиента концентрации, область увеличения молекулярной диффузии от пренебрежимо малого значения до максимального.
Если рассмотреть элементарный объем фазы (рис. 11-9), перемещающийся в граничном диффузионном слое, то станет очевидной возможность утверждать, что концентрация распределяемого вещества в нем меняется не только за счет молекулярной диффузии, но также и за счет механического переноса его из одной зоны концентрации в другую. В этом случае концентрация распределяемого вещества будет функцией не только пространственных координат и времени, как в случае только молекулярной диффузии, но и компонентов скорости перемещения элемента.
Соответственно этому изменение анализируемого параметра — концентрации С надлежит выразить через субстанциональную производную
При использовании субстанциональной производной приращение количеств распределяемого вещества в элементе за время 𝜕𝜏 может быть выражено как
Приращение количества распределяемого вещества за счет молекулярной диффузии определяется равенством (11.44). Приравнивая правые части равенств (11.44) и (11.50), получим уравнение конвективной диффузии:
7.Дифференциальные уравнения молекулярной и конвективной диффузии.
Дифференциальное уравнение молекулярной диффузии (второй закон Фика)
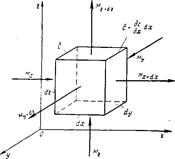
Для вы пода дифференциального уравнения молекулярной диффузии выделим в неподвижной среде или в движущемся ламинарном потоке элементарный параллелепипед с ребрами dх, dу и dz (рис. 11-9).
Если через этот элементарный параллелепипед за счет молекулярной диффузии перемещается распределяемое вещество, то через левую, заднюю и нижнюю грани за время d𝜏 в него входят количества вещества соответственно Мх, Му и Мz, а через противоположные грани — правую, переднюю и верхнюю — выходят количества вещества соответственно Мх+dх, Му+dу и Мг+dz. Следовательно, элемент за время d𝜏 приобретает диффундирующее вещество в количестве
При этом концентрация диффундирующего вещества повышается на 𝜕С/𝜕𝜏*d𝜏
Согласно основному закону молекулярной диффузии
Рис. 11-9. К выводу дифференциального уравнения молекул. диффуз
И Mx+dx=-D* 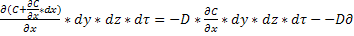
Складывая левые и правые части трех последних равенств, получим
dM=D(𝜕 2 C/𝜕x 2 +𝜕 2 C/dy 2 +𝜕 2 C/ 𝜕z 2 )*dx*dy*dz* d𝜏
С другой стороны, ту же прибыль количества диффундирующего вещества в элементе можно найти умножением объема элемента на изменение концентрации за время d𝜏, т. е.
Сопоставляя соотношения (11.44) и (11.45), получим дифференциальное уравнение молекулярной диффузии:
𝜕C/𝜕𝜏=D(𝜕 2 C/𝜕x 2 +𝜕 2 C/dy 2 +𝜕 2 C/ 𝜕z 2 )
В основу рассмотрения явления конвективной диффузии положена теория диффузионного граничного слоя, которую разделяют большинство ученых Советского Союза.
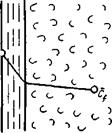 |
| Рис. 11-10. К формулировке закона конвективной диффузии. |
Согласно этой теории (рис. 11-10), распределяемое вещество переносится из ядра потока жидкости к границе раздела фаз непосредственно потоками жидкости и молекулярной диффузией. При этом воспринимаю- Гг( щая распределяемое вещество фаза считается либо твердой, либо близкой к ней (по способности гасить турбулентные пульсации потока). В рассматриваемой системе поток можно считать состоящим из двух частей: ядра и граничного диффузионного слоя. В ядре перенос вещества осуществляется преимущественно токами жидкости и в условиях достаточной турбулентности течения; концентрация распределяемого вещества в данном сечении и в условиях стационарного режима сохраняется постоянной. По мере приближения к граничному диффузионному слою турбулентность и, следовательно, турбулентный перенос затухают, с приближением к границе начинает превалировать перенос за счет молекулярной диффузии. Соответственно этому появляется градиент концентрации распределяемого вещества, растущий по мере приближения к границе. Таким образом, область граничного диффузионного слоя — это область появления и роста градиента концентрации, область увеличения молекулярной диффузии от пренебрежимо малого значения до максимального.
Если рассмотреть элементарный объем фазы (рис. 11-9), перемещающийся в граничном диффузионном слое, то станет очевидной возможность утверждать, что концентрация распределяемого вещества в нем меняется не только за счет молекулярной диффузии, но также и за счет механического переноса его из одной зоны концентрации в другую. В этом случае концентрация распределяемого вещества будет функцией не только пространственных координат и времени, как в случае только молекулярной диффузии, но и компонентов скорости перемещения элемента.
Соответственно этому изменение анализируемого параметра — концентрации С надлежит выразить через субстанциональную производную
При использовании субстанциональной производной приращение количеств распределяемого вещества в элементе за время 𝜕𝜏 может быть выражено как
Приращение количества распределяемого вещества за счет молекулярной диффузии определяется равенством (11.44). Приравнивая правые части равенств (11.44) и (11.50), получим уравнение конвективной диффузии:
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Лекция № 11 Процесс массопередачи
Массопередача – это сложный процесс, включающий перенос вещества (массы) в пределах одной фазы, перенос через поверхность раздела фаз и его перенос в пределах другой фазы. Как известно, при теплопередаче обменивающиеся теплотой среды в большинстве случаев разделены твердой стенкой, в то время как массопередача происходит обычно через границу раздела соприкасающихся фаз. Эта граница может быть либо подвижной (массопередача в системах газ-жидкость или пар-жидкость, жидкость-жидкость), либо неподвижной (массопередача с твердой фазой).
массоотдача – это перенос вещества из фазы к границе раздела фаз или в обратном направлении, т. е. в пределах только одной фазы.
Виды процессов массопередачи. В промышленности применяются в основном следующие процессы массопередачи:
1. Абсорбция — поглощение газа жидкостью, т. е. процесс разделения, характеризуемый переходом вещества из газовой фазы в жидкую.
2. Экстракция (в системе жидкость-жидкость) — извлечение вещества, растворенного в жидкости, другой жидкостью, практически несмешивающейся или частично смешивающейся с первой. При этом извлекаемый компонент исходного раствора переходит из одной жидкой фазы в другую.
8. Перегонка — разделение гомогенных жидких смесей путем взаимного обмена компонентами между жидкостью и паром, полученным испарением разделяемой жидкой смеси.
4. Адсорбция — поглощение компонента газа, пара или раствора твердым пористым поглотителем, т. е. процесс разделения, характеризуемый переходом вещества из газовой (паровой) или жидкой фазы в твердую.
5. Сушка — удаление влаги из твердых материалов, главным образом путем ее испарения.
6. Кристаллизация — выделение твердой фазы в виде кристаллов из растворов или расплавов.
7. Растворение и экстракция (в системе твердое тело — жидкость).
Процессы массопередачи можно разделить на две группы.
К одной группе относятся процессы (абсорбция, экстракция и др.), в которых участвуют минимально три вещества: одно находится только в одной фазе, другое — только во второй фазе, а третье — переходит из одной фазы в другую и представляет собой распределяемое между фазами вещество.
К другой группе относятся процессы (например, перегонка), в которых вещества, составляющие две фазы, обмениваясь компонентами, сами непосредственно участвуют в массопередаче и уже не могут рассматриваться как инертные носители распределяемого вещества.
Скорость массообменных процессов, как правило, лимитируется молекулярной диффузией. Поэтому процессы массопередачи иногда называют диффузионными процессами.
Равновесие при массопередаче
Правило фаз. Знание равновесия в процессах массопередачи позволяет установить пределы, до которых могут протекать эти процессы. В основе равновесия лежит известное правило фаз:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Ф + С = К + 2, (1)
где Ф — число фаз; С — число степеней свободы, т. е. число независимых переменных, значения которых можно произвольно изменять без нарушения числа или вида (состава) фаз в системе; К — число компонентов системы.
Правило фаз указывает число параметров, которое можно менять произвольно (в известных пределах) при расчете равновесия в процессах масообмена.
Зависимости между независимыми переменными могут быть изображены в плоских координатах в виде так называемых фазовых диаграмм. В расчетах по массопередаче используют диаграммы зависимости давления от концентрации (при t = const), температуры от концентрации (при Р = const) и диаграммы зависимости между равновесными концентрациями фаз, приведенные ниже.
Фазовое равновесие. Линия равновесия. Рассмотрим в качестве примера процесс массопередачи, в котором аммиак, представляющий собой распределяемый компонент, поглощается из его смеси с воздухом чистой водой, т. е. ввиду отсутствия равновесия переходит из газовой фазы Фу, где его концентрация равна у, в жидкую фазу Фх, имеющую начальную концентрацию х = 0. С началом растворения аммиака в воде начнется переход части его молекул в обратном направлении со скоростью, пропорциональной концентрации аммиака в воде и на границе раздела фаз. С течением времени скорость перехода аммиака в воду будет снижаться, а скорость обратного перехода возрастать, причем такой двусторонний переход будет продолжаться до тех пор, пока скорости переноса в обоих направлениях не станут равны друг другу. При равенстве скоростей установится динамическое равновесие, при котором не будет происходить видимого перехода вещества из фазы в фазу.
При равновесии достигается определенная зависимость между предельными или равновесными концентрациями распределяемого вещества в фазах для данных температуры и давления, при которых осуществляется процесс массопередачи.
В условиях равновесия некоторому значению 





Отношение концентраций фаз при равновесии называется коэффициентом распределения 
Конкретный вид законов равновесного распределения различен для разных процессов массопередачи. Так, например, в процессе абсорбции при низких концентрациях распределяемого вещества в исходном растворе равновесие описывается законом Генри для идеальных растворов в процессах ректификации — законом Рауля и т. д.
Зная линию равновесия для конкретного процесса и рабочие, т. е. неравновесные, концентрации фаз в соответствующих точках, можно определить направление и движущую силу массопередачи в любой точке аппарата. На основе этих данных может быть рассчитана средняя движущая сила, а по ней — скорость процесса массопередачи.

Зависимость между рабочими концентрациями распределяемого вещества в фазах 

Рассмотрим схему массообменного аппарата, работающего в режиме идеального вытеснения при противотоке фаз (рис. 2). Пусть в процессе массопередачи из фазы в фазу, например из газовой фазы в жидкую, переходит только один распределяемый компонент (скажем, аммиак).
Сверху в аппарат поступает Lн кг/с одной фазы (жидкой), содержащей 





Тогда материальный баланс по всему веществу

и материальный баланс по распределяемому компоненту

Теперь напишем уравнения материального баланса для части аппарата от его нижнего конца до некоторого произвольного сечения, для которого расходы фаз составляют G и L кг/с, а их текущие концентрации равны 

Материальный баланс по всему веществу

и материальный баланс по распределяемому компоненту

Решая это уравнение относительно 

Уравнение (7) представляет собой уравнение рабочей линии, выражающее связь между рабочими концентрациями распределяемого компонента в фазах для произвольного сечения аппарата.
Расходы фаз постоянны по высоте аппарата, например в процессах ректификации, когда числа молей компонентов, которыми обмениваются фазы, равны. В других случаях, если концентрации фаз мало изменяются по высоте аппарата, то расходы фаз по его высоте можно с достаточной для практических целей точностью считать постоянными, т. е. принять L = const и G = const. При этом Lк = L, Gн = G и уравнение (7) приводится к виду

Вводя обозначения 


Выражения (8) и (9) являются уравнениями рабочей линии, которыми обычно пользуются при расчетах массообменных процессов.
Таким образом, рабочая линия представляет собой прямую, которая наклонена к горизонту под углом, тангенс которого равен А, и отсекает на оси ординат отрезок, равный В. Рабочая линия для всего аппарата ограничена точками с координатами 



Скорость массопередачи
Скорость массопередачи связана с механизмом переноса распределяемого вещества в фазах между которыми происходит массообмен.
Перенос вещества внутри фазы может происходить только путем молекулярной диффузии либо путем конвекции и молекулярной диффузии одновременно. Посредством одной молекулярной диффузии вещество перемещается, строго говоря, лишь в неподвижной среде. В движущейся среде перенос вещества осуществляется как молекулярной диффузией, так и самой средой в направлении ее движения или отдельными ее частицами в разнообразных направлениях.
В турбулентном потоке перенос молекулярной диффузией преобладает только вблизи границы фазы. При турбулентном течении возникают нерегулярные пульсации скорости, под действием которых, наряду с общим движением потока, происходит перемещение частиц во всех направлениях, в том числе и в поперечном.
Конвективный перенос вещества, осуществляемый под действием турбулентных пульсаций, часто называют турбулентной диффузией.
Молекулярная диффузия. Молекулярной диффузией называется перенос распределяемого вещества, обусловленный беспорядочным тепловым движением молекул, атомов, ионов, коллоидных частиц. Молекулярная диффузия описывается первым законом Ф и к а, согласно которому масса вещества dМ, продиффундировавшего за время dt через элементарную поверхность dF (нормальную к направлению диффузии), пропорциональна градиенту концентрации этого вещества


Из выражения (1) следует, что удельный поток вещества, переносимого молекулярной диффузией через единицу поверхности (F = 1) в. единицу времени (t = 1), или скорость молекулярной диффузии, составляет

По своей структуре закон Фика аналогичен закону Фурье, описывающему передачу тепла теплопроводностью, причем аналогом градиента температур является в данном случае градиент концентраций, представляющий собой изменение концентрации диффундирующего вещества на единицу длины нормали между двумя поверхностями постоянных, но различных концентраций.
Коэффициент пропорциональности D в выражении закона Фика называется коэффициентом молекулярной диффузии, или просто коэффициентом диффузии. Знак минус перед правой частью первого закона Фика указывает на то, что молекулярная диффузия всегда протекает в направлении уменьшения концентрации распределяемого компонента.
Согласно уравнению (1), коэффициент диффузии выражается как:
откуда (до сокращения одноименных величин) вытекает физический смысл D. Коэффициент диффузии, показывает, какая масса вещества диффундирует в единицу времени через единицу поверхности при градиенте концентрации, равном единице.
Коэффициент молекулярной диффузии представляет собой физическую константу, характеризующую способность данного вещества проникать вследствие диффузии в неподвижную среду. Величина D таким образом не зависит от гидродинамических условий, в которых протекает процесс.
Турбулентная диффузия. Масса вещества dMт, переносимого в пределах фазы вследствие турбулентной диффузии, может быть принята, по аналогии с молекулярной диффузией, пропорциональной поверхности dF, времени dt и градиенту концентрации 

где 
Коэффициент турбулентной диффузии 
Коэффициент 

Конвективный перенос. Скорость конвективного, переноса вещества вместе с самой средой в направлении, совпадающем с направлением общего потока, равна

где v — скорость потока жидкости, газа или пара; С — коэффициент пропорциональности.
Суммарный перенос вещества вследствие конвективного переноса и молекулярной диффузии, по аналогии с теплообменом, называют конвективным массообменом или конвективной диффузией.
Распределение концентрации при переносе путем конвективной диффузии определяется в самом общем виде дифференциальным уравнением конвективной диффузии.
Дифференциальное уравнение конвективной диффузии. Выделим в потоке данной фазы элементарный параллелепипед с ребрами dx, dy и dz, ориентированными относительно осей координат, как показано на рис. 1. Рассмотрим материальный баланс по распределяемому веществу для параллелепипеда в наиболее общем случае неустановившегося массообмена. Будем считать, что процесс переноса происходит в условиях установившегося движения потока фазы. Распределяемое вещество проходит сквозь грани параллелепипеда как путем конвективного переноса, так и молекулярной диффузии.
Обозначим концентрацию распределяемого вещества в плоскости левей грани параллелепипеда площадью dydz через с и проекции скорости на оси координат для данного элемента (точки) потока — через 


Тогда масса вещества, поступающего только путем конвективной диффузии через площадь dydz, т. е. в направлении оси х, за время dt составит

На противоположной грани параллелепипеда скорость в направлении оси х равна 


Разность между массами вещества, прошедшего через противоположные грани параллелепипеда за время dt в направлении оси х, равна

где dV = dx dy dz — объем элементарного параллелепипеда. Аналогично в направлении осей у и z:


Таким образом, содержание распределяемого вещества в объеме параллелепипеда изменится за время dt вследствие перемещения вещества только путем конвективной диффузии на величину
или в развернутом виде

Согласно уравнению неразрывности потока для установившегося движения фазы

Следовательно, предыдущее выражение dMк примет вид

Масса распределяемого вещества, поступающего в параллелепипед только путем молекулярной диффузии через грань dy dz за время dt составляет

Масса вещества, выходящего за то же время путем молекулярной диффузии через противоположную грань,

Разность между массами продиффундировавшего через противоположные грани параллелепипеда вещества в направлении оси х за время dt равна

Аналогично в направлении осей у и z:


Масса распределяемого вещества в объеме всего параллелепипеда за время dt изменится при переносе путем молекулярной диффузии на величину

В результате изменение массы распределяемого вещества во времени в объеме параллелепипеда

Изменение массы распределяемого вещества за счет конвективной и молекулярной диффузии в объеме параллелепипеда по закону сохранения массы должно равняться соответствующему изменению массы этого вещества во времени, т. е.

Проводя соответствующие сокращения и перегруппировывая члены этого уравнения, получим


или в более краткой записи

Уравнение (20) представляет собой дифференциальное уравнение конвективной диффузии. Оно выражает закон распределения концентрации данного компонента в движущейся стационарно среде при неустановившемся процессе массообмена.
Уравнение (20) по структуре аналогично дифференциальному уравнению конвективного теплообмена (уравнению Фурье-Кирхгофа). Отличие состоит в том, что в уравнение (20) вместо температурного градиента входит градиент концентрации, а вместо коэффициента температуропроводности а — коэффициент молекулярной диффузии D.
Для частного случая установившегося массообмена уравнение (20) принимает вид:

При массообмене в неподвижной среде 



Уравнение (22) носит название второго закона Фика. В дифференциальном уравнении конвективной диффузии, помимо концентрации, переменной является скорость потока. Поэтому данное уравнение надо рассматривать совместно с дифференциальными уравнениями гидродинамики: уравнениями Навье-Стокса и уравнением неразрывности потока. Однако эта система уравнений не имеет аналитического решения, и для получения расчетных зависимостей по массообмену приходится прибегать к преобразованию дифференциального уравнения конвективной диффузии методами теории подобия.
Ввиду сложности механизма процессов массоотдачи в фазах для практических целей принимают, что скорость массоотдачи пропорциональна движущей силе, равной разности концентраций в ядре и на границе фазы или (в случае обратного направления переноса) разности концентраций на границе и в ядре фазы. Соответственно, если распределяемое вещество переходит из фазы Фу в фазу Фх, то основное уравнение массоотдачи, определяющее количеством М вещества, переносимого в единицу времени в каждой из фаз (к границе фазы или в обратном направлении), выражается следующим образом:


входящие в эти уравнения разности концентраций 





Коэффициенты пропорциональности в уравнениях (1) и (1, а) называются коэффициентами массоотдачи. Коэффициенты массоотдачи 

Коэффициент массоотдачи является не физической константой, а кинетической характеристикой, зависящей от физических свойств фазы (плотности, вязкости и др.) и гидродинамических условий в ней (ламинарный или турбулентный режим течения), связанных в свою очередь с физическими свойствами фазы, а также с геометрическими факторами, определяемыми конструкцией и размерами массообменного аппарата, Таким образом, величина 
По своему смыслу коэффициент массоотдачи является аналогом коэффициента теплоотдачи в процессах переноса тепла, а основное уравнение массоотдачи идентично по структуре основному уравнению теплоотдачи.
Коэффициент массоотдачи может быть выражен в различных единицах в зависимости от выбора единиц для массы распределяемого вещества и движущей силы. Если принять, что масса вещества выражена в килограммах, то в общей форме коэффициент массоотдачи выразится следующим образом:
При этом единица измерения р в каждом конкретном случае будет связана с единицами, принятыми для выражения движущей силы (табл. Х-1).
Подобие процессов переноса массы. Наиболее строгий и принципиально возможный путь для определения коэффициентов массоотдачи, заключается в интегрировании уравнения диффузии в движущейся среде (Х,19) совместно с уравнениями движения, т. е. с уравнениями Навье-Стокса и уравнением неразрывности потока при заданных начальных и граничных условиях.
Однако система указанных уравнений практически не имеет общего решения. Поэтому так же, как для гидродинамических и теплообменных процессов, не решая системы основных уравнений, можно методами теории подобия найти связь между переменными, характеризующими процесс переноса в потоке фазы, в виде обобщенного (критериального) уравнения массоотдачи.
Общая функциональная зависимость Nu’ от определяющих критериев и симплексов подобия для неустановившихся процессов массоотдачи может быть выражена как

Для установившихся процессов массоотдачи условие равенства критериев Fo’ в сходственных точках подобных потоков отпадает н приведенные выше обобщенные зависимости принимают вид:

Расчетная зависимость типа уравнения (13 и 14) называется обобщенным или критериальным уравнением массоотдачи.
Как отмечалось, процесс массопередачи включает процессы массоотдачи в пределах каждой из двух взаимодействующих фаз и, кроме того, процесс переноса распределяемого вещества через поверхность раздела фаз. Сложность расчета процесса связана с тем, что практически невозможно измерить концентрации фаз непосредственно у границы их раздела. Учитывая это, основное уравнение массопередачи, определяющее массу М вещества, переносимого из фазы в фазу в единицу времени (нагрузку аппарата), выражают следующим образом:


где у*, х* — равновесные концентрации в данной фазе, соответствующие концентрациям распределяемого вещества в основной массе (ядре) другой фазы; Ку, Кх— коэффициенты и массопередачи, выраженные соответственно через концентрации фаз Фу и Фх.
Коэффициент массопередачи (Kу или Кх) показывает, какая масса вещества переходит из фазы в фазу за единицу времени через единицу поверхности контакта фаз при движущей силе массопередачи, равной единице.
По физическому смыслу коэффициенты массопередачи отличаются от коэффициентов массоотдачи, но выражены в одинаковых с ними единицах измерения. Таким образом, коэффициенты массопередачи могут выражаться в м/с, кг/(м2 с); кг/(м2 с мол доли) и в с/м.
Концентрации фаз изменяются при их движении вдоль поверхности раздела, соответственно изменяется движущая сила массопередачи. Поэтому в уравнение массопередачи вводят величину средней движущей силы ( 



С помощью уравнений (3) и (4) обычно находят поверхность контакта фаз F и по ней рассчитывают основные размеры аппарата. Для определения F необходимо предварительно рассчитать коэффициент массопередачи Kу или Кх и среднюю движущую силу. Величина М либо задается при расчете, либо определяется из материального баланса.
Зависимость между коэффициентами массопередачи и массоотдачи. Чтобы установить связь между коэффициентом массопередачи и коэффициентами массоотдачи, обычно принимают, что да границе раздела фаз см. рис. 5) достигается равновесие. Это предположение равносильно допущению о том, что сопротивлением переносу через границу раздела фаз можно пренебречь. Отсюда вытекает, как следствие, положение об аддитивности фазовых сопротивлений, которое является одной из предпосылок для расчета коэффициента массопередачи. Допустим, что распределяемое вещество переходит из фазы Фу в фазу Фх, и движущая сила массопередачи выражается в концентрациях фазы Фу. При установившемся процессе массопередачи количество вещества, переходящее из фазы в фазу, определим по уравнению (1).
Для упрощения рассмотрим случай, когда равновесная зависимость % между концентрациями в фазах линейна, т. е. линия равновесия описывается уравнением у* = m x, где т – тангенс угла наклона линии равновесия. После ряда преобразований получаем

При выражении коэффициента массопередачи в концентрациях фазы Фх аналогичные рассуждения приводят к зависимости

Левые части уравнений (9) и (10) представляют собой общее сопротивление переносу вещества из фазы в фазу, т. е. сопротивление массопередаче, а их правые части — сумму сопротивлений массоотдаче в фазах. Поэтому зависимости (9) и (10) являются уравнениями аддитивности фазовых сопротивлений.
При т = const уравнение (10) можно получить, разделив уравнение (9) на т. Отсюда следует, что величины Kу и Kх связаны зависимостью Kу = Kх/m.
Уравнения аддитивности (9) и (10) выведены для линейной равновесной зависимости, но они остаются в силе и для кривой линии равновесия.
Видео:Броуновское движение. Диффузия в жидкостях, газах и твердых телах | Физика 7 класс #5 | ИнфоурокСкачать

Диффузия молекул
Диффузией молекул является процесс перемещения вещества, обусловленный беспорядочным движением молекул.
Диффузия молекул происходит без видимого движения участков вещества, движение молекул является тепловым. Молекулярная диффузия происходит из-за распределения концентрации вещества и является самопроизвольным процессом движения вещества.
Диффузия является концентрационной, если ее причиной является неоднородная концентрация вещества в смеси.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Основные понятия о диффузии молекул
Диффузия молекул замечательно описывается первым законом Фика, в соответствии с которым количество вещества (dM) , продиффундировавшего за конкретное время (dt) через элементарную поверхность (dF) , будет пропорционально градиенту концентрации () этого вещества:
Из второй формулы можно вывести скорость диффузии молекул, которая является удельным потоком транспортирующегося вещества сквозь единицу поверхности (F) за единицу времени (t) и рассчитывается по формуле:
По своей сути закон Фика перекликается с законом Фурье, описывающем передачу тепла при помощи теплопроводности. В этом случае градиент концентраций выступает аналогом градиента температур. Он характеризует смену концентрации вещества, что продиффундировало, относительно линии между поверхностями неоднородных концентраций.
Видео:Просто о сложном - ДиффузияСкачать

Коэффициент молекулярной диффузии
Коэффициент пропорциональности (D) в уравнении первого закона Фика, называется коэффициентом диффузии молекул. Из формулы (1) формируем выражение для расчета коэффициента диффузии:
Этот коэффициент показывает количество вещества, которое продиффундирует за единицу времени сквозь поверхность с единичным градиентом концентрации вещества. Коэффициент диффузии (D) считается аналогом коэффициента теплопроводности (а) .
Сложно разобраться самому?
Попробуй обратиться за помощью к преподавателям
Коэффициент диффузии молекул – это физическая постоянная, которая характеризует способность вещества проникать в другое неподвижное вещество с помощью явления диффузии. Значит, величина этого коэффициента не зависит от гидродинамики происходящего процесса. Величина коэффициента может изменяться лишь при изменении температуры или давления. Величина коэффициента диффузии в каждом конкретном случае будет рассчитываться при помощи теоретических или полуэмпирических уравнений, учитывающих температуру и давление.
Стоит отметить, что при диффузии газов коэффициент диффузии D будет находиться в диапазоне от 0,1 до 1 см 3 /с. При диффундировании газа в жидкость он составит около 1 см 3 /сутки. Это означает, что процесс молекулярной диффузии довольно медленный, особенно в жидкостях.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Практические примеры молекулярной диффузии
Диффузия в физике рассматривается как хаотичный процесс, происходящий на уровне молекул и вызванный их беспорядочным движением. При этом скорость диффузии будет пропорциональна скорости движения отдельных молекул. Таким образом, процесс молекулярной диффузии будет определяться максимальной тепловой скоростью молекул, то есть молекул с минимальной массой.
Диффузия характеризуется перемещением энергии или материи из точки с большей концентрацией в точку с меньшей концентрацией вещества. Самым наглядным примером диффузии молекул является процесс перемешивания газов или жидкостей. К примеру, при попадании капли краски в воду, она постепенно в ней растворяется, окрашивая весть объем воды.
Не нашли что искали?
Просто напиши и мы поможем
Еще одним ярким примером является процесс нагревания твердого тела. Если мы, к примеру, возьмем металлический стержень и начнем его нагревать с одной стороны, то тепло постепенно распространится к его другому концу. Та же ситуация наблюдается при подведении заряда электроэнергии к одному из концов стержня.
В примере с металлическим стержнем мы наблюдаем быстрое нагревание и распространение тепла, ровно так же, ка и тока. Если же мы возьмем синтетический стержень, то процесс тепловой и электрической диффузии будет протекать намного медленнее.
Длительность процесса молекулярной диффузии можно наблюдать, положив кусочек сахара в стакан с водой и не перемешивая их. Раствор достигнет однородности лишь через несколько недель.
Еще более длительным будет диффузия твердых веществ. Так, например, медь, вскрытая позолотой, лишь спустя тысячи лет пропитается золотом всего на пару микрометров.
🎦 Видео
Закон диффузии ФикаСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Урок 12 (осн). Диффузия. Броуновское движениеСкачать

Лекция 29 Задача Коттрелла Cлучай неравных коэффициентов диффузииСкачать

Количество вещества. Молярная масса | Химия 8 класс #16 | ИнфоурокСкачать

Решение задач на нахождение молекулярной массы вещества. Урок 14. Химия 10 классСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Как решать уравнения с модулем или Математический торт с кремом (часть 1) | МатематикаСкачать

Уравнения математической физики. Уравнение теплопроводности (диффузии).Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Органика. Решение задачи на определение состава вещества по продуктам его сгорания.Скачать

10.1 Закон Фика и уравнение диффузии моноэнергетических нейтронов (часть 1)Скачать