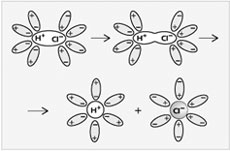
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A — (анион)
Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
- Растворы; электролитическая диссоциация; гидролиз солей
- Растворы; электролитическая диссоциация; гидролиз солей
- Учебные вопросы:
- 9.1. Растворы и их классификация
- 9.2. Физическая и химическая теория растворов; тепловые явления при растворении
- 9.3. Растворимость и ее зависимость от природы веществ
- Теория электролитической диссоциации
- 🔍 Видео
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:
Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:
Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.
Электролиты — жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.
Неэлектролиты — вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.
Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:
Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы
Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике — остается только то, что сократить нельзя.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Растворы; электролитическая диссоциация; гидролиз солей
Электронное учебное пособие
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Растворы; электролитическая диссоциация; гидролиз солей
В результате изучения данной темы вы узнаете:
В результате изучения данной темы вы научитесь:
Учебные вопросы:9.1. Растворы и их классификацияРастворами называют гомогенные системы, в которых одно вещество распределено в среде другого (других) веществ. Растворы состоят из растворителя и растворенного вещества (веществ). Эти понятия условны. Если одним из составляющих растворов веществ является жидкость, а другими — газы или твердые вещества, то растворителем обычно считают жидкость. В других случаях растворителем считают тот компонент, которого больше. Газообразные, жидкие и твердые растворы В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы. Газообразным раствором является, например, воздух и другие смеси газов. Морская вода — наиболее распространенный жидкий раствор различных солей и газов в воде. К твердым растворам принадлежат многие металлические сплавы. Истинные и коллоидные растворы По степени дисперсности различают истинные и коллоидные растворы (коллоидные системы). При образовании истинных растворов растворенное вещество находится в растворителе в виде атомов, молекул или ионов. Размер частиц в таких растворах равен 10 –7 — 10 –8 см. Коллоидные растворы относятся к гетерогенным системам, в которых частицы одного вещества (дисперсная фаза) равномерно распределены в другом (дисперсионная среда). Размер частиц в дисперсных системах находится в пределах от 10 –7 см до 10 –3 и более см. Следует отметить, что здесь и далее везде мы будем рассматривать истинные растворы. Ненасыщенные, насыщенные и пересыщенные растворы Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. Так, процесс растворения твердых веществ, имеющих ионное строение, в жидкостях можно представить следующим образом: под влиянием растворителя разрушается кристаллическая решетка твердого вещества, а ионы распределяются равномерно по всему объему растворителя. Раствор останется ненасыщенным до тех пор, пока в него может переходить еще некоторое количество вещества. Раствор, в котором вещество при данной температуре больше не растворяется, т.е. раствор, находящийся в состоянии равновесия с твердой фазой растворяемого вещества, называется насыщенным. Растворимость данного вещества равна его концентрации в насыщенном растворе. При строго определенных условиях (температура, растворитель) растворимость есть величина постоянная. Если растворимость вещества увеличивается с ростом температуры, то охлаждая насыщенный при более высокой температуре раствор, можно получить пересыщенный раствор, т.е. такой раствор, концентрация вещества в котором выше концентрации насыщенного раствора (при данных температуре и давлении). Пересыщенные растворы очень неустойчивы. Легкое сотрясение сосуда или введение в раствор кристаллов вещества, находящегося в растворе, вызывает кристаллизацию избытка растворенного вещества, и раствор становится насыщенным. Разбавленные и концентрированные растворы Не следует путать ненасыщенный и насыщенный растворы с разбавленным и концентрированным. Понятия разбавленный и концентрированный растворы – относительные и между ними нельзя провести четкой границы. Они определяют соотношение между количествами растворенного вещества и растворителя. В общем случае, разбавленные растворы – это растворы, содержащие небольшие количества растворенного вещества по сравнению с количеством растворителя, концентрированные – с большим содержанием растворенного вещества. Например, если при 20 o С растворить в 100 г воды 25 г NaCl, то полученный раствор будет концентрированным, но ненасыщенным, поскольку растворимость хлорида натрия при 20 o С составляет 36 г в 100 г воды. Максимальная масса AgI, которая растворяется при 20 o С в 100 г Н2О равна 1,3·10 –7 г. Полученный при этих условиях раствор AgI будет насыщенным, но очень разбавленным. 9.2. Физическая и химическая теория растворов; тепловые явления при растворенииФизическая теория растворов была предложена В. Оствальдом (Германия) и С. Аррениусом (Швеция). Согласно этой теории частицы растворителя и растворенного вещества (молекулы, ионы) равномерно распределяются по всему объему раствора вследствие процессов диффузии. При этом между растворителем и растворенным веществом отсутствует химическое взаимодействие. Химическая теория была предложена Д.И. Менделеевым. Согласно представлениям Д.И. Менделеева между молекулами растворяемого вещества и растворителем происходит химическое взаимодействие с образованием неустойчивых, превращающихся друг в друга соединений растворенного вещества с растворителем – сольватов. Русские ученые И.А. Каблуков и В.А. Кистяковский объединили представления Оствальда, Аррениуса и Менделеева, заложив тем самым основу современной теории растворов. Согласно современной теории в растворе могут существовать не только частицы растворенного вещества и растворителя, но и продукты физико-химического взаимодействия растворенного вещества с растворителем – сольваты. Сольваты – это неустойчивые соединения переменного состава. Если растворителем является вода, их называют гидратами. Сольваты (гидраты) образуются за счет ион-дипольного, донорно-акцепторного взаимодействий, образования водородных связей и т.д. Например, при растворении NaCl в воде между ионами Na + , Cl – и молекулами растворителя возникает ион-дипольное взаимодействие. Образование гидратов аммиака при его растворении в воде происходит за счет образования водородных связей. Гидратная вода иногда настолько прочно связывается с растворенным веществом, что выделяется вместе с ним из раствора. Кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами, а вода, входящая в состав таких кристаллов, называется кристаллизационной. Примерами кристаллогидратов является медный купорос CuSO4·5H2O, алюмокалиевые квасцы KAl(SO4)2·12H2O. Тепловые эффекты при растворении В результате изменения структуры веществ при переходе их из индивидуального состояния в раствор, а также в результате происходящих взаимодействий изменяются свойства системы. На это указывают, в частности, тепловые эффекты растворения. При растворении происходят два процесса: разрушение структуры растворяемого вещества и взаимодействие молекул растворенного вещества с молекулами растворителя. Взаимодействие растворенного вещества с растворителем называется сольватацией. На разрушение структуры растворяемого вещества затрачивается энергия, а взаимодействие частиц растворенного вещества с частицами растворителя (сольватация) – процесс экзотермический (идет с выделением теплоты). Таким образом, процесс растворения может быть экзотермическим или эндотермическим, в зависимости от соотношения этих тепловых эффектов. Например, при растворении серной кислоты наблюдается сильное разогревание раствора, т.е. выделение теплоты, а при растворении нитрата калия – сильное охлаждение раствора (эндотермический процесс) . 9.3. Растворимость и ее зависимость от природы веществРастворимость – наиболее изученное свойство растворов. Растворимость веществ в различных растворителях колеблется в широких пределах. В табл. 9.1 приведена растворимость некоторых веществ в воде, а в табл. 9.2 – растворимость йодида калия в различных растворителях. Таблица 9.1.Растворимость некоторых веществ в воде при 20 o С Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  Теория |









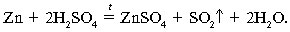
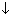 + Na2SO4.
+ Na2SO4.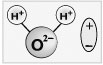
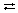 ». Например, для H2SO4 и ее кислой соли NaHSO4:
». Например, для H2SO4 и ее кислой соли NaHSO4: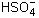 ,
,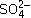 ;
;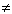 нет диссоциации,
нет диссоциации,
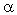 ). Величина
). Величина 















