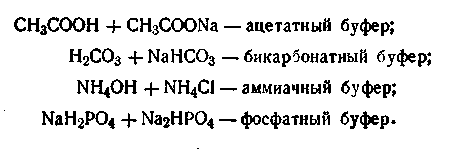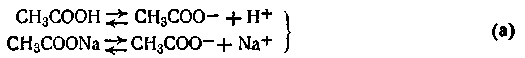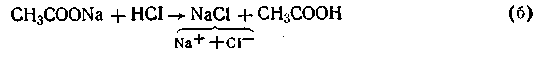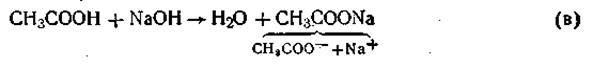ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10 КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК


Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47, 48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3/2004
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

§ 7.2. Слабые кислоты и основания
Если вы будете заниматься исследовательской работой, вам понадобится знание среды раствора и его рН. Сейчас вы познакомитесь с растворами слабых электролитов, узнаете, как рассчитать рН раствора, зная концентрацию соли и константу равновесия диссоциации слабого электролита.
Расчет концентрации ионов водорода и гидроксид-ионов в растворах слабых кислот и слабых оснований несколько сложнее, чем расчет для сильных кислот и оснований (щелочей), и проводится с использованием констант их диссоциации.
Уксусная кислота – слабый электролит и в очень незначительной степени диссоциирует по уравнению:
Константа диссоциации (равновесия) К уксусной кислоты:
Учитывая, что в растворе уксусной кислоты концентрации ионов водорода и ацетат-ионов равны, т.е. [СН3СОО – ] = [Н + ], а сама она – слабый электролит и поэтому в состоянии диссоциации находится лишь малая часть ее молекул, концентрацию непродиссоциировавших молекул СН3СООН можно считать равной концентрации кислоты скисл. Тогда получаем:
Пример. Константа диссоциации уксусной кислоты (данные справочника) равна:
Ккисл = 1,86•10 –5 . Требуется рассчитать концентрацию ионов водорода и рН в 0,1М и 0,01М растворах уксусной кислоты.
Для 0,1М раствора имеем:
рН = –lg (1,36•10 –3 ) = 2,87.
Посмотрим, как скажется на концентрации ионов водорода и рН раствора разбавление в 10 раз.
Для 0,01М раствора имеем:
рН = –lg (4,31•10 –4 ) = 3,37.
Разбавление уксусной кислоты в 10 раз привело к понижению концентрации ионов водорода в 1,36•10 –3 /4,31•10 –4 = 3,1 раза, при этом рН повысился на 3,37 – 2,87 = 0,5 единицы рН.
Вспомните, как изменится концентрация ионов водорода и рН при разбавлении в 10 раз 0,1М раствора соляной кислоты.
Аналогично определяют концентрацию ионов водорода и рН раствора гидроксида аммония:
NH4OH = 
константа диссоциации которого равна Косн = 1,79•10 –5 . Сначала рассчитывают концентрацию гидроксид-ионов:
и рОН. затем – концентрацию ионов водорода:
и определяют рН = 14 – рОН. В 0,01М растворе гидроксида аммония рН = 10,6. Проверьте.
Если в растворе сильной кислоты или сильного основания увеличить концентрацию одноименного иона введением соответствующей соли, например в раствор НСl или NаОН добавить хлорид натрия NаCl, то концентрации ионов водорода или гидроксид-ионов практически не изменяются. Если же такую операцию, т. е. увеличение концентрации одноименного иона, провести с раствором слабой кислоты или слабого основания, то наблюдается резкое изменение рН раствора.
Рассмотрим, как изменится рН раствора уксусной кислоты при введении в раствор ацетата натрия NаСН3СОО, т. е. одноименного ацетат-иона СН3СОО – .
Согласно принципу Ле Шателье равновесие реакции диссоциации
сместится влево в результате увеличения концентрации ацетат-ионов СН3СОО – , образующихся при полной диссоциации ацетата натрия как сильного электролита. Такое смещение равновесия диссоциации уксусной кислоты означает уменьшение концентрации ионов водорода, т. е. увеличение рН раствора.
Пример. Рассчитать рН 0,01М раствора уксусной кислоты, содержащей 0,01 моль/л ацетата натрия NаСН3СОО.
В выражении константы равновесия
концентрация ацетат-ионов определяется в основном концентрацией хорошо диссоциирующей соли NаСН3СОО. Поэтому можно записать:
Из этого соотношения находим концентрацию ионов водорода:
Таким образом, в результате введения в 1 л 0,01М раствора уксусной кислоты 0,01 моль
NаСН3СОО концентрация ионов водорода уменьшилась в 23 раза (4,31•10 –4 /1,86•10 –5 = 23), а значение рН возросло на 1,36 (4,73 – 3,37 = 1,36) единицы (значение рН = 3,37 из предыдущего примера).
Аналогично при введении в раствор слабого основания NН4ОН хлорида аммония NH4Cl положение равновесия диссоциации гидроксида аммония смещается в менее основную область и среда раствора становится более кислотной:
Следовательно, одноименный ион (за исключением иона водорода и гидроксид-иона), введенный в раствор слабой кислоты или слабого основания, изменяет рН таким образом, что среда раствора приближается к нейтральной. Одноименные ионы в такого типа системах ведут себя как нейтрализующие агенты: анион нейтрализует слабую кислоту, выполняя роль основания, а катион нейтрализует слабое основание, выполняя роль кислоты. Такое необычное, с нашей точки зрения, поведение веществ характерно для многих явлений природы, показывая нам всеобщую связь и взаимозависимость объектов окружающего нас мира и нас самих от него.
Видео:Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать

Please wait.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Гидролиз ацетата натрияСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2ce7480dcffaa4 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Лабораторная работа №16. Свойства уксусной кислоты. 9 класс.Скачать

Буферные растворы и буферное действие.
Как показывает опыт, разбавленные растворы сильных кислот и оснований, обладающие слабокислой или слабощелочной реакцией, характеризуются непостоянством рН. Однако смесь, например, уксусной кислоты и ее соли CH3COONa обладает способностью сохранять постоянство рН. Можно к этой смеси добавить небольшое количество кислоты или щелочи, а также разбавить ее, но рН раствора при этом почти не изменится. Свойство растворов сохранять определенное значение рН называется буферным действием. Растворы, обладающие буферным действием, получили название буферных растворов или буферных смесей.
Буферные растворы по своему составу бывают в основном двух типов. Они могут состоять из слабой кислоты и ее гидролитически щелочной соли и слабого основания и гидролитически кислой соли этого основания.
В качестве иллюстрации можно привести следующие буферные смеси:
Последний буфер, как видим, состоит из смеси двух солей, одна из которых — однозамещенная, вторая — двухзамещенная соль фосфорной кислоты. Причем первая соль (NaH2PO4) играет роль слабой кислоты. Буферным действием могут обладать растворы, состоящие из анионов разных слабых кислот, такие, как фосфатцитратный буфер Na2НРО4 + СбН8О7.
Сущность буферного действия смеси слабой кислоты с ее солью можно рассмотреть на примере ацетатного буферного раствора. В этом растворе происходят следующие реакции электролитической диссоциации:
Поскольку степень диссоциации кислоты очень мала, в растворе преобладают ее недиссоциированные молекулы. Ацетат натрия, являясь сильным электролитом, диссоциирует полностью на ионы СН3СОО — и ионы Na + . Таким образом, в ацетатной буферной смеси присутствие в большом количестве анионов СН3СОО — смещает равновесие при диссоциации уксусной кислоты в сторону образования ее молекул. Причем диссоциация уксусной кислоты может быть настолько подавленной, что кислоту можно считать практически недиссоциированной. В результате этого активная кислотность смеси очень мала. Добавление кислоты или щелочи к ацетатной смеси не вызывает существенного изменения концентрации водородных ионов в растворе. Так, при добавлении соляной кислоты к ацетатному буферу происходит реакция обменного разложения с одним из компонентов смеси (CH3COONa):
Как видим, сильная кислота в результате этой реакции заменяется эквивалентным количеством слабой кислоты. В соответствии с законом разбавления Оствальда увеличение концентрации уксусной кислоты понижает степень ее диссоциации, в результате чего концентрация ионов водорода в буферном растворе увеличивается очень незначительно.
Так же незначительно изменяется рН буферного раствора при добавлении к нему небольшого количества щелочи. При этом щелочь реагирует с уксусной кислотой (реакция нейтрализации), в результате чего гидроксид-ионы связываются с ионами водорода с образованием молекул воды:
В конечном итоге этой реакции добавляемая
щелочь заменяется эквивалентным количеством слабоосновной соли, которая влияет на реакцию среды в значительной меньшей степени, чем NaOH. Поскольку в результате этой реакции уксусная кислота расходуется, можно было бы ожидать значительного снижения содержания ионов Н + . Однако вместо прореагировавших ионов кислоты Н+ и СН3СОО — за счет потенциальной кислотности образуются новые ионы Н + и СН3СОО — , и активная кислотность смеси (рН) почти не изменяется.
Как показывает опыт, каждая из буферных смесей характеризуется определенной концентрацией водородных ионов, которую буферная система стремится сохранить при добавлении к ней кислоты или щелочи. Рассмотрим на примере ацетатной буферной смеси, что же определяет ее рН.
В соответствии с законом действующих масс константа диссоциации уксусной кислоты
 | 4.75 |
Это равенство справедливо для раствора, в котором содержится только одна уксусная кислота. Как уже отмечалось, добавление к раствору уксусной кислоты ацетата натрия подавляет ее диссоциацию, в результате чего концентрацию молекул недиссоциированной СН3СООН можно без больших погрешностей принять равной общей концентрации кислоты, т. е.
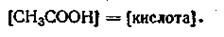 | 4.76 |
Учитывая, что соль CH3COONa как сильный электролит в водном растворе диссоциирована полностью, можно принять, что общая концентрация аниона СН3СОО — практически равна аналитической концентрации соли в данной буферной смеси, т. е.
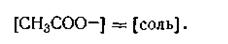 | 4.77 |
Подставляя значения (4.76) и (4.77) в уравнение константы диссоциации (4.75), получим
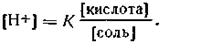 | 4.78 |
Логарифмируя это выражение и меняя знаки, запишем:
—lg[H + ] = — lg K + lg[соль]—lg [кислота] или
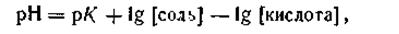 | 4.79 |
где рК— отрицательный логарифм константы диссоциации уксусной кислоты.
Отметим, что уравнение (4.79) справедливо и для буферных растворов, состоящих из смеси слабого основания и гидролитически кислой соли. В этом случае уравнение будет иметь вид
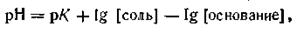 | 4.80 |
где рК — отрицательный логарифм константы диссоциации слабого основания. Из приведенных уравнений следует, что рН буферного раствора зависит от величины константы диссоциации слабой кислоты или слабого основания, а также от соотношения концентраций компонентов буферных смесей.
Для приготовления буферных смесей с желаемым значением рН необходимо взять слабые кислоты или основания с соответствующими значениями констант диссоциации, а также подбирать определенные соотношения компонентов.
На практике обычно пользуются готовыми таблицами, в которых указано, в каких отношениях должны быть взяты компоненты буферных смесей для получения буферных растворов с желаемым значением рН.
Поскольку константа электролитической диссоциации К при данных условиях постоянна, рН буферного раствора будет зависеть только от отношения концентраций кислоты (или основания) и соли, взятых для приготовления буферной смеси, и не зависит от абсолютного значения этих концентраций. Поэтому при разбавлении буферных растворов концентрация водородных ионов (рН) должна оставаться неизменной. Опыт показывает, что даже значительное разбавление буферных растворов в 10—20 раз и более мало отражается на их рН.
Способность буферных растворов противодействовать резкому изменению рН при прибавлении к ним кислоты или щелочи является ограниченной. Буферная смесь поддерживает рН постоянным только при условии, что количество прибавляемых к раствору сильной кислоты или щелочи не превышает определенной величины. Превышение этого количества вызывает резкое изменение рН, т. е. буферное действие раствора прекращается.
Предел, в котором проявляется буферное действие, называется буферной емкостью. Буферную емкость выражают количеством вещества эквивалента сильной кислоты или основания, которое следует добавить к 1 м 3 буферного раствора, чтобы сместить рН на единицу, т. е.
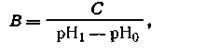 | 4.81 |
где В — буферная емкость, С — количество сильной кислоты или основания, кмоль; рН0— водородный показатель до добавления сильной кислоты или основания; pH1 — водородный показатель после добавления кислоты или щелочи.
Величина буферной емкости зависит от концентрации компонентов буферной смеси и отношения между этими концентрациями.
Зная сущность механизма действия буферных систем, нетрудно догадаться, что наибольшей буферной емкостью обладают растворы, содержащие большие концентрации входящих в состав буфера компонентов, и растворы, составленные из компонентов, взятых в равных количествах. Влияние величины соотношения компонентов буферных смесей на их емкость связано с тем, что при равных величинах числителя и знаменателя величина дроби наиболее устойчива к изменению своего числового значения. Поэтому и величина соотношения компонентов, входящих в состав буфера, будет меньше подвержена изменениям.
Таким образом, буферные растворы обладают следующими свойствами:
1) концентрация водородных ионов буферных смесей мало зависит от разбавления;
2) добавление к буферным смесям небольших количеств (в пределах буферной емкости растворов) кислоты или щелочи мало изменяет рН;
3) величина буферной емкости зависит от концентрации компонентов буферной смеси и от отношения между этими компонентами.
📺 Видео
Получение ЛЕДЯНОЙ УКСУСНОЙ кислоты!Скачать

"Горячий лёд" - эксперимент и получение ацетата натрия!Скачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Взаимодействие уксусной кислоты с гидроксидом натрияСкачать

Гидролиз ацетата натрияСкачать

Практическая работа.Получение и свойства уксусной кислоты.Скачать

Получение уксусной кислоты (реакция ацетата натрия и серной кислоты)Скачать

Получение ацетата натрия двумя способами. Наблюдение разного теплового эффектаСкачать

Расчет рН растворов сильных и слабых кислот. Химия для поступающих.Скачать

Уравнение Гендерсона-Хассельбаха в решении задачиСкачать

Получение ацетата натрия и доказательство его антибактериального свойстваСкачать

Вся теория по карбоновым кислотам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

Ацетаты (соли уксусной кислоты)Скачать

✅ Бомбический эксперимент ГОРЯЧИЙ ЛЕД!!! Как сделать ацетат натрия своими руками ✅Скачать