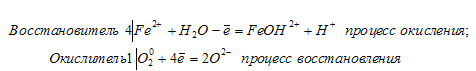Запишите уравнения диссоциации: сульфата железа (III), карбоната калия, фосфата аммония, нитрата меди (II), гидроксида бария, соляной кислоты, гидроксида калия, хлорида железа (II). Дайте названия ионов.
`Fe_2(SO_4)_3 ⟶ underset(«катион железа (III)»)(2Fe^(3+)) + underset(«сульфат-анион»)(3SO_4^(2-))`
`K_2CO_3 ⟶ underset(«катион калия»)(2K^+) + underset(«карбонат-анион»)(CO_3^(2-))`
`(NH_4)_3PO_4 ⟶ underset(«катион аммония»)(3NH_4^+) + underset(«фосфат-анион»)(PO_4^(3-))`
`Cu(NO_3)_2 ⟶ underset(«катион меди (II)»)(Cu^(2+)) + underset(«нитрат-анион»)(2NO_3^-)`
`Ba(OH)_2 ⟶ underset(«катион «)(Ba^(2+)) + underset(«гидроксид-анион»)(2OH^-)`
`HCl ⟶ underset(«катион водорода»)(H^+) + underset(«хлорид-анион»)(Cl^-)`
`KOH ⟶ underset(«катион калия»)(K^+) + underset(«гидроксид-анион»)(OH^-)`
`FeCl_2 ⟶ underset(«катион железа (II)»)(Fe^(2+)) + underset(«хлорид-анион»)(2Cl^-)`
Видео:32 задание. Железо, сульфид меди и азотная кислотаСкачать

Получение сульфида железа (III) и окисление сульфата железа (II)
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Способ получения сульфида железа (III)
Задача 1123.
Можно ли получить сульфид железа (III) взаимодействием: а) растворов FeCl3 и Н2S; б) растворов Fe(NO3)2 и (NH4)2S? Ответ обосновать.
Решение:
а) 2FeCl3 + 3H2S → Fe2S3↓ + 6HCl
Реакция идет до конца, равновесие смещается в сторону образования продуктов, так. как. выпадает осадок Fe2S3, значит данную реакцию можно использовать для получения сульфида железа (III).
При сливании растворов Fe 2+ и сульфида аммония образуется осадок FeS, поэтому эту реакцию можно использовать для получения сульфида железа (II), а никак для сульфид железа (III).
Окисление сульфата железа (II) кислородом
Задача 1124.
В водном растворе сульфат железа (II) окисляется растворенным в воде кислородом с образованием основной соли. Написать уравнение протекающей при этом реакции.
Решение:
4FeSO4 + O2 + 2H2O = 4FeOHSO4
4Fe 2+ + 2H2O + O2 = 4FeOH 2+ (ионно-молекулярная форма после приведения членов в равенстве).
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидроксид железа (III)
Гидроксид железа (III)
Способы получения
1. Гидроксид железа (III) можно получить действием раствора аммиака на соли железа (III).
Например , хлорид железа (III) реагирует с водным раствором аммиака с образованием гидроксида железа (III) и хлорида аммония:
2. Окислением гидроксида железа (II) кислородом или пероксидом водорода:
3. Гидроксид железа (III) можно получить действием щелочи на раствор соли железа (III).
Например , хлорид железа (III) реагирует с раствором гидроксида калия с образованием гидроксида железа (III) и хлорида калия:
FeCl3 + 3KOH → Fe(OH)3↓ + 3KCl
Видеоопыт получения гидроксида железа (III) взаимодействием хлорида железа (III) и гидроксида калия можно посмотреть здесь.
4. Также гидроксид железа (III) образуется при взаимодействии растворимых солей железа (III) с растворами карбонатов и сульфитов . Карбонаты и сульфиты железа (III) необратимо гидролизуются в водном растворе.
Например: бромид железа (III) реагирует с карбонатом натрия. При этом выпадает осадок гидроксида железа (III), выделяется углекислый газ и образуется бромид натрия:
Но есть исключение ! Взаимодействие солей железа (III) с сульфитами в ЕГЭ по химии — окислительно-восстановительная реакция. Соединения железа (III) окисляют сульфиты, а также сульфиды и иодиды.
Взаимодействие хлорида железа (III) с сульфитом, например, калия — очень интересная реакция. Во-первых, в некоторых источниках указывается, что в ней таки может протекать необратимый гидролиз. Но для ЕГЭ лучше считать, что при этом протекает ОВР. Во-вторых, ОВР можно записать в разных видах:
Также допустима такая запись:
Химические свойства
1. Гидроксид железа (III) проявляет слабовыраженные амфотерные свойства, с преобладанием основных. Как основание, гидроксид железа (III) реагирует с растворимыми кислотами .
Например , гидроксид железа (III) взаимодействует с азотной кислотой с образованием нитрата железа (III):
2. Гидроксид железа (III) взаимодействует с кислотными оксидами сильных кислот .
Например , гидроксид железа (III) взаимодействует с оксидом серы (VI) с образованием сульфата железа (III):
3. Гидроксид железа (III) взаимодействует с растворимыми основаниями (щелочами). При этом в расплаве образуются соли—ферриты, а в растворе реакция практически не идет. При этом гидроксид железа (III) проявляет кислотные свойства.
Например , гидроксид железа (III) взаимодействует с гидроксидом калия в расплаве с образованием феррита калия и воды:
4. Г идроксид железа (III) разлагается при нагревании :
Видеоопыт взаимодействия гидроксида железа (III) с соляной кислотой можно посмотреть здесь.
🔥 Видео
Электролитическая диссоциация / Диссоциация солейСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Решение и анализ реальной 34-й задачи ЕГЭ по химии 2020 (смесь сульфата железа (II) и (III))Скачать

Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

Теория электролитической диссоциацииСкачать

Сокращённое ионное уравнениеСкачать

Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ЕГЭ 2011 по химии. Демо. А24. Электролитическая диссоциацияСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Изучение свойств солей. | Практическая работа № 2. Опыт 3.Скачать

Тесты по химии. Диссоциация электролитовСкачать

Диссоциация солей.Скачать

ОГЭ 2022 / Задание 13Скачать

9 класс. ОГЭ. Химия. Задание 13.Скачать