Задача 1072.
Почему оксиды свинца Рb2O3 и Рb3O4 называют смешанными? Указать степени окисленности свинца в этих соединениях.
Решение:
Известны два смешанных оксида свинца Рb2O3 и Рb3O4. Их можно рассматривать как соединения оксидов свинца (II) и (III): PbO . PbO2 (Рb2O3) и 2PbO . PbO2 (Рb3O4). Первый является свинцовой солью метасвинцовой кислоты (H2PbO2), а второй – ортосвинцовой кислоты (H4PbO4). Структура обоих промежуточных окислов свинца может быть обоснована результатами их взаимодействия с разбавленной азотной кислотой. Например, из сурика 70% всего свинца растворяются, переходя в Pb(NO3)2, а 30% остаётся в виде PbO2. Этим доказывается наличие в молекуле Pb3O4 двух атомов двухвалентного свинца и одного – четырёхвалентного. Аналогично можно обосновать и структуру Рb2O3. Получают как закись свинца, так и сурик могут быть получены смешиванием растворов Pb(OH)2 и Pb(OH)4 с щёлочью. В присутствии небольших концентраций щёлочи выпадает закись-окись (в виде кристаллогидрата Рb2O3 . 3Н2О), а при её больших концентрациях – сурик. Сурик Рb3O4 – вещество ярко-красного цвета, на основе которого изготовляют краску, применяемую для защиты металлических конструкций от коррозии (замазка для придания стыкам труб газо- и водонепроницаемости).
- Гидролиз хлорида олова
- Гидролиз хлорида олова (II)
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора хлорида олова (II)
- Хлорид олова (SnCl2) свойства, структура, использование и риски
- Физико-химические свойства
- Конфигурация Валенсии
- реактивность
- Восстановительная активность
- Химическая структура
- приложений
- риски
- 📹 Видео
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз хлорида олова
Задача 1073.
Почему при приготовлении раствора SnCl2 воду подкисляют соляной кислотой?
Решение:
При приготовлении раствора SnCl2 происходит гидролиз соли по катиону по первой ступени с образованием основной соли и соляной кислоты:
Sn 2+ + Н2О ⇔ SnOH + + H + (гидролиз соли по 1-й ступени);
SnCl2 + H2O ⇔ SnOHCl + HCl (молекулярная форма гидролиза).
Поэтому для того чтобы сместить равновесие влево, в сторону предотвращения гидролиза в раствор соли необходимо добавить соляную кислоту (подкисляют воду соляной кислотой). Таким образом, при подкислении воды, идущей на приготовление раствора хлорида олова, соляной кислотой происходит замедление гидролиза соли согласно принципу Ле Шателье, равновесие системы сместится в сторону уменьшения концентрации HCl, т. е. гидролиз соли будет подавлен, значит, соль будет долго храниться.
Видео:Электролиз. 10 класс.Скачать

Гидролиз хлорида олова (II)
SnCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
SnCl2 + HOH ⇄ SnOHCl + HCl
Полное ионное уравнение
Sn 2+ + 2Cl — + HOH ⇄ SnOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Sn 2+ + HOH ⇄ SnOH + + H +
Видео:Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
SnOHCl + HOH ⇄ Sn(OH)2 + HCl
Полное ионное уравнение
SnOH + + Cl — + HOH ⇄ Sn(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
SnOH + + HOH ⇄ Sn(OH)2 + H +
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Среда и pH раствора хлорида олова (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Хлорид олова (SnCl2) свойства, структура, использование и риски
хлорид олова (II) или хлорид олова, химической формулы SnCl2, представляет собой белое кристаллическое твердое соединение, продукт реакции олова и концентрированного раствора соляной кислоты: Sn (s) + 2HCl (конц) => SnCl2(вод) + H2(G). Процесс его синтеза (приготовления) состоит из добавления кусочков оловянных опилок для взаимодействия с кислотой.
После добавления кусочков олова происходит дегидратация и кристаллизация до тех пор, пока не будет получена неорганическая соль. В этом соединении олово потеряло два электрона из его валентной оболочки, чтобы сформировать связи с атомами хлора.
Это может быть лучше понято, если учесть валентную конфигурацию олова (5 с 2 5pх 2 ри 0 рZ 0 ), из которых пара электронов занимает орбиталь рх дается протонам H + , для того, чтобы сформировать двухатомную молекулу водорода. То есть это реакция окислительно-восстановительного типа.
- 1 Физико-химические свойства
- 1.1 Конфигурация Валенсии
- 1.2 Реакционная способность
- 1.3 Восстановительная активность
- 2 Химическая структура
- 3 использования
- 4 риска
- 5 ссылок
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Физико-химические свойства
Ссылки SnCl2 Они ионные или ковалентные? Физические свойства хлорида олова (II) исключают первый вариант. Точки плавления и кипения для этого соединения составляют 247 ° C и 623 ° C, что свидетельствует о слабых межмолекулярных взаимодействиях, что является распространенным фактом для ковалентных соединений..
Его кристаллы белого цвета, что приводит к нулевому поглощению в видимом спектре.
Конфигурация Валенсии
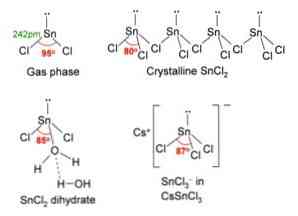
На изображении выше, в верхнем левом углу, показана изолированная молекула SnCl2.
Молекулярная геометрия должна быть плоской, потому что гибридизация центрального атома является sp 2 (3 орбитальных зр 2 и чистой орбитали для образования ковалентных связей), но свободная пара электронов занимает объем и отталкивает атомы хлора вниз, придавая молекуле угловую геометрию.
В газовой фазе это соединение изолировано, поэтому оно не взаимодействует с другими молекулами.
Как потеря пары электронов на орбите рх, олово превращается в ион Sn 2+ и его итоговая электронная конфигурация составляет 5 с 2 5pх 0 ри 0 рZ 0 , со всеми его p-орбиталями, доступными для приема ссылок от других видов.
Ионы Cl — координировать с ионом Sn 2+ дать хлорид олова. Электронная конфигурация олова в этой соли составляет 5 с 2 5pх 2 ри 2 рZ 0 , возможность принять другую пару электронов в своей свободной орбитальной рZ.
Например, вы можете принять другой ион Cl — , образующий комплекс геометрии треугольной плоскости (пирамида с треугольным основанием) и отрицательно заряженный [SnCl3] — .
реактивность
SnCl2 имеет высокую реакционную способность и склонность вести себя как кислота Льюиса (электронный рецептор), чтобы завершить свой валентный октет.
Так же, как он принимает ион Cl — , то же самое происходит с водой, которая «гидратирует» атом олова, связывая молекулу воды непосредственно с оловом, и вторая молекула воды образует взаимодействия водородных связей с первым.
Результатом этого является то, что SnCl2 это не чисто, но согласовано с водой в его дигидратированной соли: SnCl2· 2Н2О.
SnCl2 Он очень растворим в воде и в полярных растворителях, потому что это полярное соединение. Однако его растворимость в воде, меньшая, чем его массовый вес, активирует реакцию гидролиза (разрыв молекулы воды) с образованием основной и нерастворимой соли:
SnCl2(вод) + H2O (l) Sn (OH) Cl (s) + HCl (водн.)
Двойная стрелка указывает на то, что установлено равновесие, благоприятное для левой стороны (по отношению к реагентам), если концентрации HCl увеличиваются. Для этого растворы SnCl2 используемый имеет кислотный рН, чтобы избежать осаждения нежелательного солевого продукта гидролиза.
Восстановительная активность
Реагирует с кислородом в воздухе с образованием хлорида олова (IV) или хлорида олова:
В этой реакции олово окисляется, образуя связь с электроотрицательным атомом кислорода и увеличивает количество связей с атомами хлора..
В целом, электроотрицательные атомы галогенов (F, Cl, Br и I) стабилизируют связи соединений Sn (IV), и этот факт объясняет, почему SnCl2 это восстановитель.
Когда он окисляется и теряет все свои валентные электроны, ион Sn 4+ это остается с конфигурацией 5s 0 5pх 0 ри 0 рZ 0 , будучи парой электронов в орбитальных 5-ых, наиболее трудно быть «схваченным».
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Химическая структура
Видео:Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

SnCl2 представлена кристаллическая структура орторомбического типа, похожая на ряды пил, в которых кончики зубов представляют собой хлориды.
Каждый ряд представляет собой цепь SnCl3 образуя мостик Cl с другим атомом Sn (Cl-Sn (Cl)2-Cl- ···), как видно на изображении выше. Две цепи, связанные слабыми взаимодействиями типа Sn-Cl, составляют один слой расположения, который накладывается на другой слой и так далее, пока не будет определено кристаллическое твердое вещество..
Свободная электронная пара 5s 2 вызывает искажения в структуре, потому что он занимает объем (объем электронного облака).
Sn может иметь координационное число, равное девяти, то же самое, что иметь девять соседей, рисуя тригональную призму с этим, расположенным в центре геометрической фигуры, и Cl в вершинах, в дополнение к другим Cl, расположенным в каждом квадратных граней призмы.
Это легче заметить, если рассмотреть цепь, в которой Sn (темно-серые сферы) направлены вверх, а три Cl, связанные с ней, образуют треугольный пол, а три верхних Cls образуют треугольную крышу..
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

приложений
В органическом синтезе он используется в качестве восстановителя для ароматических нитросоединений (Ar-NO2 à Ar-NH2). Поскольку его химическая структура является ламинарной, он находит применение в мире катализа органических реакций, помимо того, что является потенциальным кандидатом на каталитическую поддержку.
Его восстановительное свойство используется для определения присутствия соединений золота, для покрытия стекол серебряными зеркалами и для действия в качестве антиоксиданта..
Также в своей молекулярной геометрии тригональная пирамида (: SnX3 — M + ) используется в качестве основы Льюиса для синтеза большого количества соединений (таких как кластерный комплекс Pt)3Sn8Cl20, где безэлектронная пара координируется с кислотой Льюиса).
Видео:Химия 11 класс Теория электролитической диссоциацииСкачать

риски
SnCl2 Это может повредить лейкоциты. Он вызывает коррозию, раздражение, канцерогенность и оказывает сильное негативное воздействие на виды, обитающие в морских экосистемах..
Он может разлагаться при высоких температурах, выделяя вредный газообразный хлор. При контакте с высокоокислительными агентами вызывает взрывные реакции.
📹 Видео
Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Механизм электролитической диссоциации. 9 класс.Скачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Металлы. Тема 39. Электролиз расплавов солей. Видеоопыт «Электролиз раствора хлорида меди»Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Химия / 9 класс / ЭлектролизСкачать

Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Химия | ГидролизСкачать

Соли как электролиты. Видеоурок 7. Часть 2. Химия 8 классСкачать