Материалы портала onx.distant.ru
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
- Состав комплексных соединений
- Номенклатура комплексных соединений
- Реакции образования комплексных соединений
- Реакции разрушения комплексных соединений
- Диссоциация комплексных соединений
- Задачи для самостоятельного решения
- Диссоциация комплексных соединений
- Электролитическая диссоциация комплексных соединений
- 📸 Видео
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Состав комплексных соединений
Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами . Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F — — фторо, Cl — -хлоро, ОН — — гидроксо, CN — — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование комплексных солей.
Если комплексообразователем является Fe 2+ или Fe 3+ , то координационные числа в обоих случаях равны шести:
Координационные числа ртути и меди, как правило, равны четырем:
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
- образования малорастворимого соединения с комплексообразователем:
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
Видео:ch0510 Основные положения теории электролитической диссоциацииСкачать

Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например , в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
Для комплексного иона [Ni(NH3)6] 2+ , диссоциирующего по уравнению
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni 2+ ]·[NH3] 6 / [[Ni(NH3)6] 2+ ] (1)
Величина, обратная Кн, называется константой устойчивости:
Она представляет собой константу равновесия процесса образования комплексного иона:
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGT о = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3 — в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag + в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2] + = 5,7× 10 — 8 при 298 К.
3) Величину ΔG o 298 процесса диссоциации комплексного иона.
[NO3 — ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag + и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2] + составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,
Следовательно, [Ag + ] = 1,43× 10 — 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2] + уравнением:
Значит, при Т = 298 К получаем:
ΔG о 298 = — 8,314× 298× ln5,7× 10 — 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10 — 10 , Кн.[Ag(NH3)2] + = 5,7× 10 — 8 .
Решение. Осадок выпадет при условии: [Ag + ][Сl — ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag + и Сl — в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10 -3 , 1 и 0,25 М соответственно.
Найдем концентрацию [Ag + ] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10 — 10 .
Значит, [Ag + ] = 2,85× 10 — 10 моль/л, а [Сl — ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag + ][Сl — ] = 2,85× 10 — 10 × 0,25 = 7,1× 10 — 11 (моль/л) 2 .
Поскольку [Ag + ][Сl — ] = 7,1× 10 — 11 — 10 , то осадок не выпадет.
Задача 3. При какой концентрации ионов S 2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10 — 27 , Кн[Cd(CN)4] 2- = 7,8× 10 — 18 .
Решение. Осадок выпадет при условии: [Cd 2+ ][S 2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd 2+ и S 2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S 2- ] > ПР(CdS):[Cd 2+ ].
Комплексный ион диссоциирует незначительно:
[Cd(CN)4] 2- → Cd 2+ + 4CN —
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd 2+ и 4x моль/л ионов CN — . Суммарная концентрация ионов CN — равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4] 2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4] 2- = [Cd 2+ ] · [CN — ] 4 / [[Cd(CN)4] 2- ]
Следовательно, [Cd 2+ ] = 1,8·10 — 12 моль/л.
Выпадение осадка начнется при [S 2- ] > 7,9·10 — 27 : 1,8·10 — 12 > 4,39·10 — 15 моль/л.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия;
2. Назовите следующие комплексные соединения
[Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II).
3. Составьте уравнение химической реакции:
4. Составьте уравнение химической реакции:
5 . Составьте уравнение химической реакции:
6. Составьте уравнение химической реакции:
7. Составьте уравнение химической реакции:
Видео:Механизм электролитической диссоциации. 9 класс.Скачать

Диссоциация комплексных соединений
Комплексные соединения, имеющие внешнюю сферу являются сильными электролитами. В водных растворах они диссоциируют нацело на внутреннюю и внешнюю сферу:
Внутренняя сфера (комплексный ион) диссоциирует по типу слабого электролита – ничтожно мало, т.е. ступенчато и обратимо:
Прочность комплексного иона оценивается значением его константы диссоциации, которая называется константой нестойкости (Кн).Чем меньше Кн, тем прочнее комплекс.


[ ] – равновесные концентрации частиц.
В справочной литературе приводится также обратная величина константы нестойкости, которая называется константой устойчивости комплекса.
Окислительно-восстановительные реакции с участием комплексных соединений
Некоторые малоактивные металлы растворяются в смеси кислот (HNO3 + HF , HNO3 + HCl). Просессы протекают с образованием комплексных соединений.
Правила написания уравнений химических реакций с участием комплексных соединений
При составлении окислительно-восстановительных реакций с участием комплексных соединений в электронно-ионных схемах записываются полные формулы комплексных ионов.
Red Ox Источник


3Nb + 21HF + 5NO3 – + 20H + = 3[NbF7] 2– + 21H + + 5NO + 10H2O
Разрушение комплексных ионов
Для того чтобы разрушить комплексный ион, нужно добавить вещество, которое свяжет либо лиганд, либо ион-комплексообразователь в более прочное соединение (осадок или другое комплексное соединение).
· Связывание центрального иона-комплексообразователя:
[Cd (CN)4] 2– + S 2– = CdS↓ + 4CN – ;
Если добавить H + , то можно связать лиганд в более прочный ион NH4 + : Кн [Ag (NH3)2] + =5,8 .10 -8 ; Кн NH4+ = 5,4* 10 -10
ЗАДАНИЯ К РАЗДЕЛУ 1
Задание 1. Составьте формулы комплексных соединений из заданных ионов. Напишите уравнения их диссоциации и выражение для константы нестойкости Kн.
| № варианта | Ионы | к.ч. | № варианта | Ионы | к.ч. |
| Cu 2+ , H2O, Cl – | Cl – , Fe 2+ , H2O | ||||
| Fe 2+ , K + , CN – | Pt 4+ , Cl – , H + | ||||
| Fe 3 + , K + , CN – | Al 3+ , OH – , K + | ||||
| ZrO 2+ , H2O, NO3 – | TiO 2+ , Cl – , H2O | ||||
| Sn 2+ , OH – , K + | Be 2+ , OH – , Na + | ||||
| H + , F – , WO2 2+ | K + , Ag + , I – | ||||
| NH3, OH – , Co 2+ | H2O, Ni 2+ , Cl – | ||||
| SO4 2– , VO 2+ , H2O | Hg 2+ , CN – , Mg 2+ | ||||
| K + , Au 3+ , CN – | CNS – , K + , Au 3+ | ||||
| Br – , SO4 2– ,Cd 2+ | S2O3 2– , Ag +– , Na + | ||||
| Na + , CN – , Co 3+ | CN – , K + , Ag + | ||||
| SbO + , H2O, Cl – | K + , Sn 4+ , Cl – | ||||
| NO3 – , Co 3+ , NH3 | I – , Hg 2+ , K + | ||||
| OH – , Na + , Zn 2+ | Sr 2+ , Zn 2+ , OH – | ||||
| Co 2+ , NO3 – , H2O | F – , Ni 3+ , Na + |
Задание 2. Определите степень окисления иона комплексообразователя и класс комплексного соединения. Напишите реакцию получения комплекса из приведенных комплексных соединений (по одному из трех предложенных).
Видео:Механизм электролитической диссоциацииСкачать

Электролитическая диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы, т.е. как сильные электролиты (первичная диссоциация).
Пример 2.9. Первичная диссоциация комплексных соединений.
комплексная соль катионного типа:
комплексная соль анионного типа:
Комплексные частицы, или комплексы (молекулыили ионы), в свою очередь,диссоциируют лишь частично (aдис 2+ ⇄ [Cu(NH3)3] 2+ + NH3 ; (К1)
Прочность комплекса обычно характеризуют полной константой равновесия его диссоциации.Константа суммарной реакции диссоциации комплекса называется константой нестойкости КН. Она равна произведению констант диссоциации отдельных ступеней. Например, для суммарного уравнения для всех 4-х ступеней
константа нестойкости равна:
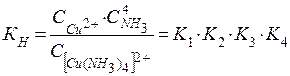
В общем виде для диссоциации комплекса [ MХn] Z :
[ MХ] Z ⇄ 
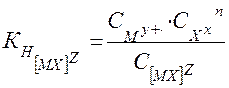
где z – заряд комплекса; n – заряд комплексообразователя; m – заряд лиганда.
Из приведенного уравнения легко определить концентрацию ионов комплексообразователя, образующихся при диссоциации комплекса, если принять, что активности ионов равны концентрациям, и в растворе нет избытка лигандов.
Чем меньше КН, тем прочнее комплекс.
Константа процесса, обратного диссоциации комплекса, т.е. процесса образования комплекса, называется константой устойчивости комплекса (Ку):
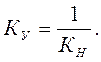
Чем больше значение Ку, тем устойчивее комплексная частица.
Значения констант нестойкости некоторых комплексных ионов приведены в табл.12.
Константы нестойкости комплексных ионов при 298 К
| Комплексный ион | КН | Комплексный ион | КН |
| [AgCl2] — | 1,76 ∙10 -5 | [Hg(NH3)4] 2+ | 5,3∙10 -20 |
| [Ag(NH3)2] + | 9,3∙10 -8 | [Co(NH3)4] 2+ | 2,8∙10 -6 |
| [ Ag(CN)2] — | 8∙10 -22 | [Fe(CN)6] 4- | 1,1∙10 -24 |
| [AgBr2] | 7,8∙ 10 -8 | [Fe(CN)6] 3- | 1∙10 -31 |
| [Cu(NH3)4] 2+ | 2,14∙10 -13 | [Zn(NH3 )4] 2+ | 3,46∙10 -10 |
| [Cu(CN)4] 2- | 9,6 ∙10 -29 | [Zn(OH)4] 2- | 3,6∙10 -16 |
| [Cd(NH3)4] 2 + | 7,56∙10 -8 | [Ni(NH3)4] 2 + | 1,12∙10 -8 |
| [Cd(CN)4] 2- | 1,41∙10 -19 | [Ni(CN)4] 2 — | 1,8∙10 -14 |
| [HgCl4] 2 — | 8,5∙10 -16 | [PbBr4] 2- | 1,1∙10 -3 |
| [Hg(NH3)4] 2 + | 5,4∙10 -20 | [CuCl4] 2 — | 6,4∙10 -6 |
| [HgBr4] 2 — | 1,1∙10 -21 | [CdI4] 2 — | 8,1∙10 -7 |
| [Hg(CN)4] 2- | 4,0∙10 -42 | [Co(NH3)6] 2 + | 7,8∙10 -6 |
| [HgI4] 2 — | 1,48∙10 -30 | [Co(NH3)6] 3+ | 7,1∙10 -36 |
Задача 2.2.Рассчитайте концентрацию ионов Ag + в 0,02 М растворе Na[Ag(CN)2] а) в отсутствии избытка лиганда; б) при наличии избытка ионов (СN) — при их концентрации в растворе NaCN 0,5 М.
а) Уравнение первичной диссоциации комплексной соли как сильного электролита:
Na[Ag(CN)2] 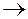
Уравнение суммарной диссоциации комплекса:
[Ag(CN)2] + ⇄ Ag + + 2 (CN ) — , а КН = 8∙10 -22 (см. табл.12).
Обозначим через x концентрацию Ag + . Тогда равновесная концентрация лиганда согласно уравнению равна 2 x, а равновесная концентрация недиссоциированного комплексного иона – (0,02 – х). Так как значение Кн очень мало, величиной х по сравнению с 0,02 можно пренебречь. С учетом этого запишем выражение для Кн:
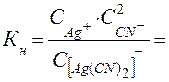

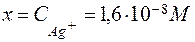
б) Концентрацию Ag + рассчитываем аналогично, но концентрацию лиганда (CN) — принимаем равной 0,5 М:
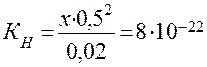
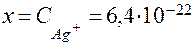
Таким образом, в 0,5 М растворе NaCN концентрация ионов Ag + почти на 14 порядков ниже, чем концентрация ионов [H + ] в воде.
Контрольное задание N 2
В соответствии с номером Вашего варианта и данными табл. 6 письменно ответьте на следующие вопросы.
Вопрос 1. Напишите уравнение первичной диссоциации комплексной соли ХY в водном растворе; укажите внутреннюю и внешнюю сферы.
Вопрос 2. Напишите уравнения ступенчатой диссоциации и суммарной диссоциации комплексной части соли XY.
Вопрос 3. Рассчитайте концентрацию ионов комплексообразователя в растворе соли XY c концентрацией СXY моль/л: а) в отсутствие избытка лиганда; б) при избытке лиганда с концентрацией 0,1 моль/л.
📸 Видео
Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

Химия 8 класс 34-35 неделя Электролитическая диссоциацияСкачать

Константа нестойкости и диссоциация комплексных соединенийСкачать

Комплексные соединения. 1 часть. 11 класс.Скачать

Растворы. Теория электролитической диссоциацииСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

72. Электролитическая диссоциацияСкачать

Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

Электролитическая диссоциацияСкачать

Теория электролитической диссоциацииСкачать

Свойства комплексных соединений. 11 класс.Скачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать


