напишите формулы соединений и приведите уравнения их диссоциации : гидрокарбонат кальция, хлорид дигидроксоалюминия, нитрат меди(I)
- Карина Кожуханова
- Химия 2019-01-25 18:48:30 9 1
В данном случае диссоциация неких веществ ступенчатая:
1) Ca(HCO3)2 = Ca[2+] + 2HCO3[-],
HCO3[-] = H[+] + CO3[2-]
2) Al(OH)2Cl = Al(OH)2[+] + Cl[-]
Al(OH)2[+] = AlOH[2+] + OH[-]
Al(OH)[2+] = Al[3+] + OH[-]
3) С uNO3 = Cu[1+] + NO3[-]
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Теория электролитической диссоциации
О чем эта статья:
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Что такое электролитическая диссоциация
Как известно, электрический ток — это направленное движение свободных электронов или ионов, т. е. заряженных частиц. В растворах электролитов, проводящих ток, за это отвечают свободные ионы.
В 1882 году шведский химик С. Аррениус при изучении свойств растворов электролитов обратил внимание, что они содержат больше частиц, чем было в сухом веществе. Например, в растворе хлорида натрия 2 моля частиц, а NaCl в сухом виде содержит лишь 1 моль.
Это позволило ученому сделать вывод, что при растворении таких веществ в воде в них появляются свободные ионы. Так были заложены основы теории электролитической диссоциации (ТЭД) — в химии она стала одним из важнейших открытий.
Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией.
Благодаря диссоциации растворы электролитов обретают способность проводить ток. Сванте Аррениус не смог объяснить, почему разные вещества сильно отличаются по электропроводности, но это сделал Д. И. Менделеев. Он подробно описал процесс распада электролита на ионы, который объясняется его взаимодействием с молекулами воды (или другого растворителя).
Схема электролитической диссоциации: KA ⇄ K + (катион) + A — (анион).
Уравнение диссоциации на примере хлорида натрия: NaCl ⇄ Na + + Cl — .
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Механизм электролитической диссоциации
При контакте с водой или другими растворителями диссоциации подвержены все вещества с ионной связью. Также распадаться на ионы могут вещества с ковалентной полярной связью, которая под действием воды переходит в ионную, а после разрушается.
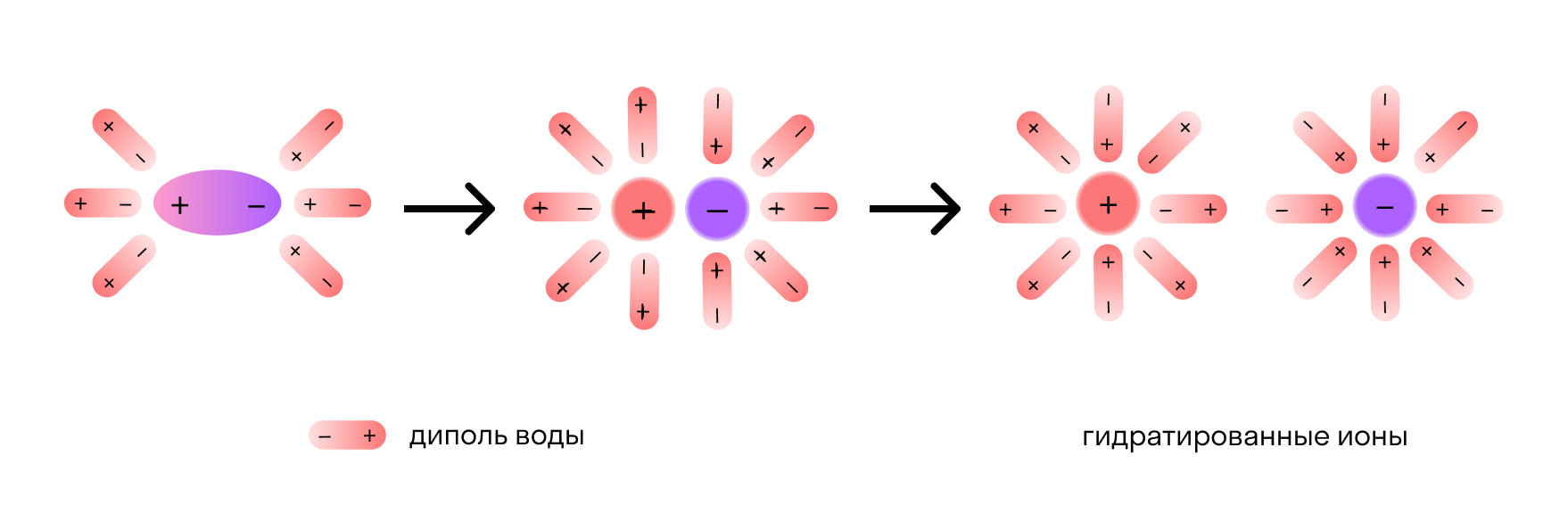
Механизм диссоциации электролитов удобно рассматривать на примере хлорида натрия NaCl. Его кристаллическая решетка образована катионами натрия Na + и анионами хлора Cl — , которые удерживаются вместе благодаря ионной связи. При растворении в воде каждый кристалл хлорида натрия окружают ее молекулы.
Отметим, что молекулы воды — это диполи. На одном конце они несут атомы водорода с частичным положительным зарядом, а на другом — атомы кислорода с частичным отрицательным. Соответственно, атомы кислорода притягиваются к катионам натрия, а атомы водорода — к анионам хлора. Эта сила электростатического притяжения ослабляет и в итоге разрывает ионную связь между натрием и хлором. Вещество диссоциирует на ионы.
После распада хлорида натрия образовавшиеся ионы Na + и Cl — окружают молекулы воды, создавая гидратную оболочку. Ионы с такой оболочкой называют гидратированными.
Если вместо воды был использован другой растворитель — например, этанол, его молекулы создают сольватную оболочку. В этом случае ионы называются сольватированными.
Сущность процесса электролитической диссоциации передает схема:
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

Электролиты и неэлектролиты
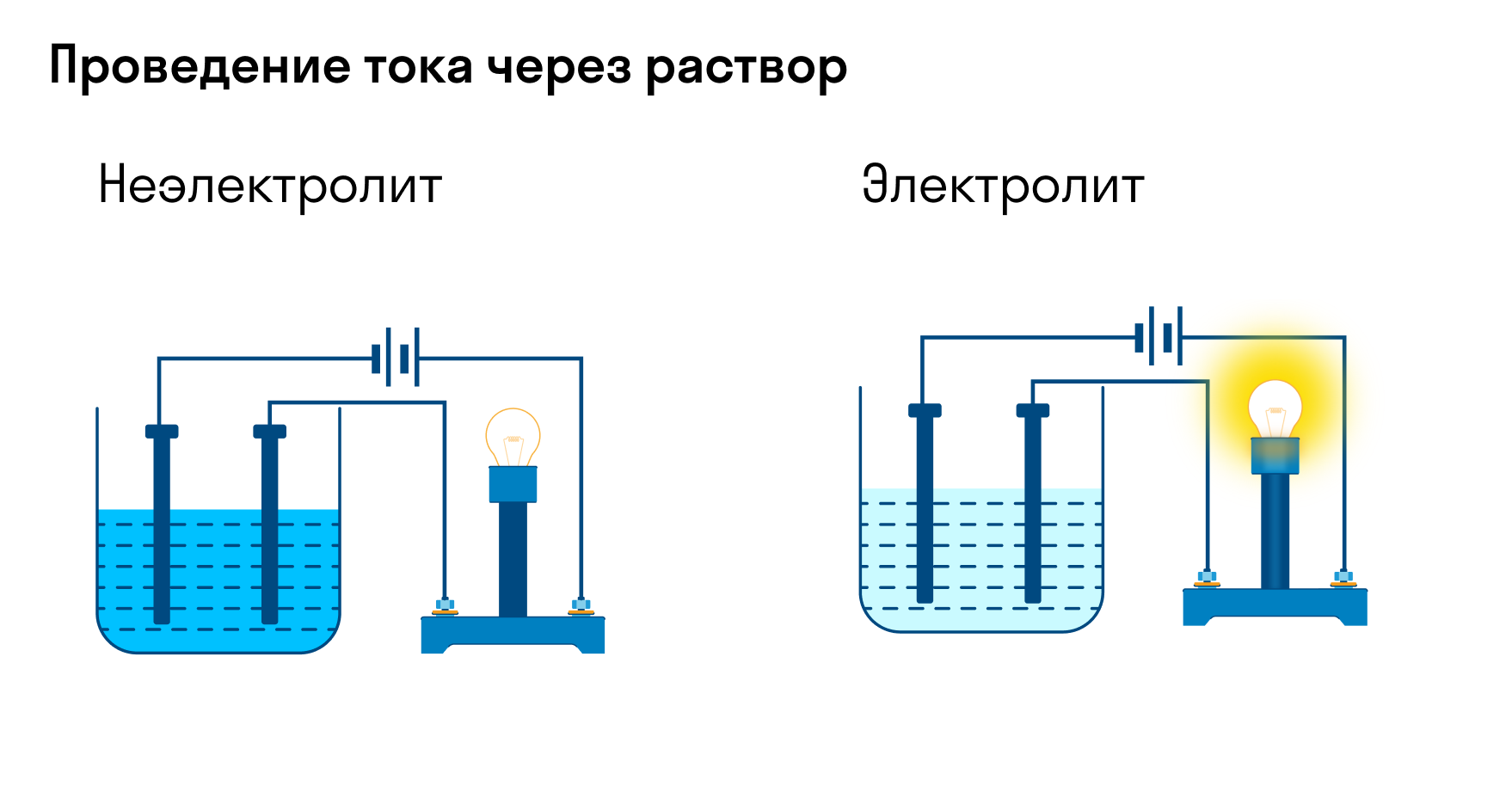
Хотя электролитическая диссоциация происходит независимо от действия электротока, между этими явлениями есть связь. Чем выше способность вещества распадаться на ионы при взаимодействии с растворителем, тем лучше оно проводит электроток. По такому критерию известный физико-химик М. Фарадей выделил электролиты и неэлектролиты.
Электролиты — это вещества, которые после диссоциации на ионы в растворах и расплавах проводят электроток. Обычно в их молекулах ионные или полярные ковалентные связи.
Неэлектролиты — это вещества, которые не распадаются на ионы в растворах и расплавах, а значит, не обладают проводимостью в растворенном виде. Для них характерны ковалентные неполярные или слабополярные связи.
Степень диссоциации
В зависимости от того, сколько молекул диссоциировало на ионы, вещество может быть сильным или слабым электролитом. Этот показатель называется степенью диссоциации, его измеряют от 0 до 1 либо в процентах.
Степень диссоциации — это отношение количества распавшихся на ионы молей вещества к исходному количеству молей.
Если в растворе на ионы распадаются все 100% электролита, .
По силе электролиты делятся на следующие группы:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Уравнение диссоциации на ионы ca hco3 2
Вопрос по химии:
6.2. Запишите уравнения электролитической диссоциации следующих растворов электролитов:Ca(HCO3)2
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
🌟 Видео
Механизм электролитической диссоциации. 9 класс.Скачать

Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Электролитическая диссоциация. Видеоурок по химии 9 классСкачать

Задание 13. Диссоциация, как писать уравнения диссоциации? | Химия ОГЭ | УмскулСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Задание 13: Все про электролитическую диссоциацию на ОГЭСкачать

Химия 9 класс (Урок№5 - Сущность процесса электролитической диссоциации.)Скачать

Электролитическая диссоциация | Химия ЕГЭ, ЦТСкачать

72. Электролитическая диссоциацияСкачать

Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

Теория электролитической диссоциацииСкачать

Химия. 9 класс. Теория электролитической диссоциации /04.09.2020/Скачать

Электролитическая диссоциация | Химия 8 класс #40 | ИнфоурокСкачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Реакции ионного обменаСкачать