Mn(NO3)2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Видео:Ba(NO3)2+NaOH=Ba(OH)2+NaNO3 Ионное и молекулярное уравнения реакции, демонстрация.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
Mn 2+ + 2NO3 — + HOH ⇄ MnOH + + NO3 — + H + + NO3 —
Сокращенное (краткое) ионное уравнение
Mn 2+ + HOH ⇄ MnOH + + H +
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
MnOH + + NO3 — + HOH ⇄ Mn(OH)2 + H + + NO3 —
Сокращенное (краткое) ионное уравнение
MnOH + + HOH ⇄ Mn(OH)2 + H +
Видео:Электролитическая диссоциация часть 2Скачать

Среда и pH раствора нитрата марганца (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Школе NET
Register
Do you already have an account? Login
Login
Don’t you have an account yet? Register
Newsletter
Submit to our newsletter to receive exclusive stories delivered to you inbox!
- Главная
- Вопросы & Ответы
- Вопрос 5413754
Мари Умняшка
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите диссоциацию следующих соединений Mn(NO3)2
Видео:9 класс. Электролитическая диссоциация. Образование ионов.Скачать

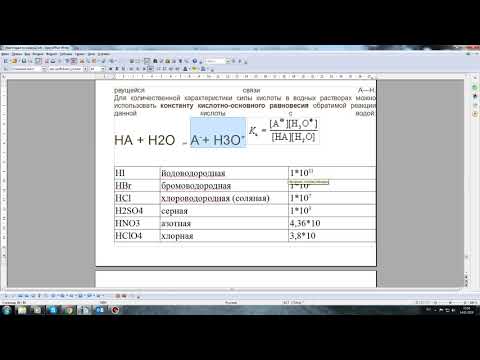
Константы диссоциации кислот и оснований в водных растворах
Читайте также:
|
| Вещество | Константа диссоциации | ||
| К I | К II | К III | |
| HF | 6,6 ∙ 10 -4 | — | — |
| HNO2 | 4,0 ∙ 10 -4 | — | — |
| H2S | 1,1 ∙ 10 -7 | 1,0 ∙ 10 -14 | — |
| H2SO3 | 1,6 ∙ 10 -2 | 6,3 ∙ 10 -8 | — |
| H2CO3 | 4,5 ∙ 10 -7 | 4,8 ∙ 10 -11 | — |
| H2SiO3 | 1,3 ∙ 10 -10 | 2,0 ∙ 10 -12 | — |
| H3PO4 | 7,5 ∙ 10 -3 | 6,3 ∙ 10 -8 | 1,3 ∙ 10 -12 |
| NH4OH | 1,8 ∙ 10 -5 | — | — |
| Cu(OH)2 | — | 3,4 ∙ 10 -7 | — |
| Fe(OH)2 | — | 1,3 ∙ 10 -4 | — |
| Fe(OH)3 | — | 1,8 ∙ 10 -11 | 1,4 × 10 -12 |
| Zn(OH)2 | 4,4 ∙ 10 -5 | 1,5 ∙ 10 -9 | — |
| Mg(OH)2 | — | 2,5 ∙ 10 -3 | — |
| Pb(OH)2 | 9,6 ∙ 10 -4 | 3,0 ∙ 10 -8 | — |
| Mn(OH)2 | — | 5,0 · 10 -4 | — |
| Al(OH)3 | — | — | 1,38 ∙ 10‾ 9 |
Ba(OH)2 и Mn(OH)2относятся к классу гидроксидов, являются основаниями, которые при растворении в воде под действием полярных молекул растворителя диссоциируют на ионы ОН — и ионы основного остатка. Формулы средних основных остатков приведены в верхней строке таблицы растворимости (табл. 3).
Ba(OH)2 — гидроксид бария,является сильным основанием (a=1), диссоциирует необратимо и в одну ступень с образованием двух ионов ОН — и одного иона основного остатка: Ba(OH)2 → Ва 2+ + 2ОН — .
Таблица растворимости солей, кислот и оснований в воде
| Катион | H + | K + , Na + | NH4 + | Mg 2+ | Ca 2+ | Cu 2+ | Zn 2+ | Mn 2+ | Fe 2+ | Fe 3+ | AI 3+ | Ва 2+ |
| Анион | ||||||||||||
| OH — | Р | Р | Н | М | Н | Н | Н | Н | Н | Н | Р | |
| CI — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р |
| S 2- | Р | Р | Р | ─ | ─ | Н | Н | Н | Н | Н | ─ | ─ |
| SO3 2- | Р | Р | Р | М | М | ─ | М | Н | М | ─ | ─ | Н |
| SO4 2- | Р | Р | Р | Р | М | Р | Р | Р | Р | Р | Р | Н |
| CO3 2- | Р | Р | Р | М | Н | Н | Н | ─ | Н | ─ | ─ | Н |
| HCO3 — | Р | Р | Р | Р | Р | ─ | ─ | ─ | Р | Р | Р | Р |
| SiO3 2- | Н | Р | Р | Н | Н | Н | Н | ─ | Н | Н | Н | Н |
| РО4 3 ─ | Р | Р | ─ | Н | Н | Н | Н | Н | Н | Н | Н | Н |
Р ─ растворимое вещество, М ─ малорастворимое, Н ─ нерастворимое, «─» ─ разлагается водой
Mn(OH)2 — гидроксид марганца (II),относится к слабым электролитам (табл. 1, 2), степень его диссоциации a + + ОН ─ ; К I Mn(OH)2 = 
Вторая ступень диссоциации Mn(OH)2 :
II. MnOH + ↔ Mn 2+ + ОН ─ ; K II Mn(OH)2 =
Na2SO3, NaHSO3, MnCl2, (MnOH)Clотносятся к классу солей, являются сильными электролитами, имеют степень диссоциации, равную единице. Соли диссоциируют необратимо и в одну ступень на основные и кислотные остатки (табл. 2).
гидросульфита натрия: NaHSO3 ® Na + + HSO3 — ;
хлорида марганца: MnCl2 ® Mn 2+ + 2Cl — ;
гидроксохлорида марганца: (MnOH)Cl ® MnOH + + Cl — .
Задание 2.Напишите молекулярные, полные и сокращённые ионно-молекулярные уравнения реакций взаимодействия между:
а) нитратом цинка и сульфидом натрия;
б) хлоридом аммония и гидроксидом калия;
в) карбонатом натрия и азотной кислотой.
Укажите причину протекания реакции двойного обмена между растворами электролитов.
Дата добавления: 2015-01-05 ; просмотров: 21 | Нарушение авторских прав
📹 Видео
Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Задача 12Скачать

ВСЯ ХИМИЯ С НУЛЯ! | Денис Марков | УмскулСкачать

ВСЯ ХИМИЯ за 8 класс в 1 уроке + таймкодыСкачать

КислотыСкачать

уравнения электролизаСкачать

Свойства кислот с точки зрения теории электролитической диссоциации. 9 класс.Скачать

Разбор реального варианта ОГЭ по Химии | Химия ОГЭ | NEON SchoolСкачать

Вторая часть экзамена по химииСкачать
Основные положения теории электролитической диссоциации | Химия 8 класс #41 | ИнфоурокСкачать

Основные положения теории электролитической диссоциации. Свойства ионов. 9 класс.Скачать

Сильные и слабые кислотыСкачать